このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
根切断術後の後根の軸索のライブイメージング
要約
アン in vivoでイメージングプロトコルが記述されています。手順は、広視野蛍光顕微鏡とTHY1 - YFPトランスジェニックマウスを利用し、CNSのインタフェースを持つPNSと軸索の相互作用が4cm以上の軸索再生の繰り返しイメージングを可能にする。
要約
脊髄神経根の損傷によって負傷した一次感覚軸索は、慢性的な痛みや永続的な感覚消失につながる、脊髄に再生に失敗する。脊髄への後根(DR)軸索の再生が後根エントリゾーン(DREZ)、CNSとPNSの間の界面で阻止される。神経損傷に関連する複雑な変更は事後解析から推定されているためDREZで再生を防止する分子や細胞のイベントの我々の理解は、部分的に、不完全です。このような軸索再生のようなダイナミックな細胞プロセスは、、最高の各生きている動物の複数の観測値とのリアルタイムイベントをキャプチャするテクニックを研究しています。 生体内で連続的にニューロンを監視するために我々の能力は、光学系およびマウス遺伝子組換えの革新的な技術革新に起因し飛躍的に増加している。 THY1 - GFPトランスジェニックマウスの数行は、神経細胞のサブセットを遺伝的に異なる蛍光色でラベル付けされている、個々の神経細胞がインビボ 1 で撮像される許可。これらのマウスは、筋肉の2-4と5月7日脳のin vivoイメージングのために広く使用されており、静的解析が解決していないことを生理学的メカニズムに新たな洞察を提供している。生きている脊髄の神経細胞のイメージング研究では、ごく最近になって始めている。リヒトマンと彼の同僚は、最初のワイド視野顕微鏡8,9で負傷した脊柱(DC)軸索を追跡することによって、その実現可能性を示した。深くに位置するDCの軸索のin vivoイメージング多光子、ミクログリアと血管はまた10を達成している。過去数年間、我々は広視野顕微鏡とTHY1 - YFPマウスのHのラインを使用してDRの軸索の再生を監視するためのin vivoイメージングに適用することに先駆けて。これらの研究は、DRの軸索は、脊髄11内に再生成が禁止されている理由についての小説仮説に私たちを導いた。
THY1 - YFPマウスのHラインでは、別個のYFP +軸索は、表面的にいくつかの軸索を同時に監視できるようになる、配置されている。我々はDREZに到着DRの軸索がより頸髄よりも腰椎でイメージングされたことを知りました。本報告では、我々は再生成DRの軸索の成功を長期的かつ繰り返しイメージングを確保するために有用な発見したいくつかの戦略を説明します。これらは、繰り返し挿管と呼吸の中断をなくす手術に伴うストレスや瘢痕形成を最小限にし、光毒性なしに高分解能で安定した画像を取り込む方法が挙げられる。
プロトコル
1。セットアップ顕微鏡とイメージングの準備
- 私たちのイメージングセットまでは、高速シャッターとMetamorphソフトウェアによって制御される冷却CCDカメラとライカMZ16蛍光実体顕微鏡で構成されています。
- ° C、動物の体温の間に、次の手術を維持するために、サーモスタット制御の加熱パッドを準備し、32.5に出力を調整します。
- 32.5℃まで手術中の脊髄の灌漑のための事前に暖かい滅菌リンゲル液または人工脳脊髄液(ACSF)。
- キシラジン(8 mg / kgの)とケタミン(120 mg / kg)のカクテルの腹腔内注射で動物を麻酔。
- 小動物のバリカンで背中を剃ると綿棒で剃毛面積以上の脱毛ローションの小さなドロップを広げる。分後、70%エタノールに浸したガーゼのスポンジを使用して適用ローションを削除します。
2。椎弓切除およびL5背根の外科的露出
- 温水(32.5 ° C)パッドの上に動物を配置し、70%エタノールに浸した綿棒で皮膚を消毒する。
- 背中の皮膚に - 実体顕微鏡で明視野照明の下、正中切開(3センチ〜2)を実行。必要に応じて、出血を止めるために綿棒を使用してください。
- 基本的な腰椎を公開するために脊髄の筋肉組織を反映している。
- 右両面半椎弓切除は、小さなrongeursを使用してL3 - S1脊髄セグメントを公開。腰仙骨脊髄の4-6セグメントを露出部分椎弓切除は、L2椎骨(2吻方腰の腸骨稜のレベル(L5 DRGの位置)でL5椎の右側の背の部分を削除して作成され最後の肋骨の椎尾)。暖かい滅菌リンゲル液で空洞を灌流。
- 脊柱をフラット化するサポートクッション(圧延コットンガーゼ)に動物を配置します。露出面積を広くするために撤回のフックを使用してください。
- この時点で(麻酔の最初のIP注射、サプリメント(0.5X)後約30分、動物は完全に麻酔を維持するために皮下注射する必要があります。代わりに、ガス麻酔(2から4パーセント0.5L/min酸素のイソフルラン)1時間以上の撮像セッション中に繰り返し麻酔のために使用することができます。
3。根切断術/後根粉砕
- YFP標識された(+)軸索を可視化する蛍光励起に切り替えます。
- サブQ(26ga.)針の先端を使用して、L5後根(DR)を覆う硬膜に小切開を行います。リンゲル液で繰り返し灌流と綿棒で軽く清掃。
- 押しつぶされるようにサイトを識別し、微細な鉗子(デュモン#5)subdurallyの片側を挿入する。
- 10秒間L5ルートの内側部を保持し、慎重に、しっかりと鉗子を閉じて、静かにピンセットを離します。
- 生理的溶液で繰り返し洗浄し、綿棒で軽く清掃。
4。画像取得と術後の手続き
- 前と右の両方が低いと高倍率でのクラッシュ後のクラッシュのサイトとDREZを含む全体の露出した領域の複数の画像を取得します。
- 画像は、単一のスナップショットとして、または30分以内に取得した10から20フレームの複数のストリームのいずれかとして取得される - 40ミリ秒の露光時間に。合焦画像は選択され、概要モンタージュは、後でPhotoshopを使用して作成されます。
- 瘢痕形成を最小限に抑えるために、しっかりと露出脊髄の上に、人工硬膜に続く細い合成マトリックス膜(Biobrane)の一部を、適用する。彼らは脊髄に付着しているように、露出した脊髄のウィンドウに正確に合うようにピースをカットしてください。
- 無菌5から0縫合糸で筋肉を閉じ、創傷クリップで正中切開を閉じてください。
- リンゲル液(0.3〜0.5 mLを皮下)注入、および皮下術後鎮痛(0.05 mg / kg)を2日間12時間ごとにブプレノルフィンを投与する。
- 回復するまで加熱パッド(34 ° -35 ° C)に動物を保管してください。
5。繰り返しイメージング
- 動物を麻酔し、傷のクリップおよび縫合糸を除去。
- 人工硬膜と薄い合成マトリックスの膜のパッチを削除し、後で再利用するためにリンゲル液を含有する滅菌チューブに保管してください。
- ゆっくりとサブQ針と細かい鉗子の曲がった先端で、蓄積されたすべての結合組織の瘢痕を削除します。暖かいリンゲル液で頻繁に灌流。
- クラッシュのサイトとDREZ含め、術野を再公開する、以前のセッションで結像されるYFP +軸索を再配置、および第4節で説明した手順を繰り返します。
6。代表的な結果:
我々は、彼らが切除傷害後の再生成していないのに対し、ほとんどすべてのYFP +軸索は、のサイトを通じて成長、ことを観察したクラッシュ後の3日間による傷害(図1)11。通常、クラッシュ後の次の日、我々は、近位断端軸索と軸索を適切に破損していることが確認さ粉砕、(; 3日目と5例、図1)の遠位同じ軸索の断片化/変性の死にバック変性を認め。いくつかの追加の基準が明確に脇に置いていたまたは負傷から回復していた軸索から再生軸索を区別するために適用されます。これらは以下のとおり(1)再生軸索は、クラッシュのサイトを補充蛍光細胞質に起因する未標識のギャップの狭小化とは対照的に近位と遠位部変性(による挫滅サイトでYFPの非蛍光部分+軸索の展開内容を見る軸索が損傷を)生き残った場合、(2)再生軸索は、あまり明るい蛍光、および傷害を生き残った軸索よりも起伏の非常に薄いです、(3)再生神経突起は薄くなり、軸索の変性蛍光フラグメントよりも薄暗い蛍光灯されるときに通過する(4)存続するか脇に置いて軸索とは対照的に、再生軸索はDREZで停止する;彼らが延長し、(5)対照的に存続または免れる軸索に、再生軸索は絞輪のノードを示していない。図1は、4つの表面的なYFP +直後にクラッシュ後の軸索(;色の矢印A1)を示しています。クラッシュの3日後、すべての4つの軸索は、クラッシュのサイトを通じて成長する(A2)、単一の神経突起を拡張。クラッシュ後の5日は、神経突起が安定していると、これらまたはその他の近位軸索(A3)からの追加の成長はありません。
クラッシュ(約3mm / 2日間)11日以降4日間として変性した軸索(すなわち、神経内膜の管)のはるかに厚いと明るい蛍光フラグメントを通して細長いクラッシュサイトを越え、そして早期にDREZに到着した再生神経突起。これらの軸索とその先端の繰り返しイメージングは、2週間以上(図2)に対しては2〜3日間は、彼らが前方に成長したり撤回していなかったことが判明、しかし不動のまま。唯一の顕著な変化は、いくつかの軸索の先端とシャフトの腫れていた。これらの観察は、それゆえDREZで再生軸索の驚くほど迅速かつ慢性的な固定化を示しています。
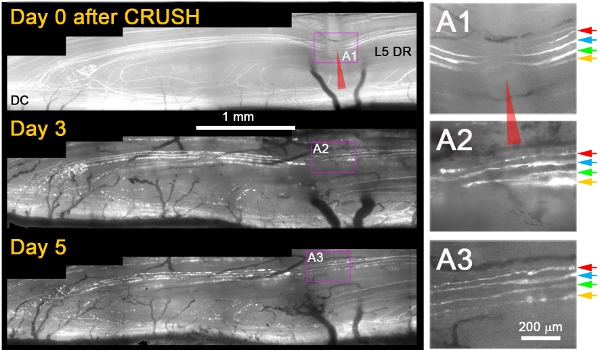
図1:5日間以上後根の粉砕のサイトでL5 DR YFP +軸索の繰り返しイメージング。 L5ルートの内側部は押しつぶさ(赤矢印)と0日目、3、、ときめき後の5上に結像された。クラッシュの面積は、右側のパネル(A1 - A3)で拡大されます。

図2:軸索の繰り返しイメージングがL5ルートのクラッシュ後の20日間DREZに到着した4日目 、三軸索(色付きの矢印は)DREZに到着した。これらの軸索の先端は、同じ場所に残り、7日、9、13、15、および20日に、その後のイメージングセッションで同じような外観を持っている。他の軸索のヒントやランドマーク(アスタリスク)に対して相対的軸索の先端の位置は、撮像セッションの間に軸索を運動性を決定するために使用された。
ディスカッション
それはその後のイメージングセッションで複数の手術侵襲と麻酔薬の手続きが続く広範囲に軸索の成長を監視するためにかなりの背側椎弓切除を必要とするため、直接生きているマウスのイメージングDR再生は特に困難である。いくつかの戦略は、これらの課題を克服する助け。最初に、成功したイメージングは、麻酔や出血の持続期間を最小限に抑えることにより、マウスの死亡率を?...
開示事項
利害の衝突は宣言されません。
謝辞
我々は、コメントと編集のヘルプは博士アランテスラーに感謝。この作品は、NIH NS062320によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| HラインTHY1 - YFP(2-4ヶ月齢、雌雄) | ジャクソン研究所(バーハーバー、ME) | 003782 | |
| キシラジン(AnaSed注射、滅菌溶液) | ロイド研究所、(シェナンドア、LA) | 4811 | 8 mg / kgを |
| ケタミン(塩酸ケタミン注射、USP) | ホスピーラ社(レイクフォレスト、イリノイ州) | 2051 | 120 mg / kgの |
| ブプレノルフィン(注射Buprenex)(0.05 mg / kg体重) | レキットベンキーザーティカルズ社(リッチモンド、バージニア州) | 7571 | |
| 小動物のバリカン | オスタープロフェッショナル、(マックミンヴィル、テネシー州) | 76059-030 | |
| 脱毛ローション | 教会&ドワイト共同(プリンストン、ニュージャージー州) | ベビーオイルとNairさん | |
| ガーゼのスポンジ | フィッシャーサイエンティフィック、(ピッツバーグ、ペンシルバニア州) | 22-362-173 | |
| 綿棒 | フィッシャーサイエンティフィック、(ピッツバーグ、ペンシルバニア州) | 14から960 - 3Q | |
| 1 mLのシリンジ | ベクトン、ディクソンと会社フランクリンレイクス、ニュージャージー州) | 309602 | |
| 皮下(サブQ)針、26ga。 | ベクトン、ディクソンと会社(フランクリンレイクス、ニュージャージー州) | 305115 | |
| 春のはさみや鉗子 | ファイン科学ツール、(フォスターシティ、カリフォルニア州) | ||
| 2.5 mmの湾曲したrongeurs | ファイン科学ツール、(フォスターシティ、カリフォルニア州) | 16221〜14 | |
| 乳酸加リンガー液USP | B. Braunはメディカル株式会社、(アーバイン、カリフォルニア州) | BBR - L7502 | |
| 滅菌生理食塩水 | APPファーマシューティカル(シャンバーグ、イリノイ州) | 918610 | |
| 薄い合成マトリックス膜(Biobrane) | Bertek医薬品、(ウェストバージニア州モーガンタウン) | 62794-096-251 | |
| 人工硬膜 | ゴアは、MVPデュラエースの代替、WLゴア&アソシエイツ、(フラッグスタッフ、アリゾナ州)を排除してください | 1MVP40 | |
| 5から0絹縫合糸 | エチコン社(サマービル、ニュージャージー州) | K - 580 | |
| 創傷クリップ | パーフェクト - ETSブリュノ、(Burnea、フランス) | A75 | |
| 蛍光実体顕微鏡 | ライカマイクロシステムズ、(ヴェッツラー、ドイツ) | MZ16 | |
| CCDカメラ | 浜松、(ブリッジウォーター、ニュージャージー州) | ORCA - Rx2の | |
| 温度コントローラ | 世界精密機器(サラソタ、フロリダ州) | ATC 1000年 | |
| Metamorphソフトウェア | Molecular Devices社、(サニーベール、カリフォルニア州) | ||
| フォトショップ | アドビシステムズ、サンノゼ、カリフォルニア州 |
参考文献
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i. in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved