Method Article
の生細胞イメージング枯草菌と肺炎球菌自動タイムラプス顕微鏡を使用して
要約
このプロトコルは、自動化された蛍光タイムラプス顕微鏡を用いて時間の異なる細菌の単セルの動作を監視するためにステップバイステップ手順を提供します。さらに、我々は、顕微鏡画像を分析する方法のガイドラインを提供します。
要約
ここ数年の間に科学者は微生物集団ベースの実験から得られた平均的なデータが単一の細胞の挙動、状態や表現型の代表ではないことをますます認識するようになりました。この新しい洞察による単一細胞の研究の数は、(最近のレビューのために1,2,3を参照)継続的に上昇する。しかし、適用される単一のセル技術の多くは、時間のある特定の単一のセル(例えばフローサイトメトリーまたは標準顕微鏡)の開発と動作を監視することはできません。
ここで、我々は多くの世代のための成長と分裂を介して枯草菌と肺炎球菌の個々の細菌細胞を以下のと(の蛍光)を記録できるようにいくつかの最近の研究4、5で使用される顕微鏡法、6、7、の詳細な説明を提供しています。結果として得られる動画は、1つの共通祖先に由来する集団内の単一セルの歴史をさかのぼることによって系統学的系統樹を構築するために使用することができます。このタイムラプス蛍光顕微鏡法は、個々の細胞の増殖、分裂と分化を調査するだけでなく、特定の細胞挙動のセルの歴史と祖先の影響を分析するために使用することはできません。また、タイムラプス顕微鏡は、理想的には細菌の細胞周期の間に遺伝子発現のダイナミクスとタンパク質の局在を調べるために適しています。方法は、細菌の細胞を調製し、微小コロニーに単一細胞の伸長を有効にするために顕微鏡スライドを構築する方法を説明します。一言で言えば、単一の細胞は、彼らが成長し、温度制御された環境室内で蛍光顕微鏡下で割っているアガロースを添加した増殖培地から成る半固体表面上にスポットされています。画像は特定の間隔でキャプチャされ、後にオープンソースソフトウェアImageJを用いて解析している。
プロトコル
1。 B.の準備枯草菌の培養
- 10ミリリットルタイムラプス顕微鏡(TLM)培地(62 mMのK 2 HPO 4、44mmのKH 2 PO 4、SO 4 15mMの(NH 4)2、6.5 mMクエン酸ナトリウム、0.8 mMで-80 ° C株からの細胞を接種するし、MgSO 4、0.02%カザミノ酸、27.8 mMグルコース、0.1 mMのL -トリプトファンは、pHを、必要に応じて抗生物質を補充したKOH溶液)を使用して、7に設定されていました。
- 振盪フラスコ(30℃、225 rpmで)で一晩細胞を成長させる。
- 翌朝、予め温めておいた化学的に定義された培地(CDM)(62 mMのK 2 HPO 4、44mmのKH 2 PO 4、15mMの(NH 4)2 SO 4、6.5 mMクエン酸ナトリウム、0.8で1:10に細胞を希釈mMのMgSO 4を用い 、2.2mmのグルコース、2.1 mMのL -グルタミン酸、6μMのL -トリプトファン、7.5μMMnCl 2を 、0.15 ×メタルミックス(含まれている50倍MTミックスの株式(REF 8)準備:0.2 M のMgCl 2、70 mMの抗生物質なしのCaCl 2、5mMのMnCI 2、0.1mMのZnCl 2を 、0.2mMのチアミン塩酸、2mMの塩酸、0.5mMのFeCl 3を (最後の追加))。
- B.を育てる中期指数期(30℃、225 rpmの)に枯草菌の細胞。通常、これは約4時間かかります。細胞は中期指数期に到達する前に重要なことは、(セクション2を参照)アガロースのスライド一時間を準備する。
- 600nmの(A 600)で、文化の吸光度を測定し、CDMを用いて0.035の近似値600に細胞を希釈する。このODは、適切な間隔を持つ単一の細胞をタイムラプス顕微鏡用顕微鏡スライド上にスポットされることが保証されます。
2。顕微鏡の試料の調製(また図2を参照)
細胞は半ば急激な増加に達する前に1時間は、次のように顕微鏡のスライドを準備します。
- 70%エタノールと水で2顕微鏡のスライドガラス(例えばクニッテルガラス、7.6 × 2.6 cmの)清掃してください。
- 遺伝子のフレーム(ABgene、1.7 × 2.8 cm)を取り、慎重に遺伝子のフレームの反対側にあるプラスチックカバーの逆アセンブルを引き起こすことなく、遺伝子のフレームからプラスチック製の箔の1つを削除します。
- 指の爪で、残りの遺伝子のフレームのガイド付きの添付ファイルが続く、片側だけの最初の促進の接触によってスライドガラスのひとつの中央にある遺伝子のフレームを取り付けます。スライドガラスへの遺伝子のフレームを装着しながら、気泡を防ぐ。
- 150 mgの(1.5%)を10mLのCDMにおける高解像度低融点アガロース(Sigma)を溶解するためにマイクロ波を使用してください。アガロースは、タイムラプス顕微鏡実験に必要な最小限の背景を得るために、完全に溶解する必要があります。必要に応じて、この時点でインデューサーまたは他の化合物をアガロース- CDMを補完
- 遺伝子のフレームの中央に温かいアガロース- CDM 500μLを転送する。 (ボーダー)を含む地域全体が完全に覆われていることを確認します。
以下のステップ(2.6から2.10に)アガロース- CDMの過度の乾燥を防ぐために迅速に実施する必要があります。 - アガロース- CDM満たされた遺伝子のフレームの2番目のスライドガラスを配置。空気の泡を避けるためにしてください。 4℃で45分間水平に挟まれたスライドを配置° Cアガロース- CDMが十分に固化できるように、冷蔵庫インチ
- 慎重に上部ガラススライドを外します。細胞が増殖されるの遺伝子のフレーム内に〜5mm幅の寒天片を切り出すためにカミソリの刃を使用してください。 threeストリップの最大は、どちらかの側に〜4 mmのスペースで区切って、スライドごとに使用することができます。これらのスペースは、B.のために不可欠な空気を提供します枯草菌の成長。つの異なる株が時間内に従わなければならない必要がある場合は、2つのストリップを行うことができると四つの小正方形をもたらすことが半分に短縮する。任意の残留固形培地を削除します。
- 慎重に遺伝子のフレームの粘着面を露出させる遺伝子のフレームから2番目と最後のプラスチックカバーを取り外します
- ピペットチップでそれに触れることなく、固体培地上での単一のセルを(ステップ1.5から)ロードする。全体ストリップ、または小さな正方形の1μLを2.5μlを使用する。常にアガロースパッドの上に起動して、液体が上下にスライドを回して、割り当てられた成長領域に均等に分散することができます。スライドの準備ができている、とすぐに液体のエッジのような段ボールになって、スライドをめくるときの液体の動きは、もはや目に見えるではありません。
- 一方から他方への遺伝子のフレーム(気泡を避けるため)でクリーンな顕微鏡スライドカバースリップを(24 × 50mm)を置きます。指の爪で遺伝子のフレームに沿ってカバースリップに圧力を加えて完全な添付ファイルを確保。カバーガラスは、それらが十分に長い乾燥させることなく、セル上に配置されている場合、細胞は、実験中に互いの上に成長する傾向がある。また、アガロース、その後乾燥しすぎになるので、カバースリップを適用する前に、あまりにも長く待つように注意してください。
- 30℃で1時間プレ暖かいスライド℃にスライドwにオールドは、直接顕微鏡の予め温めておいた環境室(ステップ3.1参照)に配置すること、温度の変動は、実験の最初の数時間でオートフォーカスの問題が発生する可能性があります。
3。タイムラプス蛍光顕微鏡(また、図3とムービー1を参照)
- 実験を開始した後にオートフォーカスの問題を防ぐために、時間に関する環境室(実験の開始前に、私たちの手で少なくとも2時間)を事前に温めてください。必要な時間は、使用環境室だけでなく、暖房装置や顕微鏡に依存します。
- あなたの実験のセットアップに応じて適切な目標、フィルタおよびダイクロイックミラーを選択します。長い実験のためにUVフィルターは、光源と試料の間に配置されていることを確認します。また、可能であれば、露出を最小限に抑えるためにNDフィルターを使用して励起光の一部をブロックする。
次の機器(DeltaVision、英国で提供される)デヨングらに公開されてタイムラプス顕微鏡実験に使用した2010 5:。IX71顕微鏡(オリンパス)、CoolSNAP HQ2カメラ(プリンストンインスツルメンツ)、300Wキセノン光源、60倍明るいフィールドの目標(1.25 NA)、GFPフィルタセット(クロマ、40分の470 nmで励起、発光50分の525 nm)を、mCherryフィルタセット(クロマ、35分の572 nmで励起、発光60分の632 nm)を。オートフォーカスはdiascopic光を使用し、DeltavisionのSoftworxソフトウェアのオートフォーカスのルーチンの存在を用いて行った。また、このようなツァイス確実なフォーカス、ニコンパーフェクトフォーカスシステムとライカ適応フォーカスコントロールとして適している他のオートフォーカスシステムの数が今あることに留意すべきである。
- あなたの実験セットアップに応じて、実験をプログラムする。それは前に実際の実験に他のタイムラプス顕微鏡や細菌のために特定の構造に必要な光の量だけでなく、オートフォーカス設定を決定するのが賢明です。短い露光時間と励起光の少ない量で漂白し、光毒性を最小限に抑えることができます。オートフォーカスのルーチンのためdiascopic光を使用してください。
以下の設定がデヨングらに公開されてタイムラプス顕微鏡実験に使用した2010 5:。映画のためのスナップショットがAPLLCホワイトは、明るいフィールドピクチャ用のライトと0.05秒露出をLEDの10%を使用して8または12分の間隔で採取されたそれぞれ10%GFP検出用のキセノンライトと0.5秒露出、およびmCherryの検出は32%キセノン光と0.8秒露出、。生データはsoftWoRx 3.6.0(応用Presicion)を使用して保存されていました。オートフォーカスは0.06μmのステップと1.2μmの合計範囲にプログラムされました。
- 顕微鏡の予め温めておいた環境室で準備したスライド(セクション2)を置き、30℃で微小コロニー単層に単一細胞の伸長を監視℃を
特定のヒント:
- 寒天パッドの中央に配置されている単一のセルを選択します。寒天のエッジがより簡単に完全に乾くパッド。顕微鏡のソフトウェアを使用してX、Y、Zの位置を格納します。
- X、Y、Z方向におけるステージの大きな動きは、アガロースを摂動し、結果的にオートフォーカスのルーチンによって細胞の同定を妨げるかもしれない。スライドに複数の菌株が含まれていても一般的に、X、Y、Zの動きを最小限に抑えるために、我々は実験ごとに10以上のポジションを選択しないでください。
- 最初のセルを選択した後、ソフトウェアだけでZ -ピントを合わせます。この点から、これはデジタルでエンコードされていない限り、"Z -ノブ"を使用して、顕微鏡本体に手動でフォーカスを変更されることはありません。それぞれのオートフォーカスのルーチンの後に新しいX、Y、Zの位置はソフトウェアで保存されていることを確認。
- 実行を開始する前に、オートフォーカスの設定は、実験に適しているかどうかを確認してください。位相差顕微鏡の使用は、拡張されたコントラストのため、明視野またはDIC顕微鏡を使用した場合と比較してオートフォーカスのルーチンを、改善される可能性があります。しかし、位相差の目標の位相リングは蛍光光を収集する(約10%)にはあまり敏感になります。非常に弱い蛍光サンプルのため、位相リングのない目標は適しています。
- 実験は、安定的に実行されるまで、選択された細胞は、30分おきに集中可能かどうかを確認してください。この時点でセルがフォーカスから外れているときは、手動で調整します。温度の変化だけでなく、不完全に乾燥試料に起因する、これが最初の数時間の間に必要となる場合があります。より多くの細胞が視野にある場合さらに、強化されたコントラストのために、オートフォーカスがうまく動作します。
- 実験が終了した後、必要な場合は、別のファイル(すなわち位相コントラスト、GFP、mCherry)として映画とその安全性の異なるチャネルを分離する(特定の買収のパッケージは、単一のスタックファイル内のすべてのチャンネルを配置します)。パブリケーションの場合、写真は特に私達である2Dデコンボリューション、向上させることができるタンパク質の局在の研究のためのeful。お使いの顕微鏡のソフトウェアを使用して画像をデコンやホイヘンス(のような商用パッケージとwww.svi.nl )。
- ImageJの(使用してデータ分析するhttp://rsbweb.nih.gov/ij/ )(このために生の、未処理の画像ファイルを使用)およびMicrosoft Excelまたはシグマプロットを。スタックは、例えばImageJのでは"。aviファイル"ムービーファイルとして保存することができます。時間で測定する方法を蛍光単一細胞のの詳細な説明を以下に示します。
4。 ImageJを用いたプロモーター活性の動力学のデータ解析
我々は他の優れたソフトウェアパッケージは、そのようなBHVソフトウェア9、4、Schnitzcell 10、PSICIC 11、および微生物-トラッカー12としてタイムラプス顕微鏡画像を解析することに特化したが、ここでは自由に利用できるImageJのパッケージに集中している利用可能であることに注意してください。
- imagejのダウンロード( http://rsbweb.nih.gov/ij/ )と(必要に応じて)あなたの(スタック)ファイルを開くために適切なプラグイン。例えば、映画はdeltavision顕微鏡を使用して記録だけdeltavisionオープナープラグインでImageJのに開くことができます。 ImageJのプラグインフォルダ内のDV - pluginをコピーして、プログラムを起動します。 1250編集/オプション/メモリ&スレッドでメモリ容量を変更する。これは、タイムラプスムービーから得られたものなどの、より大きなファイルで作業することができます。
- 単一のセルのセルの履歴を評価するために、一微小コロニーと映画への関心の最後のフレームにスクロールの元位相コントラストムービーを開きます。メニューの"セグメント化された行を"選択ボタンを選択します。
- 背景の線を引くと、"CTRL"+"T"を押してください。これは、対象(ROI)マネージャの領域を開きます。 (対応するバックグラウンド蛍光値は手動でバックグラウンドを減算するために使用することができる - 。。下記参照また、ImageJの中でバックグラウンド減算ルーチンの存在を使用)また、目的の細胞に線を引くとROIマネージャーにROIを追加します。我々はこのケーススタディでプロモーター- GFPの融合を検討していると、GFPが細胞質全体に拡散されているので、全体のセルは、セルの長さにわたってそれぞれ一つのピクセルのために同様の蛍光値を持つ必要があります。時間に戻って一つのフレームをスクロールし、興味の同じセルに新しいROIを選択してください。この第三のROIを保存し、ムービーの最初のフレーム内の対応するROIが保存されるまで、手順を続行します。
娘細胞の蛍光は、細胞分裂後に大幅に変化する場合があることに注意してください。どちら隔膜形成を可視化する細胞(例えば、赤膜色素FM ® 5〜95(Invitrogen社)とGFPの組み合わせなど)によって生成された蛍光タンパク質と一緒に適用することができる膜の色素を使用してください。この場合、対応する蛍光チャネルではなく位相コントラストの映画は時間で細胞をフォローするために使用する必要があります。別の方法として、セルの半分だけでROIのを選択することにより、安全側に滞在することができます。 - ROIマネージャー内で、"保存"をクリックします。ファイルの終わりが"。ROI"している場合、1つROIがリストで選択されている、とこれだけが保存されます。ファイルの終わりが"。ZIP"の場合、セット全体が(必要な)保存されます。
- 位相コントラストムービーを閉じて、オリジナルの蛍光映画(例えばGFP)を開きます。 "すべて表示"をクリックして、ROIマネージャーの"尺度"。新しいウィンドウが(結果)が開きます。 Excelシートに結果をコピーし、培地のバックグラウンド蛍光から各単セルの平均蛍光を引きます。結果として得られる正味の蛍光は時間で目的の細胞のプロモーター活性を明らかにするために、時間に対してプロットすることができます。
- また、微小コロニーのすべての細胞の蛍光は、特定の時間ポイントで分析することができます。バックグラウンドのROIのと前述のように一つのフレーム内のすべての単一のセルを、これを選択して保存していないためには、Excelに蛍光値をコピーして、"ツール"メニューの"ヒストグラム"機能を使用してヒストグラムを生成する。
- パブリケーションごとに単一のフレームから画像を取得するには、関心のフレームを選択し、"画像"を選択してください - "画像を複製"と"画像"を選択して"RGB"または"8ビット"に画像の種類を変更 - "タイプを" - "RGBカラー"または"8ビット"。 "。TIFF"などの重複フレームを保存します。 RGB/8-bitの写真は、CorelDrawのやAdobe Illustratorなどの従来の描画プログラムで開くことができます。 "調整" - - "明るさ/コントラスト"や"画像" - "調整" - "ウィンドウ/レベル"ImageJのに必要な場合、画像は"画像"を使用して適合させることができる。
5。 ImageJを持つパブリケーションのために映画を制作
- 上記のようにImageJの中のオリジナルの位相差と対応する蛍光ムービー(複数可)を開きます。開発微小コロニーがROI throuによって囲まれていることを、長方形の選択ボタン(左側の第1回) を選択して、そのような方法で、最初のフレームの四角形のROIを描く映画全体ghout。 "作物"と新しい名前の下に映画の安全にこの小型版 - "画像"を選択します。蛍光ムービー内のROIのマネージャーを介して同じROIを選択して、前の手順に従います。
- "スタックのコンバイナ" - 水平または垂直にムービーを結合するには、"プラグイン"を選択します。 "タイムスタンパー" - 必要に応じて、タイムスタンパを"プラグイン"を経由して追加することができます。として一度組み合わせたスタックを保存"。DV"または"。TIFF"と一度としては、"。aviファイル"またはQuickTimeムービーが。
肺炎球菌の代替プロトコルの適応(図4およびムービー2):
6。 S.の準備肺炎の文化
- S.の成長37 肺炎細胞 (莢膜菌株D39 13、またはカプセル化されていない菌株R6 14 C + Y媒体15に立って文化としての°に到達する約0.4の600nmのでODまで、Cは。14000rpmで2分間、細胞を遠心分離し、再懸濁細胞を正確に0.4 600nmのに結果となる14.5%グリセロール(v / v)を含有する新鮮なC + Y媒体の体積のペレット。注し、細胞と-80に保存する·今後の使用のためのC。
- タイムラプス顕微鏡の場合は、以前に培養S.のアリコートを取る肺炎球菌の細胞。 -80 ° Cの一定量の細胞の新鮮なC + Y媒体1:100 4mlを接種する。 0.2から0.1までの600nmのODに半ば指数増殖期までの細胞を成長させる。 -80 ° Cのアリコートから細胞を使用する場合は、通常、これは約2時間かかります。
7。顕微鏡の試料の調製
- B.については前述のように顕微鏡のスライドを準備する枯草菌は、しかし、アガロースは、複雑なC + Y媒体が含まれていることを確認してください。 S.以来肺炎は微好気性菌であり、アガロースストリップの間に空気のポケットは、Bのより小さくする必要があります枯草菌 (両側〜1 mmのスペース)。
- の600 nm(A 600)で、文化の吸光度を測定し、おおよそ600℃+ Yの培地を用いて0.05に指数関数的に成長している肺炎球菌の細胞を希釈し、アガロースのスライドをロードするには、この希釈を使用してください。
8。タイムラプス位相差顕微鏡
S.用顕微鏡の設定を調整肺炎球菌:S.から使わ位相差顕微鏡肺炎は、明視野顕微鏡を使用して識別することは困難です。 B.で説明したようにプロトコルを続ける枯草菌 (ステップ2.9に従っ- 3.7)。S.肺炎球菌の細胞が30のいずれかで成長することができます° Cまたは37 ° C(彼らは37℃で急速に拡大)。
9。代表的な結果:
細菌が完全に(図5A - Cを参照)、実験の終了時に視野内に配置されている微小コロニー単層、に成長した場合タイムラプス蛍光の実験は、うまく行われている。細胞はお互いの上に成長した場合、それだけで正確に彼らの歴史をさかのぼって追跡することは不可能であるだけでなく、重複する細胞の蛍光レベルを正しく測定することはできません。培地組成が遅い成長を得るために調整する必要がある場合は、斑点のある細胞が十分に乾燥させ(ステップ2.9)またはされていない場合の細胞は、お互いの上に成長する傾向がある。微小コロニーがビューから生まれた場合、一方のコロニー内の蛍光シグナルの分布を決定することはできません。 "微小コロニーの動き"の原因としては、斑点の細胞の不十分な乾燥(ステップ2.9)することができます、またはソフトウェアは、開発中に微小コロニーを追跡するようにプログラムされていない場合。さらに、これは細胞(図5D - Fを参照)からの蛍光信号を不明瞭になるように増加した蛍光のローカルパッチが培地中に検出できないことが重要です。背景関連の問題は、メディアの化合物、airbubblesまたは未溶解のアガロースの塊から生じることもできます。これを可視化するために、我々は図に示す。画像は赤色蛍光色素の励起/発光フィルターを用いて撮影されたこの特定のスライドの5Fのバックグラウンド信号。見られるように、明るい自家蛍光スポットがイメージングを妨げる可能性危険があります。このようなスポットを防ぐために、アガロースが完全に溶解し、顕微鏡のスライドにカバースリップを配置することもairbubblesがないことをされていることを確認します。
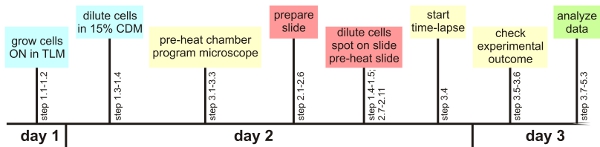
図1:実験概要

図2:顕微鏡の試料の調製
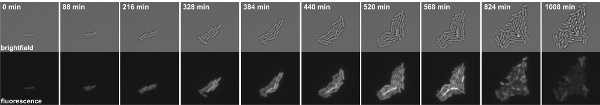
図3:Bのタイムラプス蛍光顕微鏡P kinB - GFPの融合を保有する枯草菌の細胞。スナップショットはムービー1から取得されます。トップパネル:明視野、下のパネル:GFPのチャンネル。
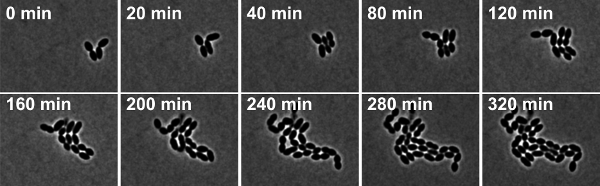
図URE 4:S.のタイムラプス位相差顕微鏡肺炎野生型株R6。スナップショットはムービー2から取得されます。
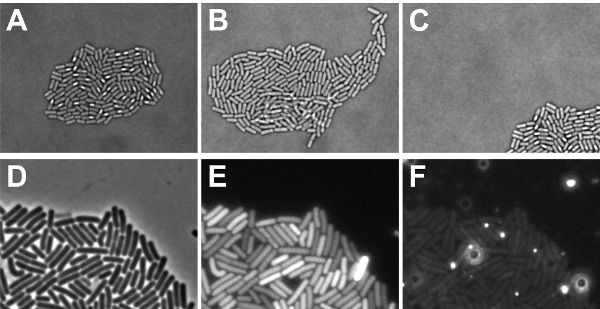
図5:可能(時間経過)顕微鏡の成果のイラスト。 ACはdiascopic光の設定で得られたデータを考慮する必要がある要因を示しています。 B.の胞子形成の微小コロニーの単分子層の(A)明視野顕微鏡写真(肯定的な結果) 枯草菌の細胞(B)Bの明視野像胞子形成B.の枯草菌のいくつかの細胞は互いの上に成長した微小コロニー(否定的な結果)(C)明視野像焦点のフィールド(負の結果)から生まれた枯草菌の微小コロニー。 B.のepiscopicライト設定(D)位相コントラスト画像で得られたデータを考慮する必要があるDFのショーの要因EとFの蛍光シグナルがバックグラウンドシグナルが各ピクセル(肯定的な結果)に類似していることD.注に示されているセルの(E)GFPシグナルに由来どこ可視化するために描かれた数期の菌細胞。また、一つのセルに背景が増加赤色蛍光レベル(ある地域が含まれていることD.注に示されているセルの赤のチャネルを介して得られる飽和信号(負の結果)(F)信号を示していますので、露光時間が多すぎるかもしれないことに注意して負転帰)。
B.のムービー1。タイムラプス蛍光顕微鏡P kinB - GFPの融合を保有する枯草菌の細胞。スナップショットは8分間隔で撮影されました。左:明視野、右:GFPチャンネル映画を鑑賞するためにはここをクリックしてください。
S.の動画2。タイムラプス位相差顕微鏡肺炎野生型株R6。スナップショットは10分間隔で撮影されました。 映画を見て、ここをクリックしてください。
ディスカッション
他の多くの単一のセル技術とは対照的に、ここで説明するタイムラプス蛍光顕微鏡法は、その祖先、その動作、および除算イベントに関する特定のセルの履歴をたどるために使用することができます。蛍光標識した標的プロモーターまたはタンパク質と組み合わせることで、特定の発生経路の活性化は、時間とタンパク質の局在ならびにタンパク質のダイナミクスは、細菌の開発時に監視することができるで追跡することができます。
上記に示したように、別の細菌種に集中して研究は特定の細菌の要件に応じて増殖条件を適応することによって行うことができます。我々が遭遇した唯一の制限は、成長条件とサンプルサイズに関連しています。密閉された環境のために、培地条件が実験中に変更することはできません。また、実験ごとに4つの系統の最大は、効率的に監視することができます。
いくつかの重要なステップを考えると、ここで説明する単一細胞解析の手法は、容易に自動化された顕微鏡を使用して適用することができます。以下では、これらの重要な手順の概要が与えられます。詳細情報は、メインテキストに記載されて一般的な準備が:それは前の実験への特定の細菌のために必要なオートフォーカスの設定を確認するのが賢明です。可能であれば同様に、蛍光の可視化のためのおおよその最適な設定は、事前に決定されるべきである。また、準備したタイムラインは時間ですぐに使用できるすべての材料を持ってするのに役立つ、以下の(スライド1時間の準備を、顕微鏡の設定をプログラミング、顕微鏡室を事前に温めて細胞は、目的の増殖期になる前に、図1を参照) B.の 。 成長TLMとCDMの枯草菌 :TLMとCDMが化学的に定義されている飢餓の媒体Bの枯草菌はゆっくりと成長。細胞を培地で栽培される時間期間は、特定の菌株によって延長する必要がある場合があります。低成長がお互いに積み重ねから細胞を防止顕微鏡の試料の調製は:。遺伝子のフレームの間に空気の泡を、スライドガラスとカバーガラスは、アガロースベースの媒体の広範囲な乾燥を防ぐために防止する必要があります。同じことはミディアム/カバースリップのインタフェースにも当てはまります。それは水泳および/ または複数の層の成長を防ぐために、細胞が十分に乾燥させることが重要ですタイムラプス蛍光顕微鏡:。スライドだけでなく、環境室の前の温暖化が主要なオートフォーカスの問題を防ぐために重要である。これらは(サンプルが十分に乾燥させて提供)実験中にフィールドとフォーカスに滞在する最高のチャンスがあるので、細胞は、寒天のパッドの中央に選択する必要があります。実験ごとに10カ所の最大は、まだ正しく動作します。興味のある最初のセルを選択した後のみ(詳細は本文を参照)フォーカスを調整するためのソフトウェアを使用しています。 。細胞は30分間隔での実験分析の最初の数時間中にフォーカス可能かどうかを確認してください:それは媒体の背景が蛍光チャンネルで同じような値を持っているかどうかを事前に拡張された分析手順に確認することが重要です。小さ な塵の粒子が、培地成分、汚れたレンズまたは小型アガロースの塊は、 トラブルシューティングを分析するために映画が困難または不可能に、局所的に増大した蛍光に貢献することができます。細胞は互いの上に成長した場合、これはどちらかのカバースリップがあったことを示すかもしれません早すぎるか、そのメディアが微小コロニー単分子膜の成長に適していない添付。スライド上の他の細胞が喜んで分割するのに対し、関心の細胞は連続して、途中で死亡した場合、あなたは位置にUVフィルターを置くかどうかをチェックすることがあります。また、長時間の実験中に、露光時間や光強度を減少させるために役立つかもしれない。
開示事項
利害の衝突は宣言されません。
謝辞
JWVのグループでの作業は、EUのマリーキュリー復帰フェローシップ、Sysmo2グラント(NWO-ALW/ERASysBio)、ホライゾン助成金(ZonMW)でとVENIフェローシップ(NWO - ALW)によってサポートされています。 OPKのグループは、いくつかのSTWの助成金(NWO)、SYSMO1(IGdeJ)とSYSMO2助成金、ESF Eurocoresシンバイオ助成金(SynMod)でと工業的発酵食品と栄養のトップ研究所のゲノミクスのためのKluyverセンターによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| 遺伝子のフレーム | ABgene | AB - 0578 | 1.7 × 2.8センチメートル |
| 高解像度の低融点アガロース | シグマ | A4718 | |
| 大きなカバースリップ | いくつか | 24 × 50ミリメートル | |
| 必要に応じて、膜色素、例えば、FM 5から95 | インビトロジェン | T23360 | 他の膜の染料も使用可能です。 http://probes.invitrogen.com/media/pis/mp34653.pdf |
| 環境室とのタイムラプス顕微鏡 | いくつか | 対応するセクションで我々のデバイスの詳細を参照してください。 |
参考文献
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. lopis P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved