このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
修正Zigmondチャンバーアッセイを使用してトランク神経冠細胞移動の解析
要約
植された細胞(幹神経堤細胞)の移行を解析するアプローチが説明されています。この方法は、安価な優しい、そのような主要なトランク神経堤細胞培養内細胞間相互作用に由来するもののような渡り鳥の極性にケモキネシスと他の影響の両方からの走化性を区別することができる。
要約
神経堤細胞は(NCCS)上皮間葉移行1,2を経て神経管背側(NT)から移住している脊椎動物の発生中に存在する細胞の一時的な集団である。彼らは目標に到達するまで、EMTに続いて、NCCSは常の経路に沿って長い距離を移行します。 NCCSは、ニューロン、グリア細胞、メラノサイト、および1-3クロマフィン細胞を含む細胞型の広大な配列に分化する。それらの適切なターゲットの場所に到達し、認識するNCCSの能力はトランク部品3 NCC由来を含むすべての構造の適切な形成のための基礎的です。トランクNCCの移行のための指導のメカニズムを解明すること、したがって非常に重要な問題となっています。多数の分子がNCCの移行4を導くことが実証されている。たとえば、トランクNCCSは、セマフォリン、エフリン、スリットリガンド5月8日のような負の指導の手がかりではじかれることが知られている。ただし、いない最近までトランクNCCS任意の化学誘引物質は、9同定されている。
付着細胞の走化性行動の研究にvitroアプローチで、従来は不死化、均一に分布細胞で最適に動作しますが、最初は均一な分布を欠いており、急速に分化する(例えばNCCSなど)特定の主要な幹細胞培養物に適用することがより困難である。走化性研究のためにトランクNCCSの分布を均一化する一つのアプローチは、持ち上げると、それらはほぼ100%コンフルエントになるようにreplate次に、プライマリNTの外植培養からトランクNCCSを単離することである。しかし、このメッキのアプローチは、時間と労力のかなりの量が十分な細胞を植する必要が過酷であり、 インビボ条件下で見つかっに異なる方法でトランクNCCSを配布しています。
ここでは、requirinずにトランクNCCSの走化性および他の渡り鳥の応答を評価することがin vitroでのアプローチを報告GA均質な細胞分布。この手法は、修正Zigmondチャンバー(標準Zigmond室は別の場所で10記述されています)内部トランクNCCS乱れのない、原発のタイムラプスイメージングを利用しています。彼らの自然な方向性予測に垂直であるchemotactantグラデーションに文化の周縁部にトランクNCCSを公開することにより、適用されたchemotactant勾配によって誘起される渡り鳥極性の変化を検出することができる。この手法は、レプリケート処理あたり2つだけのNT外植片の培養を必要とする過酷な細胞リフティングを(例えばトリプシン処理など)を回避し、植と実験の間の時間が削減され、in vivo条件下でより同様の分布にトランクNCCSを残し、安価である(おそらく差別のリスクを軽減している)、および多数の渡り鳥の特性の経時的評価を可能にします。
プロトコル
1。 1日目:カバースリップ上で一晩培養した培養液のトランク神経管の分離
- 38℃56時間、ニワトリの卵をインキュベート℃でインキュベーションから卵を取り出し、穏やかに70%エタノールを用いてそれらをスプレーして、それらを乾燥させます。紫外線滅菌ガラストレイに開いた卵を割る。
- その卵黄から各胚を解凍して、ひよこリンゲルに配置します。湾曲したハサミでその血島の周りに第一切断することによってこれを行うにしてから、鈍鉗子で、その胚体外膜によって胚を拾うとひよこリンゲル液を含有する滅菌プラスチックシャーレに入れてください。
- 過剰な胚体外膜をオフトリミングだけでなく、タングステン針(図1)を用いて、脳神経迷走神経および仙骨軸方向のレベルにより、各胚の幹を分離します。まず、ステージHH15-17 11の間にある約9胚を選択します。アップステージHH15とは、前脳と後脳の軸は鋭角を形成するので、頭が尾側に傾いて見える。にステージHH17は、尾芽が存在していて、腹側に傾くが、まだ体節が含まれていません。タングステン針を使用すると、胚から約2mmに胚体外膜を切り落とすと10体節の前方任意胚組織を切り落とした。また、第五最も新しく形成された体節の周りから始まるすべての尾胚組織を削除します。
- ディスパーゼで孤立胚性幹を(0.24 U / mlのDMEM)に置き、37℃で1時間15分のためにそれらをインキュベート℃、5%CO 2。トランクがインキュベーションを開始したら、NTの培養外植(ステップ1.5から1.8)の6カバースリップ(CS)を準備を開始。
- 70%エタノール中で6 CSをすすぐ(無菌、超純水で希釈した)して、それらを乾燥させます。ラボマーカーを使用し、直径1cm(このサークルは後でフィブロネクチンコートが塗布された場所を特定するのに役立ちます)程度である各CSの中央に円を描きます。各CSの同一面上に、単語(これはyを助ける描かれた円の外側(または他のいくつかの単語や非対称形状) "である"を書いてくださいOU)はCSの著しい側が上を向いているか停止しているかどうかを識別します。
- 下に向けて顕著な表面を持つ別の40×10mmの滅菌シャーレに各CSを置き、皿が10分間殺菌UVランプの下に開いて座ることができます。
- 60μlのフィブロネクチン(FN、10μg/ mlのDMEM)を適用1cmの円内に領域全体を確認しながらCSのマークされていない表面にはコーティングされています。 30分間37℃でインキュベートしてから、慎重に各CSからフィブロネクチンを吸引するために皿を置きます。
- 250μlの "文化"媒体のFN-被覆された領域を[L-グルタミン(2mM)、ペニシリン(100U/ml)、ストレプトマイシン(100マイクログラム/ ml)を、8%ウシ胎児血清(FBS)を含むDMEM]を追加CS。 NTSが分離されているまで、℃、5%のCO 2を再び37℃で各CSを含む皿を置きます。
- L15培地を含む1 5 cmのガラスシャーレにすべてインキュベート胚幹を移し、細かい鉗子とタングステン針(図1)を用いて各NTを解剖開始。 C言語NTを傷つけないように慎重ながらarefully NTおよび鋭いタングステン針と体節の境界に沿ってスライスする。これは、トランクの尾最端から各NTを分離開始する方が簡単です。
- 一晩培養した培養液にまっすぐと最長国税庁の6(およそ8〜15体節の間にNTSが長いことをお勧めします)を選択します。 培地で下塗りマイクロピペットチップを用いて、(1.8〜ステップ1.5から)、独自の事前に準備さCSに6国税庁のそれぞれに転送。 NTが表面に浮いて残っていないことを確認してください。 NTが固定されていない場合は、それがマイクロピペットを用いて沈むまで、その上に媒体を垂れる。
- 37℃、5%CO 2で一晩各皿を置きます。各NTがインキュベーターに皿を置く直前に、それぞれのCSのFN-塗布面積(参考として、ステップ1.5で描画した円を使用して)の範囲内であることを確認するように注意してください。マイクロピペットは、必要に応じてより良い各NTの位置を調整するために使用することができます。
- プレイスで少なくとも2滅菌15ml遠心チューブに培養液 (血清を含まない)のmlおよび37℃、5%CO 2で一晩インキュベートする。少し培地のpHは一晩調整できるように緩めてキャップを残して下さい。プレインキュベート培地は、分子勾配の確立に支障をきたす場合がありあなたのチャンバー内の気泡形成を防ぐために重要です。このような "前インキュベート"媒体は、将来のすべてのステップで使用されるべきである。使用されていない場合、この培地は、37℃でインキュベートされるべき℃を
2。 2日目:変性Zigmond室および細胞遊走のタイムラプス解析のロード
- 培養6国税庁のうち、最高の分析に適して3文化を選択します。一般的には、少なくとも1つの長い、ストレートエッジを持っているNCCの培養物(図2A)を選択する必要があります。 3最高の文化は、異なる治療をそれぞれ、一日を通して3改変Zigmondチャンバーをロードし、フィルムに使用されます。 3文化のうち、Loadinのための1つを選択するグラム第1室と、後で使用するためにインキュベーターに他人を返す。
- 綿棒を使って、1つの修飾Zigmond室の貯水池や橋を取り巻くワセリンの薄い均一な層を適用します。
- CSの表面に付着した周囲のNCCSを残しながら、タングステン針を、穏やかに、CSからNTを削除します。 NCCの文化のまっすぐなエッジの向きを覚えてペンで皿をマークします。
- 橋の上に前インキュベート培地を数滴入れます。 DAB古い培地のほとんどを除去するキムワイプに対するCSの立ち上がりエッジ、微細鉗子でCSをピックアップし、すぐに撮影する文化のストレートエッジは上の中心になるように修正されたZigmond室にCSを置く橋の長さとほぼ垂直ブリッジ貯水池の境界(図2A、B)に。
- 倒立顕微鏡を用いて、目に最も近い橋の側になるようにまっすぐにNCCの境界を移動(;コントロールに対して、これは第二ロードされている方のリザーバーに対応させていただき図2B)の疑いでchemotactantが含まれていますeの貯水池。また、より細かくブリッジ貯水池の境界線に垂直になるように文化のストレートエッジを揃えます。
- 慎重に、しかし確実にそれが完全にチャンバーへに封止されていることを確認しながら、Zigmond室に存在する石油ゼリーにCSを押し、さらにそれが気密であることを保証するためにCSのエッジに沿って追加のワセリンを置きます。封止プロセス中の任意の動きを補正するために再びNCCの境界線の角度を微調整します。
- 疑いchemotactant第一(図2B)は含まれません貯水池をロードします。約300μlの前インキュベート培地で1mlシリンジ(添付針インチ25 G×1.5)をロードすることによって、これを行うと、(貯水池内の任意の気泡を生成することがないように注意しながら)いっぱいまで、リザーバーに培地を注入します。 suffの両側に貯水池プラグ前に隣の貯水池をロードするワセリンicient量。
- 候補chemotactantを含む前インキュベート培地を使用して、この時間を除いて、手順2.7を繰り返します。常にテスト分子を欠いた貯水池をロードした後にテストされる分子を含む容器をロードするための文化にわたる分子勾配を生成するときに、それは非常に重要です。
- °Cの前撮影〜1時間インキュベートし、37℃でロードされたZigmond室を配置します。画像を90秒間隔で3時間NCCの文化のまっすぐな境界線が約37℃(図2A、B)でインキュベートした。前にムービーを作成するに、得られる画像のエッジと整列し、最後の貯水池ロードされた(図2B、上部パネルに接して橋の端に触れているようにカメラの位置を合わせてください。破線のボックスは理想を表しイメージングのための位置)。これは、分子適用勾配とthの方向性を標準化することにより、後でソフトウェアの分析を容易にするであろう生成された各ムービーで撮影貯水池からの電子の距離。
- コントロールについては、リピート(ステップ2.1)で選択された2つの他のNCCの文化ごとに2.2から2.9までを繰り返しますが、適切な培地で各リザーバータンクを埋める。 1種類の制御のプレインキュベーション培地は、試験される分子を含有していないと、両方のリザーバを埋める。第二制御治療のために、プライムCSをマウントする前に疑いchemotactantを含む前インキュベート媒体の数滴を持つブリッジ。その後、疑いchemotactantを含む同じ培地では、両方のリザーバをロードします。
- ImageJの(NIH)のマニュアルトラッキング使用(rsb.info.nih.gov / IJ /プラグイン/トラック/ track.html)と走化性および移行ツールv1.01デベロッパー (www.ibidi.de /アプリケーション/ ap_chemo.html)追跡するためのプラグインを文化jのまっすぐな国境沿い周辺NCCSの移行USTは、撮像して得られた渡り鳥の軌跡(図2B-C)の様々なパラメータを分析する。
3。代表的な結果:
多くのトランクNCCSは、上記の手法を用いて候補化学誘引物質に反応していた映画のセルの軌跡のサンプル(図2D)表示されます。肯定応答のこの例ではほとんどの細胞は化学誘引物質勾配アップ正味の移動を(赤で表示)を表示しました。軌跡データは、同様に細胞遊走の他の特性を分析するために使用することができます。
視覚的に修飾されたZigmond室、のAlexa Fluor 488 IgM抗体複合体(MW〜900 kDa)の中で適用された勾配を評価するために修正Zigmond室の第二貯水池(約40μg/ mlのH 2 Oの時)にロードされました。勾配は26時間後に1時間と、まだいくらか存在によって確立されたが、大幅に50時間(図3)によって減少した。テストされる分子が小さい場合には、適用された勾配のWi示されているものよりも速く低下するでしょう。

図1フィブロネクチンコーティングしたカバーガラス上で一晩培養するためのトランクレベルのNTSの植 。背NTからトランクNCCSの離層は体節8月28日に隣接して位置しているので、NTのこのセグメントは、顕微解剖およびNT外植片からNCCSの移住を可能にするためにフィブロネクチンでコーティングされたCSの上で一晩培養することにより隔離されています。彼らは長いストレート国境をNCCの文化をもたらす傾向がある限り、相対的に8から15体節の間にある孤立したNTSはストレート最高の一晩培養に適しています。他の神経堤軸方向のレベルを生じさせる神経管の領域は小さいフォントで表示されます。 S、体節。

図2外植トランクNCCSの移行性評価の方法修正されたZigmond室を使用。 (A)は、細長いトランクNCCの培養は国税庁の一晩培養することにより調製され、少なくとも1つの長い、まっすぐな境界線を持つ結果、NCCの培養は実験のために選択されています。選択された文化の中で最も長い直線の国境は、その後ブリッジ貯水池の境界線に垂直に配置されており、将来の適用勾配のベクトルへのゆえ並列されている。Zigmondチャンバーと密閉にNCCの文化の位置を微調整する(B)の後チャンバへのカバーガラスは、チャンバがロードされます。走化性をテストするときは、疑いchemotactant含まれません貯水池( - )は、第一及び密封されたロードされます。その後、他のリザーバが疑わchemotactant(+)と密封がロードされます。以前に選択された国境に沿って周辺NCCS次に撮像すると、ImageJ(下のパネル)用の手動トラッキングプラグインを使用して追跡することができます応答(C)において、多数の渡り鳥の特性に適用された勾配が追跡データに基づいて評価することができる。例えば、走化性インデックスはそれが移行した総距離によって、x軸に沿った細胞の変位を割ることによって求めることができる。(D)の魅力的な応答の例を最初に走化性と移行することによって生成されたセルの軌跡プロットによって示されているImageJのためのツールのプラグイン。各軌道の開始点は原点(0,0)に設定されています。彼らの最終的な位置にあるすべてのセルの質量の化学誘引物質source.Theの中心に向かってどのように多くの細胞移行に注意してください(ブルーのクロス、すべてのセルが均等に重み付け)化学誘引源にも近いです。 NCCS、神経堤細胞、赤トラックがロード貯水池に向かって移動した細胞が疑われる化学誘引物質、黒トラック、離れて移動した細胞、(+)、高級chemotactant濃度;( - )、低級chemotactant濃度。

図3 異なる時間で修正されたZigmond室の橋を渡って強度プロファイルのAlexa Fluor 488 IgM抗体複合体の添加後。チャンバーは前インキュベート水その主な例外を除き、プロトコルに記載と同様の方法でロードされました(代わりに前インキュベート媒体の)40μg/ mlの抗体を希釈するために使用され、小さなエアポケットは、橋の両端(離れて上記の強度プロファイルが取らスライスから)に出 席していましたされました。初期状態では、勾配が橋の向こう側にほとんど存在しなかった。により1ヘクタール勾配が設立され、26時間まで存在したままであった。 50 hで勾配の存在が橋のさまざまな分野で矛盾していました、そして、存在する場合は、勾配の険しさが大幅に減少した。すべてのプロファイルはAxioVisionの4.6ソフトウェアを用いて橋を渡って同一のスライス(1ブリッジ貯水池の境界線から他方へ)から生成した。注意してもしばらく空気ポケットが存在していた、勾配は中断されませんでした。高い、高輝度、低消費、低強度、橋の幅全体x軸、距離(2mm)を、(+)のAlexa Fluor 488 IgM抗体コンジュゲートでロード貯水池、( - )、リザーバは、コンジュゲートとロードされていません 。
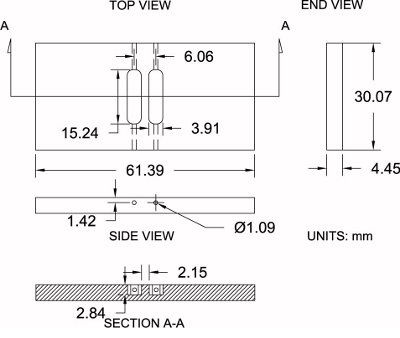
図4修正Zigmond室仕様。改変Zigmondチャンバーの図は、その次元の仕様(±0.2ミリメートル)と一緒にここで使用され示されている。測定は、適度に個別の設定を一致させるために調整することができます。
補足議定書:修正Zigmondチャンバーの作製
下記のプロトコルのための基準として、図4を参照してください:
- 3月16日 "厚磨かれたアクリル(4.45ミリメートル実際の厚さ)のシートを購入します。
- へ特大のチャンバーのブランクをカットし、テーブルソーを使用して33.25ミリメートルX 64.57ミリメートルの大まかな寸法。これは、加工用の3.175ミリメートル余分な材料が可能になります。
- 万力のチャンバを空白にして設定します。 30.07ミリメートルX 61.39ミリメートル:フライス盤と6.35ミリメートル(1/4 ")エンドミルビット、仕上げ加工、それらの正確な寸法にチャンバーの側面を持つ。
- フライス盤でチャンバーのブランクを置き、エッジファインダを使って、x軸とy軸の両方に沿ってブランクの中心を見つけ、中心位置がゼロ。
- 上面にエンドミルビットに触れることによりチャンバーの高さ(Z軸)を取得し、高さをゼロにします。
- 3.91ミリメートル(0.154 ")エンドミルビットを使用して、最初の貯水池のx軸(正方向)に沿ってビット3.03ミリメートルを相殺した。 7.62ミリメートル(0.300 ")にy軸(正方向)に沿って移動しながら2.84ミリメートルの深さまでチャンバー内に機械加工を開始してから、7.62ミリメートル(0.300にトラバース"完全なリザーバーに反対(負)の方向で) 15.24ミリメートル(0.600 ")の長さ。オフセットx軸(負方向)に沿って3.03ミリメートル(0.119 ")のビットと第二貯水池の同じプロセスを繰り返します。
- その縁で室を置き、実験中に培地をロードするためのチャンバの側面に貯水池の端を接続する各リザーバー(計4個)の端に1.09ミリメートル(0.043インチ)のドリルビットを使用して穴を開けます。
- 任意の化学汚染物質を除去するために暖かい石鹸水でよくチャンバーを浸す。
- どんな石鹸を除去するために蒸留水でよくチャンバーを浸して洗ってください。チャンバーは現在上記のように使用する準備が整いました。
ディスカッション
トランクNCCSで走化性研究を実施することの理由のシリーズのためにやりがいがあると判明しました。トランクNCCSは、長期培養した場合と区別されます異種の幹細胞集団を構成しているので、トランクNCCSはトランクレベルのNTのプライマリ植から取得する必要があります。彼らが最初に細胞が単離され、均質に走化性チャンバー(例えば、ボイデンチャンバー12)に再播種されている?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は、このメソッドの開発中に技術的な支援のためにリノキム、スティーヴ·グスマンとUjit Satyarthiに特別な感謝を与える。マイロン·ホーソーン、リチャードSpengel、ロベルト·ロハスは、ここで使用室を機械加工し、待望の技術支援を提供した。特筆すべきは、ロベルト·ロハスは、図4を産生した。我々はまた、上記の走化性アッセイの開発に先立っスコットフレイザーの貴重なアドバイスに感謝しています。本研究の一部はMEDBにNIHのMBRをのSCORE-5S06GM048680-13でサポートされているとCSUノースリッジ校大学院学位論文支援プログラムからCWに受賞をされました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| DMEM | オメガ·サイエンティフィック | DM-22 | |
| ペニシリンストレプトマイシン溶液 | オメガ·サイエンティフィック | PS-20 | 100Xストック濃度 |
| L-グルタミン | オメガ·サイエンティフィック | GS-60 | 100Xストック濃度 |
| ウシ胎仔血清 | オメガ·サイエンティフィック | FB-11 | ロット#105247(または匹敵する別) |
| 変性Zigmond室 | ホームメイドの | N / A | タンク容量:〜160μlのEA、詳細な仕様については、図を参照してください。 4と補足製造プロトコル |
| 細胞培養皿 | デンヴィル | T6040 | 40×10ミリメートル |
| フィブロネクチン | BD | 354008 | 10Xストックは1ミリリットルH 2 Oおよび9ミリリットルDMEM中で1mgのFNを希釈することにより、整形処理 |
| カバースリップ | フィッシャー | 12から548-B | 予備洗浄し、22×22ミリメートル |
| L15培地 | サーモサイエンティフィック | SH30525.02 | |
| ワセリン | 快適さ | 011110794642 | 100パーセント |
| 遠心分離管 | Biologix | 10から9152 | 15ミリリットル |
| ディスパーゼ | 電池システム | 4Z0-850 | 10Xストック濃度 |
| 注射器 | BD | 309602 | 1ミリリットル |
| 針 | BD | 305127 | 25 G X 1.5インチ |
| のAlexa Fluor 488-IgMの | 私nvitrogen | A21042 | 株式は2 mg / mlである。7モル染料/モルのIgM |
| 解剖用ピンセット | FST | その他。 | デュモン#5または55;ストレート先端、ステンレス鋼やチタン |
| タングステン針 | N / A | N / A | 自家製、ピンホルダーに配置 |
| ブラント鉗子 | ティーマン | 160から18 | 卵黄からリンゲル液に胚を転送するために使用 |
補足議定書:修正Zigmondチャンバーの作製
下記のプロトコルのための基準として、図4を参照してください:
- 3月16日 "厚磨かれたアクリル(4.45ミリメートル実際の厚さ)のシートを購入します。
- テーブルソーを使用して、33.25ミリメートルX 64.57ミリメートルの大まかな寸法に特大のチャンバーのブランクを切った。これは、加工用の3.175ミリメートル余分な材料が可能になります。
- VIのチャンバーを空白にして設定するSE。 30.07ミリメートルX 61.39ミリメートル:フライス盤と6.35ミリメートル(1/4 ")エンドミルビット、仕上げ加工、それらの正確な寸法にチャンバーの側面を持つ。
- フライス盤でチャンバーのブランクを置き、エッジファインダを使って、x軸とy軸の両方に沿ってブランクの中心を見つけ、中心位置がゼロ。
- 上面にエンドミルビットに触れることによりチャンバーの高さ(Z軸)を取得し、高さをゼロにします。
- 3.91ミリメートル(0.154 ")エンドミルビットを使用して、最初の貯水池のx軸(正方向)に沿ってビット3.03ミリメートルをオフセットします。y軸に沿って移動しながら(2.84ミリメートルの深さまでチャンバー内に機械加工を開始7.62ミリメートル(0.300 ")、そして7.62ミリメートル(0.300にトラバース" 15.24ミリメートル(0.600 ")の完全な貯水池長に反対(負)の方向)に正の方向)。 x軸(負の方向)に沿って3.03ミリメートル(0.119 ")ビットをオフセットと第二貯水池の同じプロセスを繰り返します。
- その縁でチャンバーを置き·実験中に培地をロードするためのチャンバの側面に貯水池の端を接続する各リザーバー(計4個)の端に1.09ミリメートル(0.043インチ)のドリルビットを使って穴を開けます。
- 任意の化学汚染物質を除去するために暖かい石鹸水でよくチャンバーを浸す。
- どんな石鹸を除去するために蒸留水でよくチャンバーを浸して洗ってください。チャンバーは現在上記のように使用する準備が整いました。
参考文献
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved