このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の実験的マウスモデルにおけるプッシー接種とサンプル採取のためのプロトコルカンジダ膣炎
要約
の評価に使用するキー技術カンジダ膣炎が説明されています。メソッドは、腰リンパ節を排出するから膣標本とリンパ球の迅速な収集が可能になります。これらの技術は、女性の下部生殖管の他の疾患のマウスモデルを生じさせることができる。
要約
カンジダ種に起因する外陰膣カンジダ症(VVC)は、、彼らの生殖年齢18,32-34中にそれ以外の場合は健康な女性の約75%に影響を与える低く、女性生殖器の真菌感染症です。素因は、抗生物質の使用、妊娠に起因する生殖ホルモンレベルのコントロール不良の糖尿病と障害、経口避妊薬またはホルモン補充療法33,34を含む。年ごとに3つ以上のエピソードのように定義再発VVC(RVVC)は、、ない素因33で女性の8%に独立した5影響を与えます。
VVCの実験的マウスモデルを確立し、病因とカンジダ 3,4,11,16,17,19,21,25,37の粘膜ホストの応答を研究するために使用されています。このモデルはまた、in vivoで 13,24 の潜在的な抗真菌治療法をテストするために採用されている。モデルでは、動物がoptのpseudoestrusの状態に維持されている必要がありますimal カンジダの保菌/感染6,14,23。このような条件下では、接種した動物は数週間から数カ月のための膣真菌負担を検出可能なことになります。過去の研究は、免疫学的及び生理学的性質を3,16,21の相対動物モデルとヒトへの感染の間に極めて高い並列を示す。違いは、しかし、正常な膣内細菌叢とマウスの中性の膣のpHとしてカンジダの欠如などがあります。
ここでは、膣接種、膣標本の迅速な収集、膣真菌負担の評価、及び細胞の抽出/分離のための組織の準備を含むマウス膣炎モデルにおける重要な一連のメソッドを示しています。これは、膣洗浄液、真菌の負担、および流入領域リンパ節の白血球の利回りの構成要素のための代表的な結果が続いている。麻酔剤の使用で、洗浄のサンプルは、の経時的評価のための同じマウスで複数のタイムポイントで収集することができます感染症/植民地化。さらに、このモデルは、定義されたホストの条件の下で免疫学的研究を可能にする、感染を開始するためには免疫抑制剤を必要としません。最後に、モデルとここで紹介した各手法は、潜在的に低い女性の生殖器(ウイルス、寄生虫、細菌)と、それぞれの局所的または全身的な宿主防御の他の感染症を調べるために方法論の使用を生じさせることができる。
プロトコル
1。 カンジダアルビカンスによる膣接種
- 前の接種から3日後、腹部を露出するために動物を抑制しつつ、下腹部の皮下にβ-エストラジオールの0.1から0.5 mgを含むごま油の100μlを注入する。注射部位からの漏れを最小限に抑えるために皮膚に横5〜10ミリメートル程度の針を進める。
下腹部におけるエストロゲンの皮下投与は生殖器に近接のため、このモデルに最適です。有効用量は、マウスの系統、年齢またはエストロゲン誘導体によって異なる場合があります。 CBA - J(H - 2κ)、C3H/HeN(H - 2κ)、C57BL / 6(H - 2 b)に、をBalb / c(H - 2 d)を用いてこれまでの研究では、DBA / 2(H -年齢の6-8週で2 D)、SJL(H - 2 S)マウス、0.1 mg/100μlの膣壁の肥厚により証明される効果的な発見した、膣粘液を減少させ、上皮細胞の脱落が増加した。上記のこの濃度でエストロゲンを投与したマウスはカンジダで一貫性のある膣の植民地化を示す。他の株と年齢のマウスでの接種の場合は、パイロットスタディは、修正された条件下でのエストロゲンの実効性を確保し、必要に応じてエストロゲンの用量を増やすことをお勧めします。
エストロゲンのソリューションは、注射の日のたびに新鮮な準備する必要があります。ごま油でエストロゲンの完全な溶解性を確保するために、徹底的に37℃、断続的にボルテックスミキサーと熱を使用して溶液を混合℃に研究期間を通して週1回の注射を繰り返します。 - 接種を準備するには、Cの白金耳を追加0.1%グルコースを添加したPhytone -ペプトンブロス10mlにサブロー-ブドウ糖寒天(SDA)に関する最近のサブカルチャーの準備からalbicansの blastoconidia。 25℃で18時間固定相へのブロス培養液を振盪水浴中でC。
- インキュベーションの後、目を集めるeのブロス培養5分、800 × gで15 mlコニカルチューブと遠心分離機に。滅菌PBSで2回ペレットを洗浄します。
- トリパンブルー色素排除によって血球計数器で生きていけるblastoconidiaを列挙する。滅菌PBSで× 10 6個 / ml(または希望の接種濃度に)2.5に細胞濃度を調整します。
- マウスを安定させるために、二本指で尾の付け根をホールドし、上向きので、膣の開口部は(図1A)に向かって直面しているヒップを持ち上げます。マウスがマウスに尾の拘束に対する耐性を提供できるように平らなおろし表面(例えば、ケージの上部)に配置されている場合、それが理想的です。
- 膣内腔(図1B)の奥深くに約5mmピペットの先端を挿入することにより接種懸濁液をピペットで20μlの(または20μlを超えないように、目的のボリューム)。マウスの苦痛を最小限に抑えるため、できるだけ迅速かつ静かに、このステップを完了してください。
2。膣lavages
- 以下の安楽死(または麻酔)、H膣の開口部が露出になるように2本の指で尾の付け根から下に古いマウス。
- ピペットチップで繰り返し誤嚥と攪拌しながら滅菌PBSを100μlを導入することにより、膣腔を肺胞。ピペットの先端は、細胞が詰まっになることがあります。この問題が発生した場合、閉塞細胞を分注し、膣内に残っているPBSでlavaging続けます。マイクロ遠心チューブに洗浄液を収集する。
- また、膣lavages、イソフルラン吸入麻酔で麻酔したマウスで行うことができます。このため、彼らは完全に(〜30秒。)鎮静されるまで、イソフルランを気化するためにマウスを公開。尾の付け根で下方へマウスを持って、静かに滅菌PBS50μlを使用して膣内腔を洗浄。この手順の実行中に膣への外傷を最小限に抑えるためにピペットチップで過酷な攪拌を避けるようにしてください。鎮静マウスは、周囲の空気への暴露の30秒内で麻酔から回復する必要があります。
イソフルレンイソフルラン気化器とO 2(優先)または標準的なドロップシステム気化器系(呼吸困難を避けるために鎮静しながら動物の綿密なモニタリングを必要とする)ことなく、麻酔チャンバーを閉じてを使用して蒸発させることができます。
麻酔したマウスで膣lavagesは、同じマウスの上に長手方向の洗浄試料のための選択の方法でなければなりません。連続したlavagingは時間41以上の真菌負担の評価には影響しません。
- ウェットマウント標本の場合は、スライドガラス上に洗浄液の10μlを転送し、光学顕微鏡により400 - 1000Xの倍率で観察します。また、洗浄液の細胞分画を細胞と核の形態を調べるために染色することができます。塗抹標本の場合は、スライドガラス上に洗浄液の10μlを転送し、ピペットチップの外側の壁を使って感染を広げます。 CytoPrepの固定液でスミア試料を保持し、標準的なパパニコロー法による染色(パパニコロウ塗抹)。光学顕微鏡で400倍の倍率で観察。
3。膣真菌負担の定量化
- 96ウェル丸底プレートでは、一番上の行とその列の次の5つのウェル(プレート下)に滅菌PBS 180μLの1つのウェルに洗浄液を転送する。
- 列内の次のウェルに流体の20μlを転送することにより、膣洗浄液の1:10希釈系列を作る。それぞれの転送の前に繰り返し吸引して完全に混和。 12洗浄サンプル(つの完全な水平方向の行)までの連続希釈物を、12チャンネルピペットを用いて同時に行うことができます。
- 最も低い希釈で始まる、サブロー - デキストロース寒天(SDA)にサンプル10μlを転送する。最大36サンプルのメッキは、グリッドや調節可能な間隔のマルチチャンネルピペットを用いて正方形のペトリ皿に準備SDAを使用して、1プレートで行うことができます。
- 34でインキュベーション後にコロニー形成単位(外装フィルム)を列挙° C Fまたは48時間
4。膣組織の抽出
- 膣洗浄の手順に従って、その背中に安楽死させたマウスを置くと、70%エタノールで鼠径部を飽和させる。ピンセットを使用して、上方に膣の開口部が露出になるよう尿オリフィスを持ち上げます。
- 膣の内腔に曲がったピンセットを挿入し、子宮頸部を探します。鉗子でしっかりしたグリップを維持しながら、膣腔(図2A - C)を介して子宮頸部を抽出する。
- 膣開口部の基部に膣消費税とし外科ハサミで膣から子宮頸部を取り除く。膣組織が渦巻き状のであることを忘れないでください(膣の上皮側の内側が外側に露出している)。組織は、いずれかの横方向に膣の元の方向を維持するために反転または横方向の切開を行うことによってシート状に開くことができます。
切り出した膣の組織は、1)リンパ球抽出は、次のコラージュに使用することができます。組織学的分析25 naseの消化(〜1 × 10 4 /マウス)40、2)上皮細胞の単離後ディスパーゼ消化(〜5 × 10 4 /マウス)28、3)凍結またはパラフィン包埋準備。
5。腰部リンパ節切除
- 膣洗浄の手順に従って、その背中に安楽死させたマウスを置くと70%エタノールで腹部を飽和させる。下腹部から胸に出発横切開を行い、内臓を公開。両手でピンセットを用いて、中央の血管が見えるようになるように上向きに腸を動かす。
- 下大静脈と腹部大動脈を見つけます。通常は、腰リンパ節のペアは、腎臓および腸骨動脈39の原点間のほぼ中間に位置する、腹部大動脈に隣接して識別することができます。これらのリンパ節が視覚的に弾性テクスチャによって脂肪組織と区別することができます。と脂肪組織(図3)に比べて色が薄く、より不透明です。これらのリンパ節は、未接種の動物と比較して著しく感染した動物がより大きくなるからです。
- ノードの下にmicroforcepsを配置し、周囲組織から分離するために軽くプルアップにより、消費税リンパ節。
6。単細胞懸濁液中のリンパ系細胞の分離
- ハンクス平衡塩類溶液の約10ミリリットル(HBSS)(図4)を含む滅菌ガラスのペトリ皿の中に置か滅菌ワイヤーメッシュスクリーン(サイズは約3 × 3 cm 2)の上のリンパ節を転送します。
- わずかに傾斜したペトリ皿に、シリンジのプランジャーヘッドと画面に対するリンパ節を押してください。ノードの非細胞成分(すなわち、膜、角膜実質、脂肪)が画面上に残っている間は、ノードの細胞の内容が画面を通過するように、すべてのリンパ節を分割することを確認してください。
- 同じプランジャーとシリンジ、吸引tを使用する彼は、それを含む細胞をHBSS。 〜5mlのHBSSで画面を洗い、15 mlコニカルチューブに残った液を集める。
- 10分、800 × gで遠心する。液体廃棄の前にピペットで液体の上部に任意の脂肪性沈着物を吸引除去する。 HBSSで細胞ペレット3回洗浄する。トリパンブルー色素排除によってHBSSおよび列挙する生細胞を1mlでペレットを再懸濁する。
7。代表的な結果:
> 4日間接種したマウスから膣洗浄液の細胞分画は、通常、 カンジダ 、上皮細胞と細胞の浸潤(図5)で構成されています。ウェットマウント顕微鏡によって、 カンジダは、視覚的に菌糸の存在だけでなく、酵母(図5A)で識別できます 。膣洗浄液の塗抹標本の調製物は、主要な細胞は、トリ- nucleによって識別される好中球であるの上皮細胞および浸潤白血球を、調べるためにパパニコロー法により染色することができますARローブ(図5B)。非常に少数の好中球は、もしあれば、41未接種マウス(図5C)で検出されています。
膣真菌負担の例を図6に示されています。特定の時点で収集された膣洗浄液は、CFUの列挙(図6A)のために培養されています。 カンジダは、非エストロゲン処理接種したマウス(図6C)で膣植民地化の確立に失敗しながら、カンジダによる膣の植民地化/感染症は、エストロゲン投与接種したマウス(図6B)の週間持続する。エストロゲン投与未接種のマウスは(データは示さず)の時間を通して、カンジダは陰性のまま。さらに、膣lavagesは、各時点または縦方向に麻酔下で同じマウスで別のマウスのいずれかの時間を行うことができます。
腰リンパ節には生殖器と膣の課題に対する全身免疫応答のために評価するために最も関連性の高いサイトの主要なリンパ節です。 N彼らは通常、未接種マウスでは非常に小さく表示しながら、これらのリンパ節が接種されたマウスで拡大になる可能性があることOTE。白血球細胞の回収率は一般的に8 × 10 5 / 5〜未接種のマウス× 10 6 /接種マウスの範囲。腰リンパ節に加えて、鼠径部、膝窩および腸間膜リンパ節を使用することもできます。
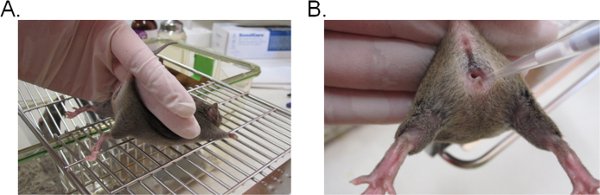
図1。 カンジダとプッシー接種。 A)マウスは、接種のために拘束。マウスは、ワイヤーケージのインサート上に配置され、足を持ち上げ、膣開口を公開するために、やや上向きに、尾の基部によって保持される。それは尾の拘束に抵抗しようとするとマウスのヒップは同じ手で安定化することができます。膣腔へ接種のB)の紹介。ピペットの先端を穏やかに膣腔への深い5mm程度挿入されます。サスペンションの接種材料は、蒸着される。
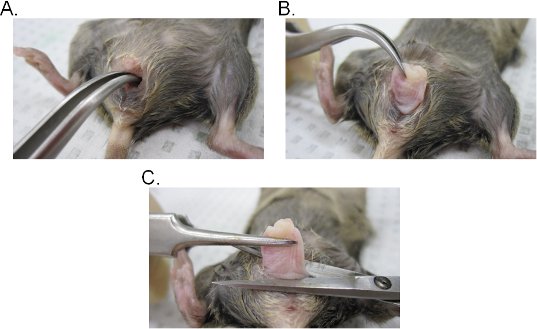
図2。プッシー組織抽出。 AB)子宮頸部の抽出。子宮頸部は、湾曲鉗子で位置しており、膣腔を介して外側に露出している。一度外膣腔から、子宮頸部がさらに完全に膣を露出する外側に引っ張られている。膣のC)抽出。膣は、はさみと外陰部から切り出されている。一度切り離された、膣から子宮頸部を削除します。

図3。腰リンパ節の同定。骨盤付近の周囲の臓器/血管の中で腰リンパ節の位置が示されます。 、腹部大動脈。 B、膀胱。 C、総腸骨動脈。私、腸。 L、肝臓。 R、直腸。 S、脾臓。 U、子宮。

図4。ワイヤーメッシュスクリーン上に配置腰リンパ節。リンパ節は、HBSSでペトリ皿に置かれたスクリーン上にプールされます。リンパ節は、単細胞懸濁液のリンパ球様細胞を得るために注射器のプランジャーで画面に押し付けています。
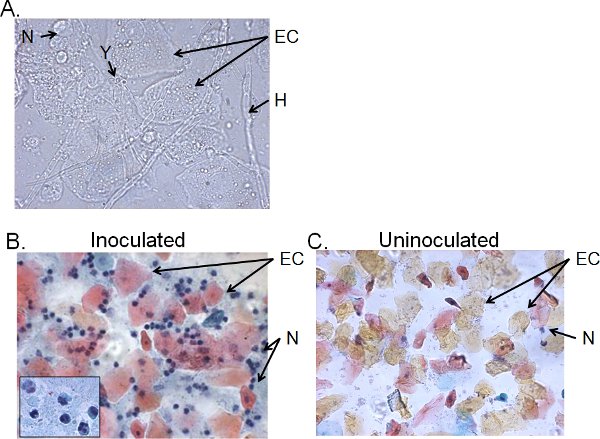
図5。接種したマウスから膣洗浄液の細胞分画。膣洗浄サンプルの)ウェットマウントおよびB)パパニコロウ塗抹標本は、未接種のマウスから)4日後に接種し、Cを集めた。画像は1000 ×()または400 ×(B、C)の倍率で表示されます。 Bのインサートは、1000 ×で膣好中球の核形態を示しています。 カンジダ酵母(Y)と菌糸(H)、上皮細胞(EC)とneutrohils(N)が示されている。
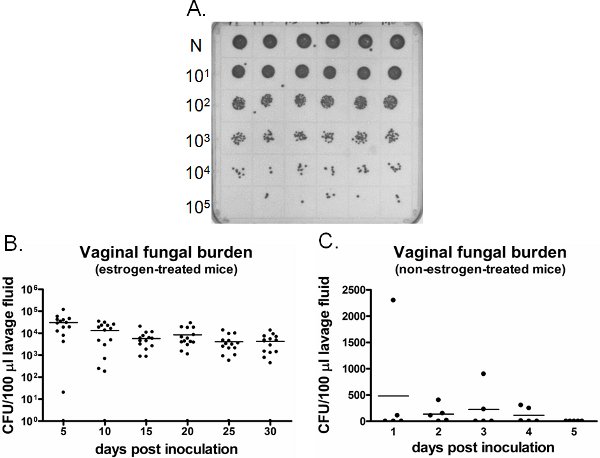
図6。検出膣真菌負担のイオン。 A)SDAプレート上に成長した代表C. albicansのコロニーが。 6種類の異なる接種したマウス(一番上の行)からニート(N)洗浄のサンプルを連続希釈し、CFUの列挙のために培養した。膣真菌エストロゲン治療の負担とCのB)定量)非エストロゲンで処置したマウス。接種したマウスから肺胞洗浄液のCFU/100μlを指示された時点で評価した。
ディスカッション
カンジダ膣炎の実験的マウスモデルが確立され、歴史的に3,4,11,13,16,17,19,21,24抗真菌治療をテストするためだけでなく、 カンジダの粘膜ホストの応答を研究するために過去数十年のために使用されています25,37。プロトコルは、これまでに説明した効率的で手間のかかる方法を取り入れて、 カンジダ膣炎の最も最適化されたモデルシステムの一つ?...
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、R01 AI32556(NIAID、国立衛生研究所)によってサポートされていました。この作品は、評議のルイジアナ州会主催の感染症研究のためのルイジアナ州ワクチンセンターと南部ルイジアナ研究所によって部分的にサポートされていました。
資料
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 雌のCBA / Jマウス | チャールズリバー研究所 | 01C38 | 生後5-6週間 |
| カンジダアルビカンス (3153A) | 病原真菌のナショナルコレクション、英国 | NCPF3153 | |
| ごま油 | シグマアルドリッチ | S3547 | 使用前にあらかじめ滅菌する必要はありません。 |
| Β-エストラジオール17 -吉草酸 | シグマアルドリッチ | E1631 | ごま油で0.1 - 0.5mg |
| Phytoneペプトン | ベクトンディッキンソン | 211906 | 0.1%グルコースで補足 |
| トリパンブルー溶液 | シグマアルドリッチ | T8154 | |
| サブローデキストロース寒天 | ベクトンディックinson | 211584 | |
| コラゲナーゼIV型 | シグマアルドリッチ | C5138 | 0.25パーセント |
| ディスパーゼ | インビトロジェン | 17105-041 | 1.7 U / mlの |
| ワイヤーメッシュスクリーン | TWP | 060X060S0065W36T | No.60メッシュ、ステンレス |
| ハンクス平衡塩類溶液 | インビトロジェン | 24020-117 | |
| CytoPrep固定液 | フィッシャーサイエンティフィック | 12-570-10 | スミアスライドを保持 |
| パパニコローは、EA - 65染色 | EMDケミカルズ | 7054X - 85 | |
| パパニコローは、OG - 6染色 | EMDケミカルズ | 7052X - 85 | |
| ハリス"ミョウバンヘマトキシリン | EMDケミカルズ | 638A - 85 | |
| イソフルレン | バクスターヘルスケア | NDC 10019-773-60 | イソフルラン気化器、またはドロップシステムで使用される麻酔薬室は閉鎖 |
参考文献
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved