このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
脂質Bicelle法を用いた膜タンパク質のハイスループット結晶化
要約
Bicellesは、脂質二重層内での膜タンパク質(MPS)を維持するが結晶化ロボットによるハイスループットスクリーニングを容易にするユニークな相挙動を持っている脂質/両親媒性物質混合物である。この手法は、正常に原核生物と真核生物の両方のソースから高解像度の構造体の数を生産している。このビデオでは、結晶化の試験を設定する(手動でだけでなく、ロボット制御)と媒体から結晶を収穫、bicelle混合物中にMPを搭載した、脂質bicelleの混合物を生成するためのプロトコルについて説明します。
要約
膜タンパク質(MPS)は、全ての細胞や小器官を囲むそうでなければ不透過性の膜二重層を介して特定の分子を汲み上げるなど、多くの生理学的プロセスにおいて重要な役割を果たしている。多くの人間の病気や障害のMPが結果の機能の変化、したがって、その構造の複雑な理解は、生物学的研究にとって重要な目標のまま。しかし、国会議員の構造決定は、しばしばそれらの疎水性に起因する重要な課題である。
国会議員は、二重層内に埋め込まれた実質的な疎水性領域を持っている。洗剤は、頻繁にして可溶性タンパク質と同様に操作することができるタンパク質 - 界面活性剤のミセルを生成する二重層からこれらのタンパク質を可溶化するために使用されます。伝統的に、結晶化試験では、タンパク質 - 界面活性剤混合物を使用し、処理を続行しますが、彼らはしばしば結晶化に抵抗または低品質の結晶を作り出す。これらの問題が原因で起こる洗剤のできないことは、十分に安定性が低いと不均一で、その結果二重層を模倣する。さらに、洗剤のシールドはMPの疎水性表面は、結晶接触のための利用可能な表面積を減らすことができます。回避するためにこれらの欠点のMPは、より密接に彼らの内因性の環境をシミュレートする脂質メディア、で結晶化することができ、最近ではMPの結晶化のためのde novoの技術となっている。
脂質キュービック相(LCP)は水性のチャンネル1の相互接続されたシステムが貫通三次元脂質二重層である。モノオレインの選択の脂質ですが、そのようなmonopalmitoleinやmonovacceninなどの関連脂質はまた、LCP 2を作るために使用されている。国会議員は、彼らは三次元とフィード結晶核の拡散LCPに組み込まれています。 LCPの大きな利点は、タンパク質がより多くのネイティブ環境に残っていることですが、この方法は、高viscを含む技術的な欠点がいくつかありますosity(特殊な装置を必要とする)と結晶可視化と操作3,4の難しさ。なぜなら、これらの技術的困難さから、我々は、結晶化- bicelles 5,6( 図1)のための別の脂質培地を利用した。 Bicellesは、両親媒性物質(CHAPSO)または短鎖脂質(DHPC)とホスファチジルコリンの脂質(DMPC)をブレンドすることにより形成された脂質/両親媒性物質混合物である。両親媒性分子のラインが無極性のエッジが二重膜と界面活性剤の両方の有益な特性を提供しながら、各bicelleのディスク内に、脂質分子が二重層が生成されます。重要なのは、その転移温度以下に、タンパク質- bicelleの混合物は、還元粘度を持ち、結晶化ロボットとbicellesが互換性を、界面活性剤で可溶化した議員と同様の方法で操作されます。
Bicellesが正常にいくつかの膜タンパク質5,7-11(表1)を結晶化するために使用されている。この成長のコレクション蛋白質の原核生物と真核生物源からのαヘリックスとβシートのMPの両方を結晶化するためのbicellesの汎用性を示しています。なぜなら、これらの成功と高スループットの実装のシンプルさ、bicellesはすべての膜タンパク質の結晶学者の武器庫の一部である必要があります。このビデオでは、我々はbicelle方法論を説明し、標準的なロボットを使用してMPを精製のハイスループット結晶化試験を設定するためのステップバイステップのプロトコルを提供しています。
プロトコル
ⅰ)bicelle形成脂質の準備::Bicelleベースの結晶化は、4つの基本的な手順(図2)で構成され、ⅱ)bicelle培地に精製タンパク質の取り込み、ⅲ)結晶化試験(手動またはロボット制御)、両親媒性物質混合物およびiv)可視化、結晶の抽出及び凍結。これらの手順は以下で詳細に説明されています
1。 Bicellesの準備
両親媒性物質の組み合わせと濃度の広い範囲:Bicellesは、脂質の様々な形成することができます。したがって、最初のコンポジションベースの以前の成功に( 表1)推奨条件は、されています。どちらか(下記の試薬の表を参照)混合すぐに使用できる製剤として、市販または説明されているように実験室で調製することができるCHAPSO bicelle製剤、:最も成功した混合物は、DMPCです。 2.8:1モル比でCHAPSO混合物:この演習では我々は35%のDMPCの1mlを準備します。
- 、0.26グラムDMPCを(氏677.9グラム/モル)秤量0.09グラムCHAPSO(ミスター630.9グラム/モル)と1.0mlの最終容量を脱イオン水を加える。
- 2.6-3.0:1(表1)に至るまでCHAPSOモル比:bicelleの割合は、DMPCで10%-40%の間で変化することができます。
- 注:それは高い溶液粘度が得脂質を溶解するためにより高いbicelleの濃度がより困難。しかし、集中bicelleの製剤は、タンパク質濃度が低い場合に有利であり得る。
- 均一な溶液を得るために脂質を溶解することで、このステップbicelle方法で消費するほとんどの時間を作り、かなりの労力が必要です。 DMPCが完全に混合されるまで、次の手順を順に切り替え:
- 混合物を温める〜40 ° Cの水浴またはインキュベータと〜1分間ボルテックスを用いて。
- 注:以上のサイクルが実行されるように、混合物を温めるとゲル状CONになりますsistencyは、それが困難な渦になっています。
- 数分間、氷とボルテックスで混合物を冷却する。冷却は、渦にそれを容易にするソリューションを液化するのに役立ちます。
- 注:以上のサイクルが実行されるように、混合物は冷却時に白濁することがあります。
- 脂質が完全に溶解するまで(1.2.1および1.2.2)上記の手順を繰り返します。
- 注:このプロセスは数時間かかる場合があります。 CHAPSO製剤:Bicelleの形成は、DMPCの相挙動の変化によって示されます。完了すると、混合物は室温と氷の上で粘稠な液体で、または上記の透明なゲルとなる。
- 混合物を温める〜40 ° Cの水浴またはインキュベータと〜1分間ボルテックスを用いて。
- bicelleの混合物が使用できるようになりましたし、長期保管(最長5年間)は-20℃で保存することができます。リン脂質頭部基の加水分解の危険があるため、それは長時間室温でbicellesを格納することはお勧めできません。
2。 bicellesへのタンパク質の取り込み
bicellesから得られた最もMPの構造は、DMPCで結晶化した:CHAPSO bicelleの濃度は、8〜12 mg / mlの( 表1)のタンパク質濃度を使用して2〜8%の範囲。可能であれば、初期画面は、これらのガイドラインを使用する必要がありますし、追加の濃度は、最適化の段階でスクリーニングすることができる。 LCPの方法に比べ、bicellesとタンパク質の取り込みは、結晶化試験と同じ日に行われるべきシンプルなプロセス( 図3)、です。
- 透明なゲルに相変化するまで室温でCHAPSO bicelleの混合物:DMPCを解凍。
- 注:複数の凍結融解はbicelle動作に影響しません。
- 液化すると均質なbicelleの位相を再確立するために簡単にボルテックスして氷上に置きます。氷上に置いたときに混合物は濁ってくることがあります。
- FROMは、この時点で、bicelle混合物を保持し、氷上でタンパク質を精製した。これは、ピペッティングには、従順作る液相でbicelleを保持します。
- 1:4(V / V)の比率で精製された界面活性剤で可溶化したタンパク質にbicelle混合物を追加。
- 例えば:100μlのタンパク質- bicelle混合物を20μlのbicelleと80μlのタンパク質を混合することによって得られる。タンパク質濃度が15 mg / mlの場合とbicelle濃度は35%である場合、これは12 mg / mlのタンパク質濃度と7%のbicelle濃度でbicelleを組み込んだタンパク質の混合物を与える。
- 溶液が透明と均一になるまでゆっくりと内容をピペッティングにより混和する。
- 注:気泡が表示される場合は、卓上遠心機で迅速なスピン(30〜60秒、13000rpmで、4℃で)それらを取除くのを助けることができる。
- タンパク質のint型の完全な取り込みを促進するために少なくとも30分間氷上で混合物をインキュベートO bicelles。タンパク質- bicelleの混合物は結晶化臨床試験の準備ができています。
3。結晶化試験のセットアップ
LCPのような他の脂質の結晶化技術は、培地の高粘度のために特殊な装置を必要とする、しかしbicellesのユニークな相挙動は、ロボット( 図3)を含むほぼすべての標準的な結晶化の形式で実装できます。結晶化の試験はどちらかの標準的な市販の画面を使用してドロップ形式をぶら下げたり、座ってで行うことができる。
- 手動でトレイを設定したり、結晶化ロボットを使用しているかどうか、氷の上でタンパク質bicelleの混合物を維持する。これは、タンパク質- bicelleの混合物の寒さを保持し、溶液の粘度が最小であることが保証されます。
- 手動の結晶化トライアル - 標準的なピペットを使用して、タンパク質- bicelleの混合物は、通常行うのと同じ方法で、リザーバー溶液と混合することができます水溶性または界面活性剤で可溶化した膜タンパク質のED。
- 注:試験中に氷の上でタンパク質- bicelleの混合物を置かないでください。
- ロボットの結晶化トライアル -私たちは、蚊の結晶化ロボットのためにこれらの試験を合わせているが、原理的に(同じ予防措置に続く)技術は、すべての結晶化ロボットと互換性があるはず。以下のヒントは、タンパク質- bicelleの混合物は、クールのままと正確にロボットがピペットことを保証します。
- 発送前に冷凍する氷の上に置くことで、タンパク質bicelleの混合物を保持するプレート。
- プレートにタンパク質bicelleの混合物をピペットで、氷上にプレートを維持し続けます。このプレートは、実行を開始する前に、ロボットに移動する最後の項目でなければなりません。
- 蚊ロボットのプラットフォーム3および5の貯水池のトレイと結晶化の蓋を、アップに設定。
- プラットフォーム4にタンパク質- bicelleの混合物を含むプレートを置きます蚊ロボットの。これは、タンパク質- bicelle混合物はロボットによって取得される最後のものである保証し、それが即座に解放されます。
- 加熱や増粘を防止するために、タンパク質- bicelle混合物でタンクを混在させないでください。
- 複数の画面を実行するときは、すぐに実行が完了するとすぐに冷却するために氷にbicelle -蛋白質プレートを返します。
- ドロップ量との比率(タンパク質:貯水池)は、従来の結晶化試験用として選択することができます。 bicelle混合物に加え、0.25μlの貯水池:例えば、蚊のロボットを使用して初期結晶試験を0.25μlのタンパク質を使用して設定できます。
- 20℃チャンバー内の結晶試験をインキュベート℃にbicellesの相挙動は温度に依存するので、温度は良いスクリーニングと最適化のパラメータです。
- より高い温度が事前に組織の利点を有するラメラ相12( 図1)、誘導層のタンパク質。 20℃以下をスクリーニングすることができるが、4を下回ることがあります° Cを、これは長期間にわたって沈殿物に脂質を引き起こす可能性があるので。
- 従来の結晶化試験と同じ方法で、bicelleの試験は、結晶の外観と成長のために定期的に監視する必要があります。我々は、週1回の検査に続いて第1および3日目のセットアップ後にトレイを確認することを推奨。
- 結晶の最適化は、日常的にグリッドのスクリーニング、添加剤のスクリーニング、さらに、温度などを変えること、bicelleの割合と蛋白質を含む洗剤ベースの結晶のために使用される方法を用いて実施することができる:bicelle比を変えることができる。さらに、bicellesは、タンパク質の安定性や機能に必要となる具体的な脂質をドープすることができます。
4。可視化、結晶の抽出及び凍結
タンパク質- bicelleの混合物と結晶試験導入されたバージョンタンパク質 - 界面活性剤の滴に似て粘度を有し、可視化と結晶抽出には、日常的であり、伝統的なセットアップと同様に行われます。
- 可視化:多くの場合結晶を検出するため、通常と偏光下で高品質の照明を必要とするLCPのメディアとは対照的に、可視化がbicellesによって妨げられない。着色されただけでなく、無色タンパク質結晶のドロップが簡単に標準的な顕微鏡を用いて分析することができ、特別な機器は必要ありません。
- Bicellesは、他の脂質のメディアと同様に、偽陽性の割合が高いを生成する傾向がある。 UV顕微鏡は大幅に塩の結晶(図4)から蛋白質を差別化に役立ちます。
- 抽出と凍結:クリスタル抽出と凍結は比較的簡単ですし、周囲のbicelleメディアの溶解を必要としません。さらに、bicelleの位相自体は、いくつかの適度な低温保護を提供します。
5。代表的な結果:
NT">これは一般的に現れると、彼らの最大サイズに成長するために約一週間以上に結晶の2〜3日かかります。これは、バクテリオロドプシンとマウスの電位依存性アニオンチャネル1(mVDAC1)結晶4,8の場合だ他の膜タンパク質の場合には、結晶成長のために数週間かかる場合がありますので、よく最初の数週間を超えて結晶試験の監視を継続することが重要です。他の脂質のメディアと同様に、bicellesは結晶のように見えることが形状を形成する傾向がある。また、彼らは塩と洗剤結晶の割合が高いにつながることが観察されている。トリプトファン蛍光を検出するUV -顕微鏡を行うと、このような非タンパク質性偽陽性を排除することができます。観測されている別の結果を区別するために可視および紫外光で見たときの図4は、脂質の形状、塩と蛋白質の結晶を示しています。
83fig1.jpg"/>
図1。Bicelle回路図 。 Bicellesは、DMPC(青)とそのような二重層の疎水性のエッジを保護するCHAPSO(緑)、として両親媒性物質として二重層形成脂質の分子で構成されています。温度が増加するにつれ、円盤状のbicellesは、穴あきラメラシート12に相変態を起こす。
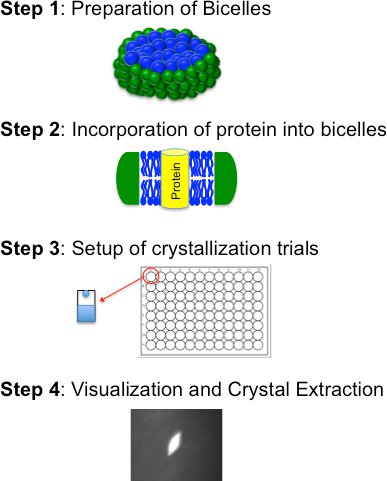
図2。4つの基本的な手順を概説bicelle結晶化方法のフローチャート。

図3。水晶トライアルセットアップ回路図。界面活性剤で可溶化した膜タンパク質を精製すると、単に一緒に内容をピペッティングすることにより、氷上でbicellesと直接混合することもできる。 〜30分間氷上でタンパク質/ bicelle混合物をインキュベートした後、結晶化試験ロボット工学を含む、任意の標準形式を使用して設定できます。

図4。結晶試験の可視化。塩のみの状態で観察された()の針状結晶の可視画像( 上パネル )およびUV画像( 下のパネル )。いいえ蛍光は、結晶から偽陽性の指示を検出することができます。 MPD状態で形成される(B)ロッド状結晶。結晶は弱い蛍光をがX線回折を用いて非タンパク質であることが判明した。 (C)クリスタルは約4週間の試験を設定した後に観察。 UV光の下で強い蛍光は、タンパク質の結晶である確認します。
| いいえ | タンパク | 元 | Bicelleの定式化 | Concentratiタンパク質の | 洗剤1 | 解像度(Å) | リファレンス |
| 1 | バクテリオロドプシン2 | Halobacterium salinarum | 8パーセントDMPC:CHAPSO(2.8:1) | 8 mg / mlの | 2.0 | Fahamとボウイ、2002 | |
| 8パーセントDTPC:CHAPSO(3:1) | 8 mg / mlの | 1.8 | Faham ら 、2005 | ||||
| 2 | β2-アドレナリン受容体/ファブの複雑な | 人類 | 8.3パーセントDMPC:CHAPSO(3:1) | 10 mg / mlの | DDM | 3.4/3.7 | ラスムッセンら 、2007 |
| 3 | 電位依存性アニオンチャネル1 | ハツカネズミ | 7%DMPC:CHAPSO(2.8:1) | 12 mg / mlの | LDAO | 2.3 | Ujwal ら 、2008 |
| 4 | Xanthorhodopsin | Salinibacter紅色 | 4.2パーセントDMPC、5%のNM | 4 mg / mlの | DDM | 1.9 | リュークら 、2009 |
| 5 | 菱形プロテアーゼ | 大腸菌 | 2%のDMPC:CHAPSO(2.6:1) | 9 mg / mlの | ノニルグルコシド | 1.7 | Vinothkumar、2011 |
膜タンパク質の精製に使われる1洗剤
紫膜からの2ネイティブの脂質は、精製時に一緒に行ってもよい
表1。膜タンパク質の構造に対する結晶化条件の要約は、bicellesを使用して解決 。
ディスカッション
Bicellesは洗剤で可溶化したかのように動作しながら、ネイティブの二重層のような環境を提供するユニークな脂質メディアです。ない学習曲線またはこの技法のために必要な特殊な機器がないので、このプロパティは、bicelles、他の脂質ベースの結晶化の方法に比べて明確な利点を与える。一度bicellesは、商用または実験室で調製されたいずれかの利用可能な、彼らは結晶化の試験がほぼ正確...
開示事項
利害の衝突は宣言されません。
謝辞
我々は、博士に感謝します。 bicelleの方法と有用な議論のための博士テルアビブラパスに技術的な専門知識と指導を提供するためのジェームズボウイとセーラムFaham。我々は実験的にサポートするようにルデュを認めます。 Rachna Ujwalしかし、この作業をサポートしていない、MemXバイオサイエンスLLC、の経済的利害関係を持っています。この作品は、NIH(RO1 GM078844)からの助成金によって部分的にサポートされていました。
資料

参考文献
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved