このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
強化されたマイクロおよびナノ操作のためのプラズモニックとフォトニック結晶ナノ構造の利用
要約
プラズモニックピンセットとフォトニック結晶のナノ構造は、光学的にマイクロおよびナノ粒子を捕集の効率性と配向制御に有用な機能強化を作成することが示されている。
要約
サブミクロン粒子の位置と方向を操作する方法は、非破壊的に基本的な生物学的研究のための非常に便利なツールとなります。おそらく、小さな粒子の非侵襲的操作を実現するために最も広く使用されている物理的な力は、しかし、誘電泳動(DEP)1をされている、それ自身のDEPは、それが伝統的に固定電極を用いて行われるので、細胞を操作するときに望まれる汎用性と精度を欠いている。この目的の汎用性と精度を達成するため、小さな粒子の力を発揮する3次元電磁界勾配を利用した光ピンセット、2しかし、このアプローチの主な欠点は、どの粒子をトラップするために必要な力を達成するために必要な高い放射強度である生体試料を損傷することが3トラップし、より低い光強度でソート可能にするソリューションは、光ピンセット(OET)がOETのは、小さな粒子の細かい操作に制限があるもの、。。というDEPベースの技術は、ソリューションのプロパティに制約を置く4 5
このビデオの記事では、生きた細胞の光学的操作のために必要な放射線の強度を低下させ、また、配向制御のための方法を説明する2つの方法を説明します。最初の方法は、図1に示すように試料用の基板として、ランダムな金ナノ粒子(AuNP)配列を使用するプラズモニックピンセットです。 AuNPの配列は、その共振ダイポールモーメントから構成される局在表面プラズモン(LSP)に入射光子を変換し放射し、細胞溶液に大きな勾配を持つパターン化された放射線のフィールドを生成する。 Righiniらと我々自身のモデリングによる表面プラズモン増強のトラップの最初の仕事は、トラップ粒子。6,7,8プラズモンアプローチは罰金にできることプラズモン基板で生成されるフィールドは、傾斜磁場を高めることにより、必要な初期強度を減少さが示されているために機械的エネルギーと双極子に依存する照射野へのより効率的な光エネルギー変換の低い光強度を持つ楕円体粒子と細胞の配向制御。これらのフィールドは、図2に示されていると低トラップの強度は、図4と図5に詳しく説明されています。プラズモニックピンセットで主要な問題は、LSPのは熱のかなりの量を生成することで、トラップは、二次元です。この熱は、トラップからサ ブミクロン粒子を追い出すような強力なものにできる対流の流れと熱泳動を生成します。9,10我々が記述できることを第二のアプローチは、図6に示すように、回折モードに非常に効率的に散乱の入射光に周期的な誘電体のナノ構造を利用している理想的には11、一プラズモニックピンセットで経験した同じ加熱の問題を回避するために、誘電体材料から、この構造を理解するだろうが、私たちのアプローチではアルミコーティングされた回折格子は、一次元の周期的な誘電体のナノ構造として使用されます。それは半導体ではありませんが、それはかなりの発熱を経験し、効果的に図7に示すように、低トラッピング強度、小さな粒子を捕捉していない。格子の基板を有する粒子の整列は、概念的に2次元フォトニック結晶に非球面ミクロンサイズの粒子の正確な回転を可能にすることができるという命題を検証します。これらの光トラップの10効率が原因で説明されているナノ構造で生成された拡張されたフィールドに増加しているこの紙。
プロトコル
1。ランダムな金ナノ粒子アレイの作製8,10,12,14
- Auナノ粒子の配列は、最初の454 nmの平均直径を持つランダムに吸着ラテックス球の緻密層で作られてテンプレートを作成することによって形成される。これは、まず、接着層としてのクロムを使用して20nmの厚さにカバーガラス上に金を蒸発させることによって達成されます。
- ポリスチレン球の単層は、1 - エチル-3 - (3 - ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)、ラテックス球懸濁液と脱イオン水の混合物に、金でコーティングされた基板を公開することにより、自己集合しています。
- 吸着プロセスは、約1時間持続することが許可されており、非吸収球は大量の水で洗い流されている。
- 形成された単分子層を乾燥空気に許可されています。
- 最後に、金の別の20nmのは、ランダムな金ナノ粒子アレイを形成するために、ラテックス球の単層上に蒸発させる。
- SEMが使用可能な場合は、AuNPの配列は、図1とプロセスのダイアグラムは、図8に示すようにSEMで見ることができます。
2。生物学的サンプルの準備9,11
- 光学的にトラップマウスの細胞核のための試料調製が表示されるようになりました。
- アクリジンオレンジ色素でタグ付けされた3T3マウス細胞の核は、フレッドハッチンソンがん研究センターのTewariグループから得た。
- 10(BSA::マウスの細胞核)10%リン酸のウシ血清アルブミン(BSA)は、(PBS)緩衝生理食塩水が約1の濃度でマウスの細胞核に追加されます。 BSAは、基板に付着するから核を防ぐことができます。
- 超音波を使用してソリューションを混ぜる。
- 当社のソリューションの5 ULは、アルミ格子の配列のカバースリップ上に堆積される。解決策が堆積した後にサンプルを輸送する必要がないように、それは顕微鏡のステージ上にアルミ格子でこの手順を実行することをお勧めします。
- カバースリップを"1から"2個の1の2つのスタックは、サンプルが表示されている通過第五カバースリップをサポートするために使用されます。
- 鑑賞するために顕微鏡下でサンプルを置きます。
3。トラップする方法
- 光ピンセットは、サンプルに到達する633 nmのレーザー照射を可能にするために変更されたGFP 17フィルターセットを装備したツァイスAxioはImager.D1Mを通じて、35 mWのヘリウムネオンレーザーを送信することによって構築されています。
- ツァイスLD EC Epiplan - NEOFLUAR 50倍の目標は、画像、直径約5ミクロンである細胞核をするために使用されます。
- サンプルが客観下に配置された後、金ナノ粒子の配列または回折格子に顕微鏡の焦点を合わせる。
- フォーカスがトラップすることを望む核を達成するまで垂直に顕微鏡を翻訳。
- 粒子と粒子上の位置のレーザートラップのスポットは、ステージが翻訳されていてもレーザースポットでの地位を維持する必要があります。
4。代表的な結果:
ランダムな金ナノ粒子の配列の手順は、図1のようにSEM下で観察することができますAuNPのの単層をデポジットしてください。これらのプラズモニックピンセットで作成されたトラッピング力は、標準の光ピンセットによって生成された10〜20倍の力になります。粒子の閉じ込めを達成するためにプラズモニックピンセットで必要とされる最低限の強度は、図4の様々なサイズの粒子のために示されている。9,10回折格子は、金のナノドットよりも20倍も高い捕集効率との整合性とトラッピングを達成し、少しのようにトラップ達成できる17 UW / UM 2(図7)。11など
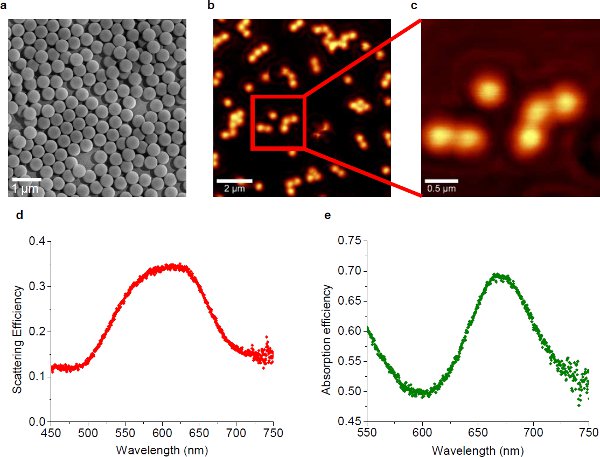
図1 10()自己組織化金ナノ粒子のSEM写真。個々の金ナノ粒子の直径は約450nmである。近接場光を示すナノ粒子の分布が疎であるプラズモン基板の(b)のNSOM像、。励起レーザーの波長は633 nmです。 (b)の赤い四角でマークされたエリアの(c)高倍率ビュー。 624 nmにピークを示すプラズモン基板の(d)の散乱効率スペクトル、。 668 nmにピークを示すプラズモン基板の(e)の吸収効率スペクトル、。
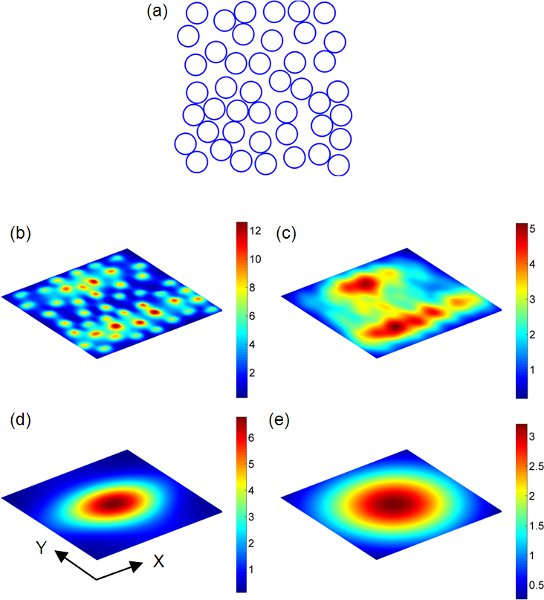
図2 13()金ナノ粒子は、ランダムに2次元ドメイン1の分散× 1μm2である 。それぞれの青い点は、ナノ粒子の中心(= 60 nm)を表す。ランダムナノスフェアの配列に平行な観測平面上の散乱電界の分布は(b)に示す - (E)。ナノスフェアの配列が均一に540nmの波長における平面波が照射される。周囲の媒質の屈折率は1.33です。ポーラX軸(()で水平方向)に沿って平面波のポイントのrization方向。事件電界の大きさは計算で1と想定されます。観測面とナノ粒子の配列の間の分離は、hのように定義されます。 B)H = A。 C)、H = 2A。 D)H =λ。 e)はH =2λ。
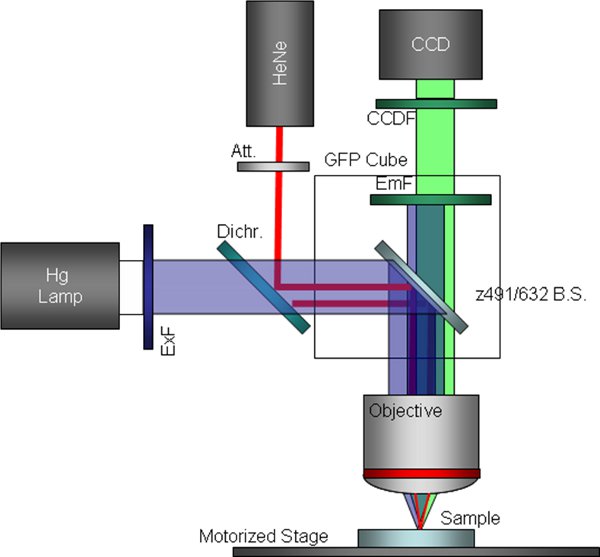
図3バイパス励起フィルターと交換したダイクロイックビームスプリッターを含むカスタマイズされた蛍光顕微鏡の構成9回路図。これは、同時トラップと蛍光イメージングのために使用される構成です。
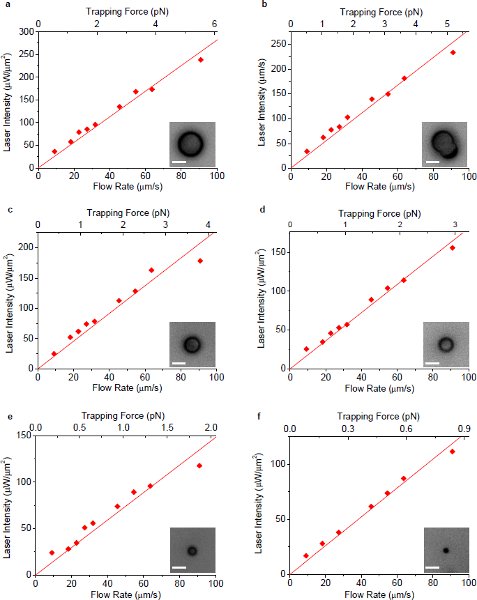
図4 10プラズモニックトラッピングを利用した流体を周囲の流量の関数としてトラップを維持するための最小のレーザー強度。すべての光強度は、顕微鏡対物下で試料面で測定されています。 (A) - (f)にそれぞれ、直径7.3、6.3(非球面)、5.0、3.9、2.5および1.1μmの単一のポリスチレンビーズの測定結果を示す。インセットは、粒子の対応する顕微鏡画像を示す。すべての画像のスケールバーの長さは5μmを表す。
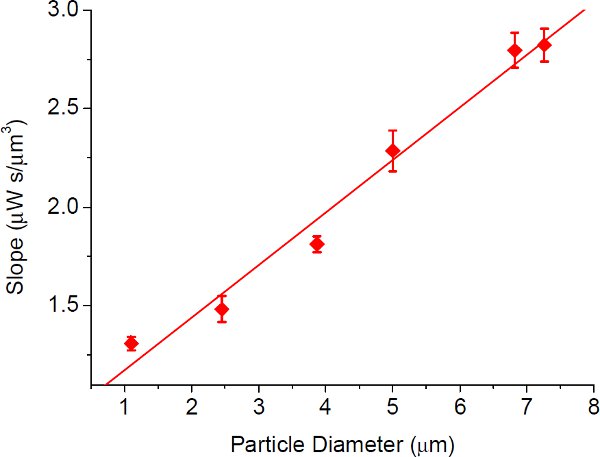
図の原点を通る図5近似直線の傾き。プラズモニックトラッピングのための粒子サイズ対4。エラーバーは、線形近似の標準偏差を示す。図中の近似直線の傾き(光強度のしきい値と流量との比)。 4は、特に小さい粒子のプラズモントラッピングの利点を示す、この図に示すように粒径とほぼ直線関係を持っています。
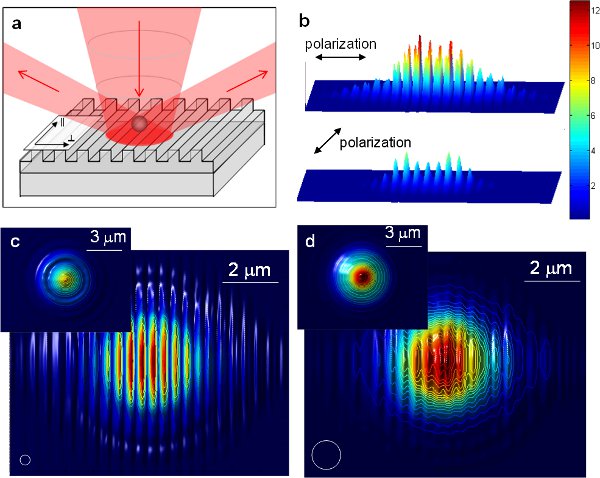
図6 1次元周期的ナノ構造を利用した強化された光トラッピングの11()模式図。入射ビームは、遠方界での周期的ナノ構造によって回折される。 (B)ファーフィールドでの二つの直交偏光のナノ構造と光の強度分布。 (b)のFDTDシミュレーションを用いて得られた417 nmの周期を持つアルミ格子の表面に二つの直交偏光を持つ光の強度分布。分布は平坦なアルミニウム表面上に強度に正規化されています。 (C)と(c)350 nmのポリスチレンビーズとビーズ(D)が1μmのポリスチレンのための直接粒子の格子面に対する位置の上の粒子のための(d)のトラッピングポテンシャル。白い丸は、粒子の大きさを示しています。挿入図は、比較と同じ粒径のフラットアルミの表面上のトラップの可能性を示しています。値は、各粒径のために正規化されます。すべてのFDTDシミュレーションの数値の場合はビューのフィールドには、10 ×8μmの2です。
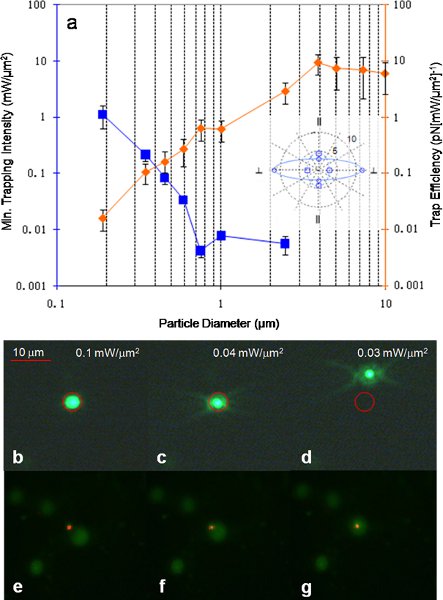
図7 11()トラップの効率性と格子線のビームの偏光に垂直で、さまざまなサイズのポリスチレンビーズのために測定された最小トラッピング強度。挿入図のトラップは、格子の規則に3.87 UMポリスチレンビーズ垂直と平行を変換するための捕集効率の非対称性。実線は(大型の非対称性)格子への入射光偏光に対して垂直で得られ、および破線は、(小は非対称性)格子への入射光偏光パラレルで得られる。単位は(PN [MW /μm2である ] -1)になります。 (B) - 蛍光590nmのポリスチレンビーズの(d)のトラッピングデモンストレーション。赤い円は、レーザー光が見られるには余りにも暗くなったようにレーザースポットの位置を示します。最初は粒子がパワーが低くなるにつれ、粒子のブラウン運動は粒子が脱出できるように、トラップ力を克服し、より高い電力でのスポット内に捕捉される。 (E) - 蛍光卵巣癌の細胞核の(g)をトラッピングデモンストレーション。トラッピングを開始するために必要な最低限の強度は16μW/ 20倍対物レンズを用いて得られたμmの2であった。
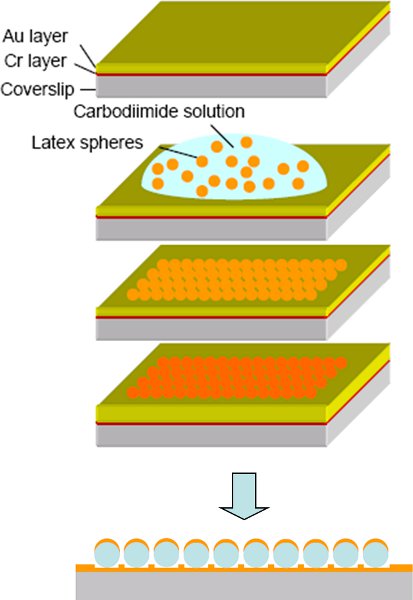
ガラスカバースリップ上にCrおよびAu薄膜層の)蒸発:キャップの形をした金ナノ粒子の図8 14作製の手順。 B)1時間球のポリスチレン球懸濁液と吸着への曝露。 c)非吸着ポリスチレン球と表面の乾燥の除去。テンプレートの球体の上に金の別の層のd)蒸発。金だけテンプレートの球体の上面を覆うキャップ状のAuナノ粒子の配列、の電子)回路図。
ディスカッション
トラッピングのこれらのメソッドの意義は、彼らが持続的な10 3μW10μW/μm2であるの順番でどこかへ/μm2であるの順番のどこかからのトラップのために必要な光強度を減少させることです。10,11は、これらの技術上の制約金ナノ粒子の配列は、克服しなければならないの加熱の問題を経験することです。この問題を克服するために、誘電体材料で構成されている2次元フォ...
開示事項
利害の衝突は宣言されません。
謝辞
我々はまた内に記載された方法のほとんどを開発するための暁ミャオ族とベンウィルソンに感謝したい。この作品は、国立科学財団(DBI 0454324)と国立衛生研究所(R21 EB005183)でとECKへNIGMSからPHS NRSA T32 GM07270によって賄われていた。
資料
| 材料名 | タイプ | 会社 | カタログ番号 | コメント |
| アクシオイメージャ顕微鏡 | D1M | ツァイス | D1M | ツァイスアクシオImager.D1M |
| 顕微鏡対物 | 50x/0.55 | ツァイス | LD EC Epiplan - NEOFLUAR 50x/0.55 HD DIC | |
| ツァイスの顕微鏡カメラ | AxioCam MRC | ツァイス | ||
| ヘリウムネオンレーザー | 35 mWの | 研究エレクトロオプティクス | ||
| 可変減衰器 | 連続可変ND | ThorLabs | NDC - 100C - 4M | 顕微鏡の強度を調整するための |
| ツァイスフィルターセット | フィルターセット#17 | ツァイス | 488017-9901-000 | フィルターセット#17 |
| 顕微鏡のスライド | 0.5 mmの厚さ | VWR | ||
| 3T3マウス細胞核 | フレッドハッチンソンがん研究センター | できるだけ冷たい店 | ||
| アクリジンオレンジ色素 | フレッドハッチンソンがん研究センター | |||
| ウシ血清アルブミン | PBS 1〜10配給 | フレッドハッチンソンがん研究センター | ||
| 454 nmのポリスチレンラテックス球 | Polysciences、(株) | |||
| カルボジイミド塩酸塩(EDC) | 1 - エチル-3 - (3 - ジメチルアミノプロピル) | G -バイオサイエンス | BC25 - 1 | |
| 金(堆積用) | ||||
| 反射支配回折格子 | エドモンドオプティクス | |||
| リン酸緩衝生理食塩水(PBS) | ダルベッコのリン酸緩衝食塩水(D - PBS)(1X) | インビトロジェン | 14190-144 | |
参考文献
- Jones, T. B. . Electromechanics of Particles. , (1995).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc. Natl. Acad. Sci. U.S.A. 94, 4853-4853 (1997).
- Neuman, K. C., Chadd, E. H., Liou, G. F., Bergman, K., Block, S. M. Characterization of photodamage to Escherichia coli in optical traps. Biophys. J. 77, 2856-2856 (1999).
- Chiou, P. C., Ohta, A. T., Wu, M. C. Massively parallel manipulation of single cells and microparticles using optical images. Nature. 436, 370-370 (2005).
- Hsu, H. Y., Ohta, A. T., Chiou, P. Y., Jamshidi, A., Nealea, S. L., Wua, M. C. Phototransistor-based optoelectronic tweezers for dynamic cell manipulation in cell culture media. Lab Chip. 10, 165-172 (2010).
- Righini, M., Ghenuche, P. S., Cherukulappurath, V., Myroshnychenko, F. J., Garcia de Abajo, R. Quidant Nano-optical Trapping of Rayleigh Particles Escherichia coli Bacteria with Resonant Optical Antennas. Nano Letters. 9, 3387-3391 (2009).
- Righini, M., Zelenina, A. S., Girard, C., Quidant, R. Parallel and Selective Trapping in a Patterned Plasmonic Landscape. Nature Physics. 3, 477-480 (2007).
- Miao, X., Lin, L. Y. Large dielectrophoresis force and torque induced by localized surface plasmon resonance of a cap-shaped Au nanoparticle array. Opt. Lett. 32, 295-297 (2007).
- Wilson, B. K. . Manipulation of Nanoparticles and Biological Samples through Enhanced Optical Forces [dissertation]. , (2009).
- Miao, X. Y., Wilson, B. K., Pun, S. H., Lin, L. Y. Optical manipulation of micron/submicron sized particles and biomolecules through plasmonics. Optics Exp. 16, 13517-13525 (2008).
- Wilson, B. K., Mentele, T., Bachar, S., Knouf, E., Bendoraite, A., Tewari, M., Pun, S. H., Lin, L. Y. Nanostructure-enhanced laser tweezers for efficient trapping and alignment of particles. Optics. Exp. 18, 16005-16013 (2010).
- Miao, X., Wilson, B. K., Cao, G., Pun, S. H., Lin, L. Y. Trapping and Rotation of Nanowires Assisted by Surface Plasmons. IEEE Journal of Selected Topics in Quantum Electronics. 15, 1515-1520 (2009).
- Miao, X. Y., Lin, L. Y. Trapping and manipulation of biological particles through a plasmonic platform. IEEE Journal of Selected Topics in Quantum Electronics. 13, 1655-1662 (2007).
- Miao, X. . Plasmonics for Micro/Nano Manipulation and Optofluidics [dissertation]. , (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved