このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの表在性リンパ節手術
要約
同じマウス内で時間をかけて免疫応答の進行を追跡するには、リンパ節は、順次手術によって除去することができる。ここでは、この手法を実行する方法について説明します。
要約
ワクチン、感染症や腫瘍に対する免疫応答の進行を理解する免疫学の分野では、応答は、しばしば時間をかけて続いています。同様に、リンパ球の恒常性の研究では、時間経過実験をする必要があります。同じマウス内でこれらの研究を実行すると、実験的な変動と同様に使用されるマウスの数を減らすことが理想的です。血液の撤退は時間経過実験のパフォーマンスを可能にする、それが唯一の循環リンパ球に関する情報を提供し、細胞1-4の限られた数を提供しています。体を循環するリンパ節に存在するリンパ球は異なる特性を持っているので、両方の場所を調べることが重要です。手術によるリンパ節の連続除去が免疫応答や時間をかけて同じマウスの免疫細胞の増殖に従うユニークな機会を提供しています。 PEに十分であるリンパ節あたり1×10 6個の細胞の間にさらに、この技術は、収量表現型の特性および/または機能アッセイをrform。シーケンシャルリンパ節の手術やリンパ節郭清が正常に私たちと他の5月11日によって使用されています。ここでは、上腕動脈と鼠径部リンパ節がanesthetisedマウスの皮膚に小切開を行うことにより除去することができる方法について説明します。手術は表面的な、急速に行われるので、マウスは非常に迅速に回復し、よくヒールや過度の痛みを経験していません。一日おきに、それは時間のコースの実験を可能にする1つまたは2つのリンパ節を採取することが可能です。この手法は、時間をかけてリンパ節に存在するリンパ球の特性を研究するため、適しています。このアプローチは、様々な実験デザインに適しており、我々は多くの研究室は、順次リンパ節の手術を行うことの恩恵を受けるだろうと信じています。
プロトコル
1。手術前の準備
マウスは、アニマルケアのガイドラインのカナダ人評議会に従って処理した。
- ケタミン/キシラジン(150/300 mg / kg投与、ip)を注入するか、またはイソフルランの吸入(2%、1Lの酸素)によるAnesthetiseマウス。可能であればそれは麻酔時間と深さのよりよい制御を可能にするとして、イソフルランを使用する必要があります。また、酸素は動物の生理機能をサポートし、同時に投与される。また、イソフルランは、直接肺によって除去されるため、肝臓または腎臓の代謝を必要としません。
- または他の鎮痛剤 - ブプレノルフィン(0.1 mg / kg体重、皮下0.05)注入します。
- (イソフルランが使用されている場合)眼の乾燥を避けるために手術前にマウスの目に軟膏を適用します。
- マウスは、その足をつまんで、そのしっぽを丸めて眠っていることを確認します。マウスが反応しない場合は、手術を続行します。
2。外科
これは、手術による表在リンパ節(LN)の4を削除することが可能である:2鼠径部と2上腕。古いマウスの脂肪組織の存在は、LNの分離を妨げることができるのでLNの単離は、若いリーンマウス(6-8週)の方が簡単です。しかし、この制限は、反復練習で克服されています。マウスの快適さのために、我々は時間で2 LNSの最大の収穫、我々はタイムコース実験を行うとき、我々は一日おきにLNSを収穫。また、感染を防ぐために、抗生物質をマウスに与えられたが、我々はしないと傷がうまく治癒されている可能性があります。一つは、実験デザインに応じて、抗生物質の使用は(細菌への応答が測定される場合など)が観察結果に影響を与える可能性があることに注意する必要があります。すべての楽器がそれぞれの使用後に滅菌され、無菌状態は、手続きを通して維持されることに注意してください。- その側にマウスを置きます。
- あなたがincisioを実行する領域をローカライズするnは、あなたが収穫したいLNによって異なります。 ( 図1)。
- その領域に、クロルヘキシジン、または他の消毒剤を適用します。
- 前足の裏に、腹部の近くに後足( 図1)上記のいずれかを鋭いハサミで小さな切開(約5mm)を作る。
- あなたは鉗子で切断した緩い毛を削除します。必要であれば、切開を行う前に、マウスを剃ることができます。しかし、それは手順が長く、我々はここに示すように、それは両方とも非常に稀である治癒または減少感染症を改善しないので、それは必要がないことを見つける。
- LNを見るために2ピンセットで切開を伸ばす。切開は10 mmに達することがあります。 LNは灰色がかったまたは周囲の脂肪よりも暗く表示されます。
- 1鉗子とLNの上に筋膜(脂肪と組織を網羅薄い膜)をつまんで、周囲の組織を壊さずに軽く引っ張ります。
- 可能な限りunde第二鉗子を配置LNをrneath。第一鉗子を使用すると、筋膜を破るとLNを削除します。あなたが正常にLNを収穫している場合は、血液の汚れは、LNが以前にあった場所に表示されます。 LNは、等張液に沈むことに注意してください。この単純なテストは、あなたがLNではなく、脂肪組織を抽出していることを検証することができます。
- 全く毛が傷口に入っていないことを確認します。
- (皮膚の内側)を一緒に皮膚の2つの部分を張り付けることで、クリップでそれらをステープルで切開を閉じます。我々は、適用し鉗子でいくつかのミシェル·クリップを使用しています。切開の大きさに応じて、1つまたは2つのクリップを取り付けます。組織が回復するときに最も頻繁に、クリップが脱落します。
3。術後処置
- マウスは、手術後に容易に供給することができるようにケージの底にいくつかのウェットフードを追加します。
- 手術後6から8時間ほど、彼らは痛みを経験していないことを確認するためにマウスを確認してください。慎重に行動(姿勢、歩行、内を観察する毛皮の同族と外観teraction)。マウスの全体的な外観が悪い場合には、ブプレノルフィンの2回目を管理します。次の日でマウスは、ブプレノルフィンの投与を継続するそうでなければ彼らの正常な動作を取り戻す必要があります。マウスは以前動物·ケア協議会によって決定され、受け入れられるエンドポイントに到達することはありません。あなたの動物のケアのビバリウムの技術者からアドバイスや助けを求めることをお勧めします。
4。リンパ節の取り扱い
- 研究室では、単一の細胞懸濁液を得るために、通常の手順に従って、LNを解離させる。我々は、すりガラスのスライドに対して、LNを押すと、定期的にLNあたり1-2×10 6細胞を得る。また、我々は、RNA抽出のためにLNを準備します。
- あなたの通常のプロトコルに従って細胞を染色。あなたが期待LNフローサイトメトリー·プロファイルを取得する必要があります。
5。代表的な結果
前方と側方散乱pの例多くの手術によって、または犠牲マウス( 図2)から麻酔マウスから採取したLNSのための示されています。プロフィールやライブリンパ球ゲート内の細胞の割合はLN手術は収穫細胞への適切な手法であることを示していると同じです。
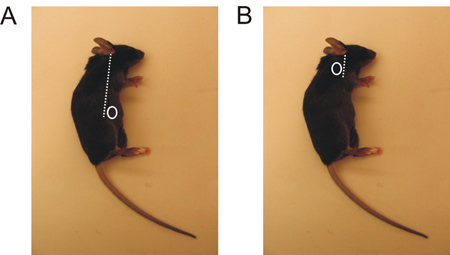
図1マウスの鼠径部および上腕LNの局在。 A.鼠径LNは少し腹に向かって、ちょうど後足の上に位置しています。 B.上腕LNは、前足の後ろに位置している。
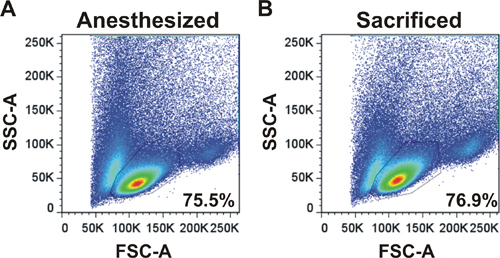
リンパ球の図2フローサイトメトリープロファイルは、LNの手術後に得られた。前方と側方散乱プロファイルはanesthから収穫LNSのための示されている手術()によって犠牲マウス(B)からetizedマウス。 LNSは、解離し、収穫し、フローサイトメーターで分析した。ライブリンパ球ゲート内の細胞のパーセンテージが表示されます。
ディスカッション
我々は、多くの実験系に適用することができLN手術のプロトコルを記述している。免疫応答または免疫細胞の恒常性に従うことが非常に有用ですが、このテクニックはいくつかの制約があります。まず、4つのみLNSを収穫することができます。第二に、研究免疫応答は、全身であるか、浅鼠径または上腕(皮排水)LNSで実行する必要があります。最後に、採取した細胞の数は、LNの除去、絶対?...
開示事項
利害の衝突が宣言されません。
謝辞
私たちは、プロトコルの重要な読書のためのシルヴィージャンルサージとすべてのラボのメンバーに感謝します。この作品は、健康の研究(CIHR)のカナダの協会からの助成金(MOP-77545)によってサポートされていました。ナタリーLabrecqueはFRSQシニア奨学金によってサポートされており、メリッサマチューはNSERCアレクサンダー·グラハム·ベル·カナダ大学院奨学金を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬名 | 会社 | カタログ番号 | コメント |
| グレーフェファインパターンプレミアム鉗子 | ハーバード装置 | 52から2144 | 強く湾曲し、10センチ(4インチ)、0.8 mmの先端 |
| 鉗子を適用すると削除ミシェルクリップ | ハーバード装置 | 52から3779 | 12.5センチメートル(5) |
| ミシェル·クリップ100 | ハーバード装置 | 52から3746 | 7.5〜1.75ミリメートル |
| Temgesic(ブプレノルフィン塩酸塩) | シェリング·プラウ | ||
| Vetalar(塩酸ケタミン) | Bonicheアニマルヘルスケア | DIN:01989529 | |
| Rompun(キシラジン) | バイエル | DIN:02169592 | |
| イソフルレン | ABBOTT | DIN:02032384 | |
| Hypotearsの眼軟膏 | ノバルティスOphtalmics | DIN:02133288 | |
| Baxedin(イソプロピルアルコールでClorhexidineグルコン酸2パーセント70%) | オメガ | L0000017 | DIN:02251477 |
参考文献
- Zehn, D., Lee, S. Y., Bevan, M. J. Complete but curtailed T-cell response to very low-affinity antigen. Nature. 458, 211-214 (2009).
- Vezys, V. Memory CD8 T-cell compartment grows in size with immunological experience. Nature. 457, 196-199 (2009).
- Zhou, X. Differentiation and persistence of memory CD8(+) T cells depend on T cell factor 1. Immunity. 33, 229-240 (2010).
- Wirth, T. C., Badovinac, V. P., Zhao, L., Dailey, M. O., Harty, J. T. Differentiation of central memory CD8 T cells is independent of CD62L-mediated trafficking to lymph nodes. J. Immunol. 182, 6195-6206 (2009).
- Rooke, R., Waltzinger, C., Benoist, C., Mathis, D. Targeted complementation of MHC class II deficiency by intrathymic delivery of recombinant adenoviruses. Immunity. 7, 123-134 (1997).
- Witherden, D. Tetracycline-controllable selection of CD4(+) T cells: half-life and survival signals in the absence of major histocompatibility complex class II molecules. J. Exp. Med. 191, 355-364 (2000).
- Labrecque, N. How much TCR does a T cell need. Immunity. 15, 71-82 (2001).
- Leignadier, J., Labrecque, N. Epitope density influences CD8+ memory T cell differentiation. PLoS One. 5, e13740 (2010).
- Leignadier, J., Hardy, M. P., Cloutier, M., Rooney, J., Labrecque, N. Memory T-lymphocyte survival does not require T-cell receptor expression. Proc. Natl. Acad. Sci. U.S.A. 105, 20440-20445 (2008).
- Obst, R., van Santen, H. M., Mathis, D., Benoist, C. Antigen persistence is required throughout the expansion phase of a CD4(+) T cell response. J. Exp. Med. 201, 1555-1565 (2005).
- Bassett, J. D. CD8+ T-cell expansion and maintenance after recombinant adenovirus immunization rely upon cooperation between hematopoietic and nonhematopoietic antigen-presenting cells. Blood. 117, 1146-1155 (2011).
- Lacombe, M. H., Hardy, M. P., Rooney, J., Labrecque, N. IL-7 receptor expression levels do not identify CD8+ memory T lymphocyte precursors following peptide immunization. J. Immunol. 175, 4400-4407 (2005).
- Leignadier, J., Rooney, J., Daudelin, J. F., Labrecque, N. Lowering TCR expression on naive CD8+ T cells does not affect memory T-cell differentiation. Immunol. Cell. Biol. 89, 322-325 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved