このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
RNAiによる遺伝子ノックダウンと
要約
このプロトコルでは、とRNAiによる遺伝子サイレンシングを組み合わせる利尿アッセイは蚊体液の排泄をしています。
要約
このビデオプロトコルは、昆虫の特定の遺伝子をノックダウンし、排泄率を測定するための新規バイオアッセイを行うための効果的なテクニックを示しています。このメソッドは、昆虫の利尿のプロセスのより良い理解を得るために使用し、単一血粉内の液体を大量に取ることができます。吸血節足動物における利尿の研究に特に有用であることができます。
in vivoで利尿アッセイと組み合わせることは、このRNAiによる遺伝子ノックダウンは、 ネッタイシマカ蚊利尿1のアクアポリン遺伝子のRNAiによるノックダウンの効果を研究するためにハンセンラボによって開発されました。
プロトコルは、2つの部分のセットアップです。最初のデモでは、単純な蚊噴射装置を構築する方法とRNAiによる遺伝子ノックダウンのために蚊の胸部にdsRNAを準備して注入する方法を示しています。第二デモを決定する方法を示しています。in vivoでのバイオアッセイで使用して蚊の排泄率。
プロトコル
パートI -大人のネッタイシマカ蚊のRNAiによる遺伝子ノックダウン。実験の概要については、 図1を参照してください。
1。 dsRNAの合成
- 関心とコントロールdsRNAの遺伝子に対する特異的dsRNAを合成する。注:私達は3 '特異的cDNA 2の端部と5に接続されたT7プライマー配列を持つ'末端(5'-TAA TAC GAC TCA CTA位置して300から500塩基対の範囲でPCR断片のために開発のプライマーをお勧めしますTAG GG-3 ')。フラグメントの一意性は、BLASTN解析3で確認されるべきである。
- dsRNAを合成する転写反応のためにT7 RNAポリメラーゼを利用したAmbion社Megascript T7高収率転写キット(Ambion社、試薬のテーブル)を使用します。注:同様の試薬およびキットは、他の利用可能です。
- dsRNAを精製するために、Megascriptキットとの指示に従って、塩化リチウムを沈殿させる。
- purificat後イオン、滅菌水でdsRNAペレットを溶解する。マイクロインジェクションのための適切な粘度を確保するために、dsRNAの濃度は2μg/μlを超えないようにしてください。
2。注射の準備
- シンプルなマイクロインジェクタは、チューブ、はさみ、金属針、1mlの注射器、および1 mlプラスチックピペットチップ( 図2を参照)を使用して構築することができます。チューブの長さは〜40 cmにカットする必要があります。また、自動化されたマイクロインジェクタなどドラモンドNanojet II 4として使用することができます。
- 2 mlのスケールマークで注射器の先端(針ハブ)をカットし、プランジャーからゴムプランジャーヘッドを取り外します。
- パンチ穴ゴムプランジャーヘッドに金属針を使用して、針ハブに戻るゴムプランジャーヘッドを配置します。
- チューブの一端に針ハブを置き、マウスピース(あるいは、10ミリリットルSYとして使用されるもう一方の端に1 mlのプラスチック製のピペットチップを配置ringe)を注入するために必要な空気の圧力を生成するために使用することができます。
- ゴムプランジャーヘッドの穴にガラスキャピラリー針を配置し、幅は液体が流れるように十分大きくなるように針の先端を切る。注意:針先の最適なサイズは経験的に決定する必要があります - 針の幅が大きすぎる場合は、この針の幅が小さすぎる場合、それが浸透することは不可能になり、外傷や高い蚊の死亡率になります蚊外骨格。
- 準備されたdsRNAはサンプル中の水没注射針を、口の部分(またはシリンジ)で液体を吸引することにより、注射針に液体サンプルを描画します。注:この手順は 、in vivo利尿アッセイプロトコルでで使用されているPBS緩衝液(下記参照)を含む蚊に注入されているすべての液体試薬のと同じです。
3。蚊を収集し、麻酔
- コレクション1コレクションバイアルに、バッテリ駆動の吸引とT蚊。コレクションバイアルの上にキャップを置き、蚊を麻酔するためにクリーンなCO 2パッドの上に瓶を置きます。注:代わりに蚊が氷の上で麻酔をすることができます。
4。蚊インジェクション
- コレクションバイアルを開き、直接CO 2パッドの上に蚊を配置し、蚊が麻酔するまで待ちます。
- すべての男性を破棄します。
- 注射のための容易なアクセスを可能にするために側に蚊を並べる。
- 怪我を避けるために、脚や翼によって蚊をつかむ。また、蚊を操作するために微細な絵筆や羽を使用することができます。
- 第一蚊を注入する準備ができたら、穏やかに鉗子で胸部の片側をサポートしており、胸郭の反対側( 図2)に針の先端を挿入します。それはキューティクルの薄い部分に注入して針を押して避けることをお勧めします胸郭に深くO。
- 針が配置されたら、蚊に液体を吹く。所望の量は、針で液体のメニスカスを監視することによって決定することができます。特定のボリュームのために必要なミリメートルの数は、ガラスキャピラリー針(πR2時間)のシリンダー容積を計算することによって決定することができます。一般的に注射に使用されるdsRNAの有効量は1μgです。
- 液体蚊に注入されたら、慎重に針を撤回。胸郭の外側に大きな液滴の形態の場合、蚊は捨てられるべきです。その後、次の蚊で、このプロセスを繰り返します。
5。蚊の回収·貯留
- 注入後、ストレージ用のコンテナに蚊を配置します。たとえば、1パイントワックスはメッシュが段ボール蓋で保護されたカバーで(スープカップ)段ボールカップが並ぶ。蓋が公開するカバーメッシュのカットアウト部を有している。一度すべてのMOsquitoesがコンテナ内に配置され、インキュベーションのための環境制御チャンバー内にコンテナを配置し、そのようなメッシュ被覆の上に置かれ、20%ショ糖に浸した綿球などの食料源、で蚊を提供しています。 in vivoで利尿アッセイを実行する前に、各蚊の水和状態を標準化するために12時間の水源のdsRNA注入蚊を奪う。
- dsRNAを媒介遺伝子ノックダウンの効率は可変にすることができます。遺伝子サイレンシングは、注入後1日を始めることができ、それは注入後4 6日まで続く可能性があります。最大の遺伝子ノックダウンを達成するために最適な時間は、使用されるすべての遺伝子について実験的に決定する必要があります。我々が進む前に、一般的に、我々は、dsRNAの注射後3日待ってください。
パートII -大人のネッタイシマカ蚊の in vivo利尿アッセイでは
注:このプロトコルは、著者によって開発されたと黄熱病の蚊のネッタイシマカ 1にアクアポリン蛋白質のRNAiによるノックダウンに使用されます。個々の蚊の間でのばらつきを避けるために、蚊は、グループで分析する必要があります。技術的な理由から、我々は、治療ごとに5蚊のグループをお勧めします - 蚊が注射後の尿を排泄し始める前に、最初の体重測定を実行する時間の限られた量があります。
6。蚊を収集し、麻酔
- 蚊のコレクションの前に、分析精度のバランスを使用してキャップを持つ空のコレクションバイアルの重量を記録します。このバイアルは、後続のすべての測定に使用されます。
- アスピレーターで体重コレクションバイアルに5メスの蚊を収集します。コレクションバイアル上にキャップを置き、蚊を麻酔するのに数秒のためにCO 2パッドの上に座らせて。
7。初期重量測定
- tを取る高精度のバランス上のキャップで蚊を含むコレクションバイアルを配置することにより、5蚊の彼の初期重量測定。
- 蚊の体重とキャップを使用してコレクションバイアルを取り出し、キャップを持つ空のコレクションバイアルの重量を差し引いて5蚊の群の重量を計算します。
- コレクションバイアルを開いて、蚊の体重を記録した後、CO 2のパッドに直接蚊を配置します。蚊は体重測定中に目覚め始めている場合は、それを開いて、パッドの上に蚊を配置する前に数秒間、CO 2パッドの上にバイアルを設定します。
8。注射の準備
- RNAiによる遺伝子ノックダウンプロトコルに与えられた指示に従って、マイクロインジェクターを設定します。
- マイクロインジェクタのガラスキャピラリー針を置き、針の先端を断つように幅がLIQのために十分な大きさです。流れるようにUIDを指定します。
- 水没PBS緩衝液で針と注射針にバッファを描画するには、このプロトコルに使用するため、所望の量は、それぞれの蚊のためにPBSの1.25μlです。注:この量は女性の蚊5で巻き取られる血漿の平均量を模倣しています。
9。蚊インジェクション
- マイクロインジェクターで簡単にアクセス可能にするために蚊を並べる。
- 針が配置されたら、蚊にPBSバッファを吹く。
- 液体蚊に注入されると、液滴は、胸郭の外側に形成するかもしれません。この液滴は、慎重に次のステップの前に削除する必要があります。
- 次の蚊でこの注入プロセスを繰り返します。経験と、蚊の生存率は、注入後ほぼ100%になります。
10。計量蚊
- 注入後、穏やかにコレクションバイアルに蚊を配置とキャップ。高精度のバランス上のキャップで蚊を含むコレクションバイアルを配置することにより、5蚊の最初の体重測定を行います。
- キャップ付き蚊やコレクションバイアルの重量を取ることによって、5蚊の群の重量を計算し、キャップを持つ空のコレクションバイアルの重量を減算します。注:蚊はCO 2麻酔パッドから除去した後、2分以内に尿を排泄し始めるので、それが排 泄を開始する前に体重測定を行うことが重要です。
- 彼らは尿を排泄し始めます小さな容器に蚊を置きます。
11。二番目以降の体重測定
注:蚊の体重測定が30分間隔で撮影する必要がありますが、これは排泄率に応じて、短いか長い間隔に調整することができます。
- 30分後、grouを収集キャップと同じコレクションバイアルにアスピレーターで5蚊のp。高精度のバランス上のキャップで蚊を含むコレクションバイアルを配置することにより、蚊の次の重量測定を取る。
- 測定後、次の30分間、同じ保持容器内の蚊を配置します。
- 目的の時間のために、このプロセスを繰り返します。
12。決定モスキート排泄率
- 5蚊の群に注入した液体の総量は、直ちに注入後の重量から蚊の初期重量を差し引くことによって計算することができます。
- 特定の時点で蚊のグループによって排泄された尿の量は、特定の時点での蚊の重量から蚊の初期重量を差し引くことによって計算することができます。
- 特定の時点での排泄率は、配当によって計算することができます。鼎液体注入の合計額( 表1)ことにより、この時点で排泄される尿の量。
13。代表的な結果
RNAiによる遺伝子ノックダウンとin vivoでの利尿アッセイでは、ネッタイシマカ蚊利尿におけるアクアポリンの影響を研究するハンセンラボで使用されている。 ネッタイシマカマルピーギ管で表現されている3つのアクアポリンは蚊1を制御するために比較して排泄率に大きな影響をノックダウンした。 図4は、利尿アッセイはネッタイシマカとネッタイイエカの間の排泄率を比較するために使用されている実験の代表的な結果を示しています。異なる温度で。
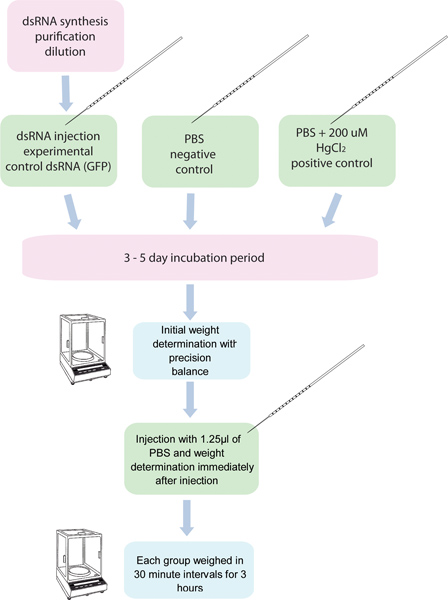
図1。 10蚊EA の RNAi /利尿アッセイのフローチャートを示す。5グループchは、特定の遺伝子のdsRNAを注入されると10蚊の別の5つのグループはコントロールするdsRNAを注入されています。 PBSで200μMHgCl 2で注入された蚊の別のグループは、ポジティブコントロールとして使用されています。これらの蚊は、注射の前に秤量し、3時間30分間隔で注入した後にされています。
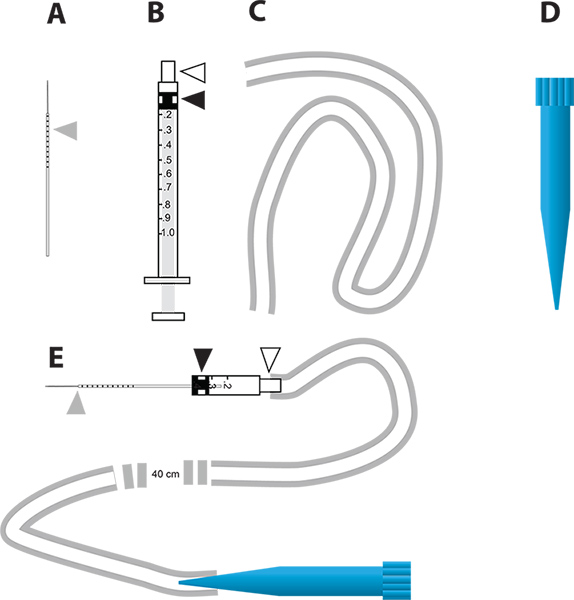
図2。 RNAiによる遺伝子ノックダウンとin vivoでの利尿アッセイでシンプルなマイクロインジェクション装置。A.ガラスキャピラリー針は注射に使用されます。灰色の三角形は、蚊に注入される液体の量を示すために、針に描かれたミリメートル単位で表します。 B. 1 mlシリンジは、マイクロインジェクタを構築するために使用される。白い三角形は、針ハブを表し、黒三角は、シリンジのプランジャに取り付けられたゴム製のプランジャーヘッドを表しています。 Cにマウスピースを接続するためのチューブインジェクタ。マイクロインジェクション装置のマウスピースとして使用されているD. 1ミリリットル使い捨てピペットチップ(ブルーチップ)。 E. ADの部品を組み込んだマイクロインジェクション装置は拡大図を表示するには、ここをクリックしてください 。
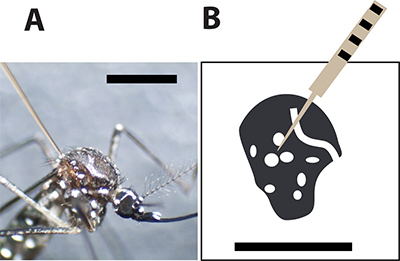
図3。最適な蚊注射部位。A.女性ネッタイシマカ蚊は、胸部に大きなスケールの間にガラスキャピラリー針で注入した。黒いバーはサイズ比較のために1ミリメートルを示しています。 B.雌の蚊の胸部の描画や白い斑点は、蚊外骨格の白鱗を表しています。注射針が貫通スポット間の蚊は、注入時の死亡率を最小限に抑える必要があります。
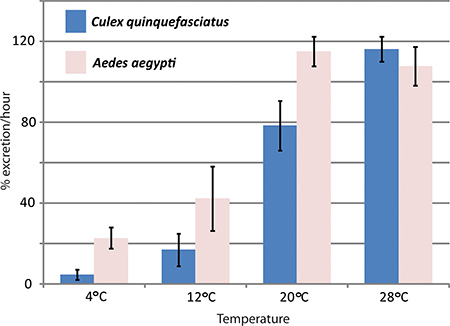
図4。温度の影響ネッタイイエカおよびネッタイシマカ利尿 上でトゥーレ。利尿アッセイは、異なる温度で、蚊、 ネッタイシマカおよびネッタイイエカの2種を用いて行った。注入後の最初の時間中に排泄率はパーセントで指定します。
| グループ | TARA (G) | 注入されません (G) | 注入後 (G) | 1Hポスト噴射 (G) | 平均重量(mg) | 量注入 (μL) | 量が排泄さ (μL) | %排泄 |
| 1 | 7.5938 | 7.6057 | 7.6104 | 7.6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7.8252 | 7.8349 | 7.8415 | 7.8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7.8896 | 7.9026 | 7.9077 | 7.906 | 2.6 | 1.02 | 0.34 | 33.3 |
in vivoでの利尿アッセイの結果表 1。 ネッタイシマカ 。4にネッタイシマカ雌蚊で行わin vivoでの利尿アッセイ ℃から生データ
ディスカッション
使用されるRNAiのプロトコルは、カリフォルニア州リバーサイド6,7の大学でアレキサンダーRaikhelの研究室で開発され、GarverとDimopoulos 4で公開プロトコルに似ていました。このビデオプロトコルに示すように、実験的なアプローチは、 生体内の設定での昆虫利尿に関与する遺伝子を研究するために使用することができます。昆虫の排泄器官、マルピーギ細管では、...
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、このプロトコルの彼女の批判的なコメントのためにビクトリアカーペンターに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬や機器の名前 | 会社 | カタログ番号 | コメント |
| MEGAscript T7ハイ·イールド·キット | Ambion社、(株) | AM1334 | |
| PBS緩衝液 | Sigma-Aldrich社 | P4417 | |
| プラスチックチューブ | ローカルベンダー | PVC | |
| 1ミリリットルのプラスチックピペットチップ | VWR | 83007-376 | ブルーチップ |
| 1mlの注射器 | ベクトン·ディッキンソンアンドカンパニー | 309602 | |
| はさみ | ローカルベンダー | ||
| 金属針 | ノースカロライナ州バイオ | 654307 | サイズ5 |
| パッドを飛ぶ | ジェネシー科学 | 789060 | |
| バッテリ駆動アスピレーターW /コレクションバイアル | UPMAラボ | IPMM 2000 | |
| ファインチップ鉗子 | 世界の精密機器 | 14095 | |
| ガラスキャピラリー針 | 世界の精密機器 | 1B200-6 | |
| ステレオ解剖顕微鏡 | ライカマイクロシステムズ | S6D | |
| 分析精度のバランス | メトラー·トレド | AB54S | |
| スクロース | Sigma-Aldrich社 | 84097 | |
| 1パイントは並んで段ボールカップをワックス | ローカルベンダー | 製造スープカップ | |
| メッシュネット | ローカルベンダー | プラスチック製のフライガーゼ |
参考文献
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved