このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遅発性筋痛を検出する熱赤外線イメージングの使用
要約
この調査の目的は、赤外線熱カメラを使用すると、運動後の筋肉痛を検出および定量するための有効なツールであるかどうか評価することであった。
要約
また、運動誘発性筋損傷(EIMD)として知られる遅発性筋痛(DOMS)は、、一般に時間の長時間物理的に非アクティブになっている人に経験し、練習1-4の予想外の試合で始まっているが、こともできますトレーニング5、通常の限界を超えて行使する選手で起こる。この痛みを伴う現象に伴う症状は、重度の衰弱痛み1,3,5に、わずかな筋肉の圧痛の範囲であり得る。これらの症状と24〜72時間後に運動1,3の間に関連する不快感の練習の終了に続く最初の24時間以内に増加し、ピークの強度。このような理由から、DOMSは、個々のパフォーマンスに影響を与える、と多くの1,4のための威圧的になることができるスポーツの傷害の最も一般的な再発形態の一つです。
最後の30年間の場合は、DOMSの現象は、相当な量を得て運動生理学、スポーツ、リハビリテーションの分野6の研究者、専門家の間で関心の。その基礎となるメカニズム、治療介入、および予防戦略1-5,7-12に関しては、この痛みの発生を調査して発表された研究の様々があった。しかし、それはこの条件6を定量化するために使用される測定ツールとメソッドの間でばらつきの広い額があるので、DOMSは、定量化する簡単な病理ではないことを文献から明らかである。それは合意は、それが困難な特定の介入が実際にこのタイプの痛みのかどうかに関連する症状を減少させることに役立つかどうかを確認するために行うDOMS用の最高の評価尺度、に行われていないことは明らかである。多くの研究が主観的ではなく、客観的な尺度である視覚的アナログスケール(VAS)10,13-15を 、使用して痛みを測定することに依存するためこのように、DOMSは、ややあいまいであると見ることができます。にもかかわらず針筋肉の生検、およびmyofibreタンパク質の血中濃度が約6のゴールドスタンダードと考えられるかもしれない、これらの血液タンパク質のいくつかの大きな変動がしばしば侵襲技術に関連する高いリスクに加えて、6,16の文書化されている。
したがって、現在の調査では、我々は、関連する筋肉の痛みを検出するために行使筋肉上記の皮膚の熱赤外(IR)イメージング技術をテストした。赤外線サーモグラフィを使用し、1950年の17以来、病気や感染症の様々なタイプの検出に成功したことが判明している。しかし驚くべきことに、何も近くには、DOMSと皮膚温度の変化に行われています。この調査の主な目的は、この安全かつ非侵襲的方法を用いてDOMSの変化を調べることであった。
プロトコル
1。エクササイズ
- この実験のための関心の筋肉は、肘の屈筋(上腕二頭筋)であった。
- 筋肉の強さは個々に適切な抵抗を与えることができるように各参加者のために測定した。これは、彼らの抵抗の最大値(RM)のための各参加者をテストすることによって決定した。
- RMをテストするため、我々は、筋肉の強さを測定するためにBIOPAC(DA - 100C)生体電気増幅器モジュール(モンテシステム、ゴレタ、カリフォルニア州)を介してコンピュータとインターフェースひずみゲージのデバイスを使用する。モジュールは、MP - 100 1秒あたり1,000ヘルツの周波数でデジタル変換器のサンプリングのアナログ、および24ビット(図10)の解像度で接続されました。
- ひずみゲージのデバイスは、45 °の角度でベンチに固定した。被験者は運動の力が自分の手首を介しているように、デバイスの背後に座ると、パディング領域に自分の肘を休ませるように指示された。これは、対象がないことを保証するために最善の方法だったtは上腕二頭筋(図11)以外の筋肉を募集。
- 強度は、それぞれの収縮は、収縮を分離する約45秒で持続時間が3秒であることで3度も決定した。 3つの測定の平均値はRMだ。
- 各参加者の二頭筋のためにRMを決定した後、運動の対象とするセッションは、そのRMの35%で行った。
- すべての被験者は、筋肉痛(DOMS)を誘導するために適切な重み付けダンベルを使用して同じ運動を施行した。これは、椅子に座っている間二頭筋の濃度のカールの25回の繰り返しの4セットを行うことにより実施し、肘で自分の太もも(図12)でサポートされました。
- 各被験者は、各セットの間に90秒の休息期間を与えられた。被験者は、25台の繰り返しのフルセットをやったか、彼らは着実に運動中に体重を制御するために失敗した場合に停止するように指示されました。
2。赤外のCaメラの準備とセットアップ
- 赤外線イメージングが行われる部屋は、偽熱測定値になりかねない、室温の違い、から任意の外部バイアスを最小限に抑えるために一定の温度に設定した。この実験の目的のために我々は約23℃に維持した温度管理された部屋を持っていた° C(+ / - 0.5 ° C)。
- カメラが離れて1メートルの距離に設定し、垂直の角度で肌に(9A図)測定される*.
- 必要な距離が設定された後、被験者は画像が撮影されるまでじっと立ってするように勧められた。これが数秒以上かかることはありませんが、これは撮影画像の精度を保証するために動きを最小限に抑えるために非常に重要です。
- これは、任意の赤外線干渉を最小限に抑えるため、部屋が暗い色の塗料ではなく、明るい色を有することが好ましい。
- 赤外線画像、becaを扱うときの照明にも重要です。蛍光灯やタングステン灯などの赤外線波が偽の高い測定値を与えることができる発する光源を使用してください。 LEDライトは、ほとんど何の赤外線干渉(図9B)を生成しないように最善の照明のオプションは、均一なLEDライトを装備したお部屋となります*
テストの*シリーズは、我々は別の角度(0(垂直)、15、30、45、および60度)で、皮膚の画像を比較してFLIR 660 IRカメラ(図8)を使用して、私たちのラボで行われた、と皮膚からの距離が異なる(1、2、および5メートル)で、正確に皮膚の温度を検出する。すべての画像は校正済みの熱電対と比較し、画像と熱電対の測定値の間に最高の相関は、垂直の角度と、肌から1メートル(R = 0.93)の距離であった。別の角度と距離は、ピクセレーションの損失が発生し、画像と熱電対の測定値間の全体的な相関を減少させた。
3。画像アックイテルメrement
- この実験の目的のために、行使筋肉のイメージは運動前、および24で撮影、そして48時間後に運動した。
- ターゲット以外のソースからの体温は、熱画像を乱し、誤った測定値を与えることができる。このような理由から、誰が意図したターゲットの横や背後に立ってはならない。
- この調査では、行使し、非行使のアームの両方の画像は、比較目的のために採取した。我々は、腕のいずれかを行使前述したように、そして他のアームは、(図4と5)を対照として使用した。
- それが誰に属している画像を識別することは困難になる可能性があるため、赤外線カメラからの画像の番号は、別のスプレッドシート上で即座に記録した。
4。画像の処理と分析
- 1.10.2:取得したIR画像は"ThermoVision ExaminIR"ソフトウェアのバージョンを用いて処理した。
- 必要な画像を選択した後R分析、関心の4つの領域は、ソフトウェアのインタフェース(図6)の統計ボックスを使用して、アームの取得画像上で同定された。
- アーム間の必要な地域の位置が特定されているときに、ソフトウェアは選択された領域のそれぞれのための温度の平均と標準偏差を示しています。我々は、どちらのクロス個別に各地域を比較したり、腕全体の平均気温(図7)を得ることができる。
5。ビジュアルアナログスケール&血液分析
- 視覚的アナログスケール(VAS)は、腕の主観的な痛みを評価するために使用されていました。スケールは10cm(100ミリメートル)一方の端に"痛み"、そして反対側の端に"非常に痛い"とマークしない長い行を持っていた。各参加者は、痛みへの反応を示すために、10cmの線に沿って印を作るために指示した。
- VASのは、24時間運動した後、および48時間で、練習前に被験者に投与した。
- 末梢血は、COLていた血液中のミオグロビンの濃度レベルを測定するために被験者からlected。
- 血液が運動の前に被験者肘静脈から描かれた、運動後30分は終わった、とで48時間。
- 血液は、細胞から血清を分離するために10分間4000rpmで遠心分離した。ミオグロビンの分析が行われたまで、次いで、試料を-80℃で保存した。
- ミオグロビンは、TOSOH"AIA - 360"自動酵素免疫分析装置(東ソー株式会社、東京、日本)を用いて測定した。ミオグロビンのアッセイキット(ミョー025297、ST AIA - PACKミオグロビンは)命令を製造するために従って使用した。
6。代表的な結果
この調査中に撮影した赤外線熱画像の結果は明らかに図1に表されます。 41被験者の行使腕を3期間(運動前、24時間後の運動、および48時間後の運動)で撮影した画像は、明らか運動前の温度、および48時間で撮影された温度と比較して2日目の温度の顕著な増加(24時間後の運動)。図1に示すように、平均皮膚温度は32.80でした+ / - 1.03 °日1 C(運動前)、および33.96 + / - 1.46 °日2用C(24時間後の運動)、および32.82 + / - 3日目のための1.29(48時間後の運動)。 1日目から2日目に皮膚の温度の違いは、(ANOVA、P <0.01)有意であった。
しかし、未行使の腕のために、3時間の期間の間で変化は明らかではなかった。平均皮膚温が33.08であることを図1に示して+ / - 0.83 °日1 C(運動前)、および32.79 + / - 1.42 °日2(24時間後の運動)、および33.17のためのC + / - 0.95のための3日目(48時間後の運動)。 3日間の皮膚の温度でこの差は有意(ANOVA、P = 0.38)はなかった。
VASによる痛みの測定値の結果を図2に示す。図に見られるがFigure 2は、報告された痛みは、2日目および3の劇的な増加が認められた。行使の筋肉の痛みのレベルは3.6から+ /増加 - 36.3へ、6.1日目1日+ / - 2日目で22.8、、37.5 + / - 25.3 3日目。 1日目から、この増加は有意であった(ANOVA、P <0.01)。
ミオグロビンの濃度レベルの結果を図3に示されています。この図に見られるように、1日目の2ミオグロビン濃度(事前に、&30分後の運動)の間の任意の変化はほとんどなかった。しかし3日目に、ミオグロビンの増加は非常に大きかった。 1日目の最初の2濃度と比較した場合、3日目のこの増加は、血液のミリリットル当たり約147ナノグラム(ng / mLの)であった。 3日目で249.51 ng / mLの - ベースラインで7.66 ng / mLに、31.66 + / - - 11.89 ng / mLの30分後の運動、および178.96 + /ミオグロビン濃度は、+ / 30.12であった。 3日目のこの増加は、(ANOVA、P <0.01)、高度に有意であった。
相関分析は、皮膚の温度との間で行われたIR画像、およびVASの痛みのレベルから得られる。それは2日目、そして2日目に皮膚の温度測定上のVAS測定値の間にかなりの相関があることがわかった。この相関は有意であった(R = 0.312、P <0.05)。しかし、VASの測定値と3日目の皮膚温との間には明らかな相関はなかった。この相関は有意であった(R = 0.047、P = 0.77)。
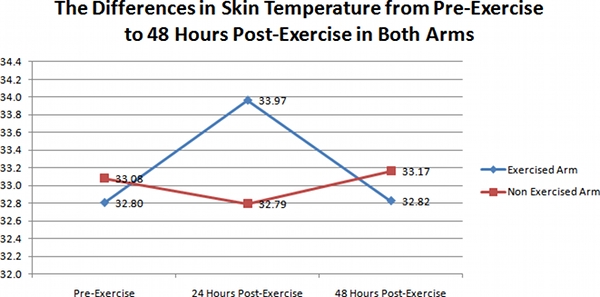
図1。行使腕(ダイヤモンド)で、皮膚の温度の違い、そして3日間の期間にわたって41科目の未行使の武器(四角)の代表的なグラフ。
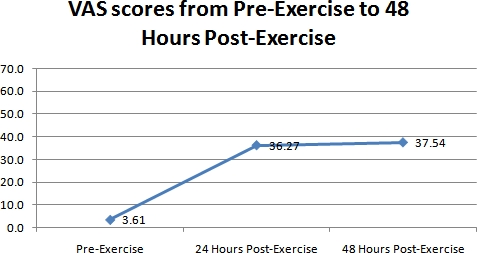
図2。全41科目の3日間の期間にわたるVASで測定した知覚筋肉痛の違いの代表的なグラフ。
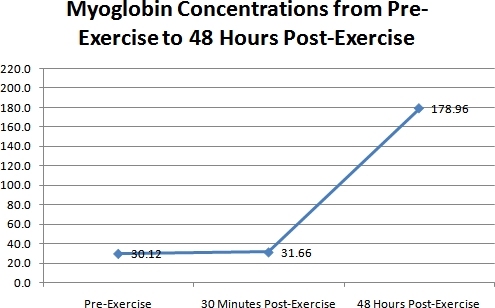
図 3の時間間隔毎に、全41科目のミオグロビン濃度の違い3。代表的なグラフ。
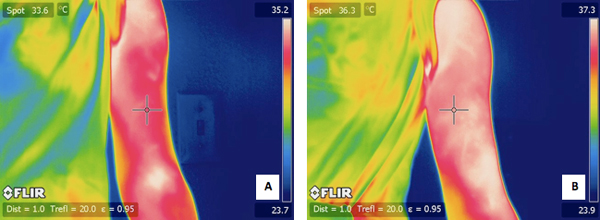
図4。運動の前に対象者の行使腕の)典型的なIRのイメージ。 24時間練習した後、同じ被験者の腕のB)IR画像。
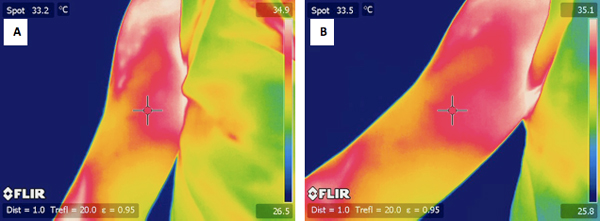
図5。運動前に被写体の未行使の腕の)典型的なIRのイメージ。 24時間練習した後、同じ被験者の腕のB)IR画像。
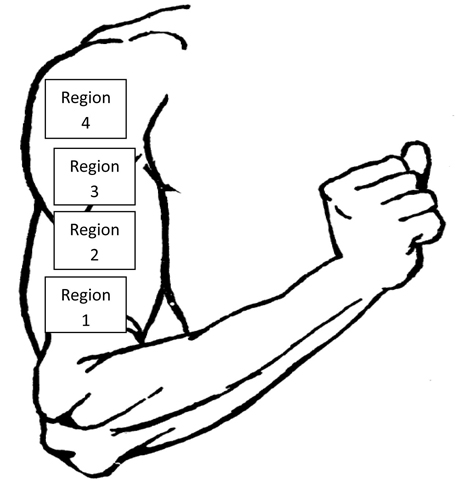
図6。THERMを分析するための関心の4地域の実例腕のアルイメージ。
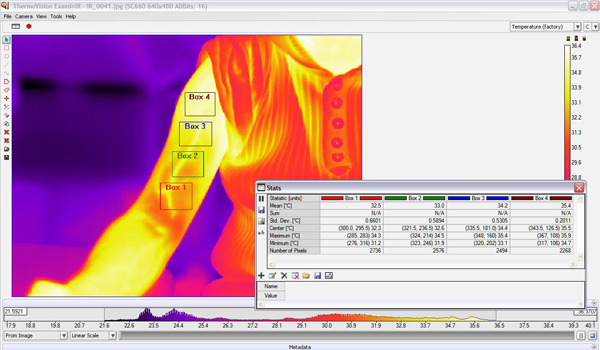
図7。行使腕のIR画像に興味の4箱を示す"ThermoVision ExaminIR"のためのソフトウェアインタフェース。また、各ボックスの統計的解釈も表示されます。

図8。この調査(FLIR 660)のために使用される赤外線熱カメラ。

図9。)離れて被験者の腕から赤外線カメラ1メーターのセットアップ。 B)LEDが点灯し、画像が撮影された実験室で使用。

図10。)筋力を測定するために使用されるBIOPACモジュール。 B)ひずみゲージのデバイスは4に固定5 °傾斜ベンチとBIOPACシステムへフック。
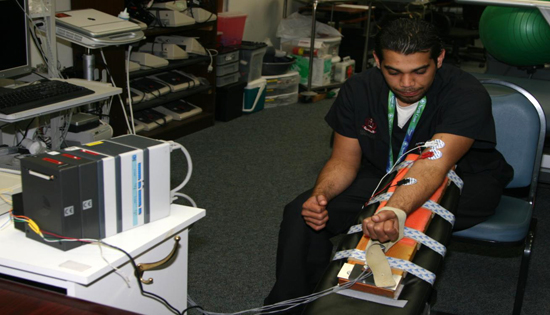
図11。ひずみゲージのデバイス上で力を発揮する典型的な主題。
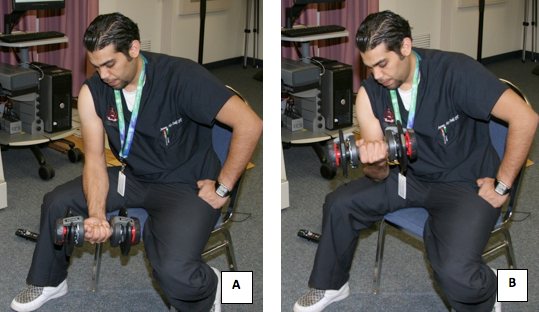
図12。筋肉痛を誘発するための運動のプロトコルを受けている対象。
ディスカッション
この調査の主な目的は、激しい運動後の筋肉痛を検出および測定に熱赤外イメージングの有用性を評価することであった、そして我々の結果は、IRイメージングでは、特に運動の最初の24時間以内に、検出DOMSのための有効な手法であることが示唆された。 Pennes 18は手足の筋肉から皮膚への熱の流れの非常に詳細なモデルを提供するので、これは、驚くべきことではない。このモデル?...
開示事項
利害の競合が宣言されない。
謝辞
我々は、この作品でのサポートにファイザー製薬から契約(WS1763368)を認識したい。我々はまた彼らのサポートのために高等教育のサウジアラビア省(モーホー)に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| デバイスの名前 | 会社 | カタログ番号 | コメント |
| 赤外線サーマルカメラ | FLIR | FLIR SC660 | |
| 熱赤外線解析ソフトウェア | ThermoVision ExaminIR | ソフトウェアバージョン1.10.2 | |
| 生体アンプモジュール | BIOPAC | DA100C | DA100Cは、可変ゲインの設定、および調整可能な電圧リファレンスを提供します。 |
| デジタルコンバータモジュールへのアナログ | BIOPAC | MP100 | |
| 自動化された酵素イムノアッセイアナライザー | 東ソー | AIA -360 | この装置は、血液サンプルを分析し、ミオグロビンの測定値を得るために使用された。 |
参考文献
- Cheung, K., Hume, P. A., Maxwell, L. Delayed Onset Muscle Soreness: Treatment strategies and Performance Factors. Sports. Med. 33, 145-164 (2003).
- MacIntyre, D. L., Reid, W. D., McKenzie, D. C. Delayed Muscle Soreness: The Inflammatory Response to Muscle Injury and its Clinical Implications. Sports. Med. 20, 24-40 (1995).
- Armstrong, R. B. Mechanisms of exercise-induced delayed onset muscular soreness: a brief review. Medicine and Science in Sports and Exercise. 16, 529-538 (1984).
- Howatson, G., Someren, K. A. V. The Prevention and Treatment of Exercise-Induced Muscle Damage. Sports. Med. 38, 483-503 (2008).
- Petrofsky, J. Comparison of Different Heat Modalities for Treating Delayed-Onset Muscle Soreness in People with Diabetes. Diabetes Technology & Therapeutics. 13, 645-655 (2011).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement Tools Used in the Study of Eccentric Contraction-Induced Injury. Sports. Med. 27, 43-59 (1999).
- Hilbert, J. E., Sforzo, G. A., Swensen, T. The Effects of Massage on Delayed Onset Muscle Soreness. Br. J. Sports. Med. 37, 72-75 (2003).
- Symons, T. B., Clasey, J. L., Gater, D. R., Yates, J. W. Effects of Deap Heat as a Preventative Mechanism on Delayed Onset Muscle Soreness. Journal of Strength and Conditioning Research. 18, 155-161 (2004).
- Vaile, J. M., Gill, N. D., Blazevich, A. J. The Effect of Contrast Water Therapy on Symptoms of Delayed Onset Muscle Soreness. Journal of Strength and Conditioning Research. 21, 697-702 (2007).
- Stone, M. B., Merrick, M. A., Ingersoll, C. D., Edwards, J. E. Preliminary Comparison of Bromelain and Ibuprofen for Delayed Onset Muscle Soreness Management. Clinical Journal of Sports Medicine. 12, 373-378 (2002).
- Barlas, P. Managing Delayed-Onset Muscle Soreness: Lack of Effect of Selected Oral Systemic Analgesics. Arch. Phys. Med. Rehabil. 81, 966-972 (2000).
- Jackman, S. R., Witard, O. C., Jeukendrup, A. E., Tipton, K. D. Branched-Chain Amino Acid Ingestion Can Ameliorate Soreness from Eccentric Exercise. Medicine & Science in Sports & Exercise. 42, 962-970 (2010).
- Law, F. r. e. y., A, L. Massage Reduces Pain Perception and Hyperalgesia in Experimental Muscle Pain: A Randomized, Controlled Trial. The Journal of Pain. 9, 714-721 (2008).
- Vaile, J., Halson, S., Gill, N., Dawson, B. Effect of hydrotherapy on the signs and symptoms of delayed onset muscle soreness. European Journal of Applied Physiology. 102, 447-455 (2007).
- Vinck, E., Cagnie, B., Coorevits, P., Vanderstraeten, G., Cambier, D. Pain reduction by infrared light-emitting diode irradiation: a pilot study on experimentally induced delayed-onset muscle soreness in humans. Lasers in Medical Science. 21, 11-18 (2006).
- Clarkson, P. M., Ebbeling, C. Investigation of Serum Creatine Kinase Variability after Muscle-Damaging Exercise. Clin. Sci. 75, 257-261 (1988).
- Jiang, L. J. A perspective on medical infrared imaging. Journal of Medical Engineering & Technology. 29, 257-267 (2005).
- Pennes, H. H. Analysis of Tissue and Arterial Blood Temperatures in the Resting Human Forearm. J. Appl. Physiol. 1, 93-122 (1948).
- Ivanitsky, G. R., Khizhnyak, E. P., Deev, A. A., Khizhnyak, L. N. Thermal imaging in medicine: A comparative study of infrared systems operating in wavelength ranges of 3–5 and 8-12 μm as applied to diagnosis. Doklady Biochemistry and Biophysics. 407, 59-63 (2006).
- Herman, C., Cetingul, M. P. Quantitative Visualization and Detection of Skin Cancer Using Dynamic Thermal Imaging. J. Vis. Exp. (51), e2679-e2679 (2011).
- Wang, J. Evaluation of the diagnostic performance of infrared imaging of the breast: a preliminary study. BioMedical Engineering OnLine. 9, 3-3 (2010).
- Murray, A. K. Noninvasive imaging techniques in the assessment of scleroderma spectrum disorders. Arthritis & Rheumatism. 61, 1103-1111 (2009).
- Zaproudina, N., Ming, Z., Hanninen, O. O. P. Plantar Infrared Thermography Measurements and Low Back Pain Intensity. Journal of Manipulative and Physiological Therapeutics. 29, 219-223 (2006).
- Kim, Y. -. C., Bahk, J. -. H., Lee, S. -. C., Lee, Y. -. W. Infrared Thermographic Imaging in the Assessment of Successful Block on Lumbar Sympathetic Ganglion. Yonsei Medical Journal. 44, 119-124 (2003).
- Brancaccio, P., Lippi, G., Maffulli, N. Biochemical markers of muscular damage. Clinical Chemistry and Laboratory Medicine. 48, 757-767 (2010).
- Neubauer, O., König, D., Wagner, K. -. H. Recovery after an Ironman triathlon: sustained inflammatory responses and muscular stress. European Journal of Applied Physiology. 104, 417-426 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved