このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
三次元マトリックスの蛍光タグ付きタンパク質を発現する遊走細胞の生細胞イメージング
要約
このような細胞遊走などの細胞プロセスは伝統的に二次元、硬いプラスチックの表面に研究されている。このレポートは、直接タンパク質の局在を可視化し、より生理学的に関連する、三次元マトリックスに移行する細胞で蛋白質のダイナミクスを分析するためのテクニックを説明します。
要約
伝統的に、細胞の遊走は、二次元、硬いプラスチックの表面に研究されている。しかし、このような創傷治癒、組織再生、および癌の転移などの重要な生物学的プロセスの間に、細胞は複雑な、三次元細胞組織をナビゲートする必要があります。よりよいこれらの生物学的プロセスの背後にあるメカニズムを理解するには、細胞移動を駆動するための責任蛋白質の役割を調べることが重要です。ここで、我々は、上皮細胞株を(MDCK)を使用して細胞移動のメカニズムを研究するためのプロトコルの概要を説明し、モデルシステムとして、三次元、繊維、自己重合行列。この光学的に透明な細胞外マトリックスは、生細胞イメージング研究に容易に適していると良いの生理的、軟組織の環境を模倣しています。このレポートは、直接タンパク質の局在や動態を可視化するためのテクニック、そして周囲の三次元マトリックスの変形を示しています。
試験細胞プロセス中のタンパク質の局在とダイナミクスの追うものは、タンパク質の機能に重要な洞察を提供します。遺伝的に符号化された蛍光標識は、タンパク質の局在や動態を観察するためのユニークな方法を提供する。このテクニックを使用して、我々は、マトリックスを介して細胞の操縦に、リアルタイムで細胞骨格成分の力が、生成、鍵の細胞内蓄積を分析することができます。さらに、波長の異なる複数の蛍光タグを用いて、我々はこのように私たちは別のタンパク質が類似または発散の役割を持っているかどうか、例えば、テストすることが、同時に複数のタンパク質の局在を調べることができます。さらに、蛍光標識タンパク質のダイナミクスは(FRAP)解析を光退色後蛍光回復を使用して定量することができる。この測定アッセイ蛋白質の機動性とどのように安定的に結合したタンパク質は細胞骨格ネットワークになる。
タンパク質機能阻害剤の治療でライブセルイメージングを組み合わせることで、我々は、タンパク質と移行する細胞の形態の分布のリアルタイムの変化で調べることができます。さらに、我々はまた、細胞移動中に行列の変形を可視化するマトリックス内に埋め込まれた蛍光トレーサー粒子の使用による生きた細胞のイメージングを組み合わせる。従って、我々は移行細胞が力を生み出すタンパク質の配布方法可視化することができます、そしてどこに牽引力が周囲のマトリックスに発揮されています。これらの技術を通じ、我々は、特定のタンパク質と細胞移動のメカニズムへの貢献の役割に貴重な洞察を得ることができます。
プロトコル
1。安定細胞株の生成(例:MDCK細胞)
- p35の皿でコンフルエント80から90パーセントで、細胞をプレート。細胞はトランスフェクション効率を減少させるが100%コンフルエントな単層を形成させてはいけません。
- リポフェクトアミン2000を用いて目的のプラスミドで細胞をトランスフェクション。製造業者のプロトコルを使用してトランスフェクション条件を最適化する。
- 次の日、二つのP150ペトリ皿に継代細胞。大皿は、安定したコロニーの間に十分な間隔を許可することをお勧めします。
- 翌日、メディアを変更し、各ディッシュにG418 500μg/ mlを加える。 G418の濃度は、個々の細胞株に対して最適化する必要があります。
- 約2週間、一日おきにメディアを変更します。 2週間後、G418耐性コロニーが形成され始めてください、そして肉眼で見えるようになります。
- 倒立蛍光顕微鏡を用いて、GFP陽性コロニーを識別する。シャーピーペンを使ってプレート上にこれらのコロニーをマーク。
- sへ待機的、組織培養プレートからコロニーをトリプシンメディアを吸引除去し、PBSまたはトリプシン溶液で2回細胞を洗浄。回目の洗浄では、すべてのソリューションを吸引しないでください。乾燥から細胞を防ぐためにプレートの底に液体の薄層を残す。
- 各マークコロニーのために:植民地の縁の周りにできるだけ近づけて拭くために滅菌綿棒を使用してください。これは、細胞コロニーを含むウェットエリアの島を作成します。コロニー上にトリプシンのピペットを10μl。すべてのコロニーのために繰り返して、乾燥を避けるために迅速に進んでください。経験豊かな研究者は通常、P150プレートあたり〜12コロニーを選択することができます。
- 37プレートをインキュベート℃で5〜10分間、細胞がプレートから切り離し、ラウンド表示されるまで。
- 各コロニーのための:ピペット10コロニー上にトリプシンの添加、そしてプレートから細胞を分離するために数回上下にピペッティング。その後、24ウェルディッシュ内の単一ウェルにコロニーからすべてのセルをピペット。
- 安定したコロニーが成長した後、各コロニーのタンパク質発現は、標準的なウェスタンブロットおよび免疫蛍光法を用いて分析される。さらに分析するためにこれらの細胞株を展開します。
2。最適なコラーゲンの結合(オプション)用ガラスボトムディッシュの表面改質
- ガラスをsilanizeに、10mmの開口部がそれぞれp35の皿のガラス部分の上に2%3 - アミノプロピルトリメトキシシラン溶液をピペットを300μl。シラン化および架橋回路図については図1を参照してください。 3 - アミノプロピルトリメトキシシランは、ろ過された水で希釈される。
- 室温で1時間インキュベートする。
- 3 - アミノプロピルトリメトキシシランソリューションを吸引し、10分ごとにフィルタ処理された水で3回洗浄する。
- ℃で1.5時間の場合は50に設定したホットプレート上で水と場所料理を吸引除去する。皿にその水分が逃げることができるので、少し皿から料理の場所がトップ。
- 熱から皿を取り外し、COOすることができますL.
- ピペット各皿のガラス部分に2%グルタルアルデヒド溶液を300μl。グルタルアルデヒドは、PBSで希釈される。
- 1時間インキュベートする。
- グルタルアルデヒド溶液を吸引し、10分ごとに、PBSで3回皿を洗う。
- 1時間UV光への曝露によって料理を滅菌する。シラン化皿は室温で保存することができます。
3。トレーサー粒子を3次元コラーゲンゲルの調製
- 、5分間15,000 rpmで遠心分離器で株式トレーサー粒子(10 10粒子/ ml)100μlをスピンダウンして蛍光トレーサー粒子を洗浄する液体を吸引し、そしてメディアの500μlを加える。 5回を繰り返します。最後の洗浄の後、メディア30μlに粒子を懸濁します。
- いつものようにGFP発現細胞をトリプシン処理。
- 約2 × 10 6細胞/ mlに再懸濁し、細胞ペレット。
- ピペットエッペンドルフチューブに増殖培地240μlを。
- 1M Hepesを、ろ過水を20μl、細胞溶液の50μlを、その後、蛍光粒子を10μlの12.6μlを添加する。
- 最後に、ウシ真皮のコラーゲンI溶液(1 mg / mlのワーキング濃度を得るために)167μlを加える。
- 徹底的に溶液を混合して、シラン化ガラスボトムディッシュのガラス部分に溶液80μlをピペットで。
- 場所のインキュベーターに料理とゲルが37℃重合することができます℃で30分間。 P35ガラスボトムディッシュでの典型的なコラーゲンゲルについては、図1Aを参照してください。
- 各ディッシュに慎重に増殖培地2 mlを加え。
4。タイムラプス画像取得のための手順
- 顕微鏡のエンクロージャの温度制御をオンにし、37℃にスコープ室が定常状態の温度に平衡させライブセルイメージングシステムの例については、図2を参照してください。
- 中性のpHを維持するために、25mMのHEPESを補った新しいメディアにメディアを変更します。のDICイメージングは、ガラストップを持っているものと皿の上部を交換する。パラフィルムの薄いストリップを使用して、メディアの蒸発を防ぐために、皿の側面をカバーしています。
- 油浸対物レンズの場合は、客観的に液浸液の一滴を置きます。
- 顕微鏡のステージ上に皿を含むコラーゲンゲルを置き、そして料理が液浸液と接触することを確認してください。
- サンプルと画像への関心のセルを検索してフォーカス。ステージのドリフトを最小限に抑えるために、皿が長いキャプチャを開始する前に、約45分間静することができます。
- 画像取り込みのパラメータを指定します。変調レーザパワー、露光時間、周波数およびキャプチャ時間の持続時間によって、細胞を損傷する恐れがあるレーザー露光を、最小限に抑えることができます。実パラメータは、顕微鏡システムや細胞の種類によって異なります。
- タイムラプス収集中に、阻害剤を添加することができる。阻害剤の添加実験では、パラフィルムで皿をシールしないでください。
- 準備ヘペスが望ましい稼動濃度で薬剤を使用してメディアを補完しています。
- 、ときにメディアへの薬剤を追加する準備がイメージキャプチャを一時停止し、慎重に料理を乱すことなく、皿の上部を取り外します。
- 皿の中でメディアを吸引除去し、シャーレに培地を含有する薬剤をピペット。その後、皿の上を慎重に置き換えます。
- サンプルは、新しいメディアの添加によるアウトフォーカス可能性がある、ピントを合わせ直す。
- キャプチャを再開し、次の30分間キャプチャを監視し、必要に応じてピントを合わせ直す。薬物添加の実験の例については、図4を参照してください。
5。 FRAPの手順と分析
- FRAPのセットアップは、システム間で異なるため、メーカーの指示に従ってください。
- 生細胞イメージングのためのパラメータを設定します。
- 退色のパラメータを設定します。細胞にダメージを与えることなく、蛍光信号を光退色するのに十分なレーザーパワーを使用してください。これらのパーをテスト練習の細胞でameters。
- イメージキャプチャを起動し、関心領域を退色する前に画像キャプチャの少なくとも5つのフレームを許可する。
- キャプチャを続行し、回復時間は完全に蛍光回復をキャプチャするために十分なはずです。 FRAP実験の例については、図5を参照してください。
- photobleachedエリアの平均蛍光強度(前と光退色後の)時間の経過を測定することにより蛍光回復を分析する。統計解析ソフト(Excelなど)を使用して、指数方程式に回復曲線をフィット:I = I F(1 - E - KT)、私は私fが最終的な強さである、強さ、tは時間であり、τ ½は半分の最終値に達するまでの強度のために要する時間です。τ½ = LN(2)/ kとハーフタイムには、タンパク質の移動度の速度の尺度になります。
- パラメータは、ハーフタイムや指数関数フィット曲線から最終的な強度を得る。目を計算する初期蛍光強度への最終の比をとることによって、電子の移動割合。
6。代表的な結果
マトリックス内の健康な上皮細胞の生細胞イメージングの例を図3に示されています。不健康な細胞は、しばしば中断膜、及び液胞の過剰な数を持っているのに対し、健康な細胞は、滑らかで、連続的な膜、および明確な核を示す。 3Dマトリックスでは、単一の上皮細胞は、1を移行し、数日間にわたって、上皮細胞は、マトリックス2内に三次元、球形、多細胞嚢胞を形成する。細胞はまた、非常に動的であり、嚢胞(図3)内に移行します。遊走細胞によって及ぼされるトラクション力の結果として行列の変形は、周囲のマトリックス(図4)に埋め込まれたトレーサー粒子の変位によって分析されます。トレーサー粒子の動きが異なるの最大投影像として表示されます。ENTの時点、およびそれぞれの時間の時点(図4B)を示すために擬似色です。また、個々のトレーサ粒子の画像は、時間の経過にトレーサー粒子(図4C)の動きを示すモンタージュとして表示されます。すべての画像解析は、ImageJを使用して行われました。行列の変形のこのような定性的な評価、およびそのための移行細胞によって加えられる力は、牽引力の分布の有用な第一次近似です。 3Dに移行する細胞によって加えられる牽引力の定量的な推定は、このプロトコルの範囲を超えていますし、他の場所で3,4記述されています。
実験を光退色後の典型的な蛍光の回復を図5に示されています。関心領域は、健康で無傷の細胞を維持しながら蛍光強度が目に見えて、バックグラウンドレベル(信号対雑音比を最大にする)に比べて減少するように最適化されたレーザーの設定を使用してphotobleachedする必要があります。最適な設定はb必要があります各FRAPの設定が異なると、電子は経験的に決定する(例えば、FRAP使用してレーザーを走査型共焦点システム)。
ポストFRAPの画像取得の曝露との時間間隔は、慎重にバックグラウンドの光退色を避けるために制御する必要があります。低レーザパワー、短い露光時間、および高感度カメラの使用と高効率光学系の使用は、高品質のFRAPイメージングのために不可欠です。画像取得中に漂白蛍光が大きい場合、このような背景の退色が観察された蛍光強度の回復から定量化し、正規化する必要があります。環境の三次元性のために、蛍光強度の回復のz成分は重要になることがあります。したがって、photobleached地域の事前および事後の3D -スタック像をとることによってphotobleachedボリュームを定義することが重要です。蛍光回復のさらなる分析とモデリングは他の場所で5,6説明しています。
ライブセルイメージングtのユニークな組み合わせechniques:GFP行列の変形、及び阻害剤の添加を監視するために細胞骨格タンパク質、赤色蛍光トレーサー粒子のダイナミクスに従うことは、蛋白質のダイナミクス、牽引力と分子経路の解析のために同時に使用することができます。
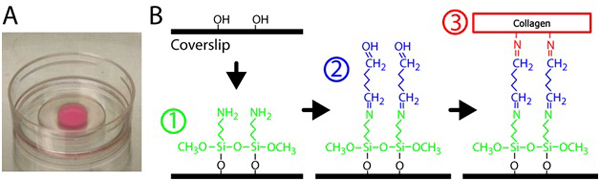
図1コラーゲンゲルの調製。ガラスボトムディッシュ上A)重合コラーゲンマトリックス。ゲルのピンクの色は、埋め込まれた蛍光粒子によるものです。 B)ガラスの表面にコラーゲンゲルを架橋するガラスボトムディッシュを治療するための手順。最初に、ガラスボトムディッシュは、3 - アミノプロピルトリメトキシシランソリューション、ガラスにコラーゲンマトリックスを架橋してグルタルアルデヒド溶液で処理される。
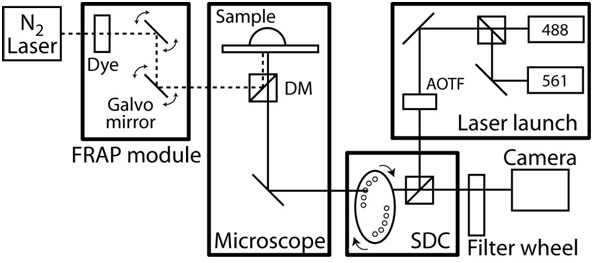
図2。FRAP /共焦点顕微鏡のセットアップの概略図。共焦点顕微鏡はCoolSnap HQ II CCDカメラとツァイスAxioObserverに基づいており、完全にSlidebookソフトウェア(インテリジェントイメージングイノベーション)によって自動化されています。共焦点ユニットは2つのレーザーの切り替えミリ秒を許可するように設計し、横河、回転するディスクユニットCSU10と音響光学的可変フィルター(AOTF)の2つの固体レーザー(50 mWと40 mWのと561 nmの持つ488 nmの)に基づいてカスタムです。エミッションフィルターは、50分の525 nmと60分の620 nmの(#118661と#118085、クロマテクノロジー)であり、ダイクロイックミラーは、488から568 BrightLineデュアルバンド(Semrock)です。目的はNA 1.1と0.62ミリメートル、およびNA 1.4と0.19ミリメートルの作動距離を持つ63xプラン-アポクロマート対物の作動距離との組み合わせで最大40倍C -アポクロマート対物長い作動距離です。顕微鏡は、ファイバ光学色素レーザー、コンピューター制御されたビーム位置と強度、および回折限界スポットサイズを励起で構成されてFRAPのphotoablationシステムが含まれています。さらに、顕微鏡が装備されています各軸上0.1ミクロンのリニアエンコーダを含むXY自動ステージ。タイムラプスイメージングの間に、環境温度は、カスタム設計された顕微鏡室とフィードバック温度制御によるヒーターによって維持されます。あらゆる騒音と振動を分離するには、全体の顕微鏡システムは、振動のないテーブルの上です。
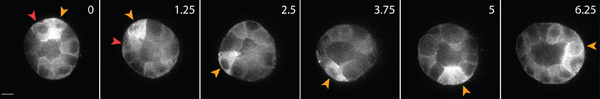
図3:GFP -アクチンを発現している上皮細胞の細胞イメージングライブ。これらの細胞は三次元コラーゲンマトリックスで培養4日後に嚢胞を形成した。他の人が嚢胞の内部(赤矢印)内に移行する間、一部の細胞は、嚢胞(黄色の矢印)の表面に沿って移動する。スケールバーは10μm、時間単位。
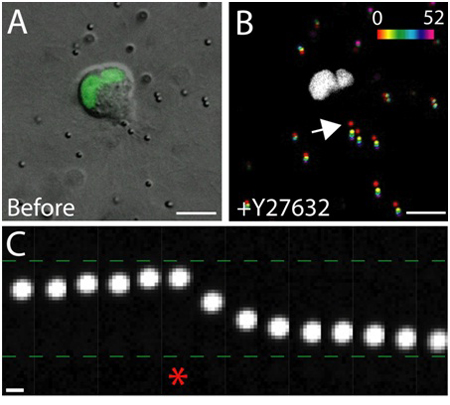
図4。牽引力でRho -キナーゼの効果が阻害。 Gを発現して移行するMDCK細胞のA)DIC画像FPは、核マーカーが付けられている。画像は、Rho -キナーゼ阻害薬Y - 27632の治療の直前に撮影された。スケールバーは10μm。 B)Y - 27632の追加による粒子変位を。様々な時点で(0 - 52分)でのパーティクルの位置は、単一の画像上に投影さ、強度の規模に応じて疑似色でした。白い領域は、移行細胞におけるGFP陽性核です。スケールバーは10μm。分単位の時間。 C)のセルの後縁にある粒子の動きは(Bの矢印を参照)。アスタリスクは、Y - 27632を添加する前にキャプチャされた最後のフレームを表します。トレーサー粒子はそれぞれ、Y - 27632の添加前と後に向かって離れての移行細胞の後縁からの移動。スケールバーは1μm。
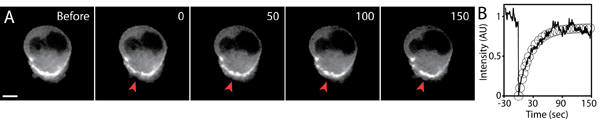
図5三次元マトリックスに細胞の移行を表現するGFP -アクチンのFRAP解析。のA)タイムラプス画像GFP -アクチンは、退色の前後のセルを表現。セルの背面に蓄積されたGFP -アクチンの小さな領域では、タイムポイントは0から(赤矢印)photobleachedいました。秒単位の時間、スケールバーは5μm。 B)photobleached領域(実線)、および蛍光回復(円)の指数関数フィットの平均蛍光強度は時間の経過とともにプロット。蛍光強度は退色する前の初期値に正規化された。
ディスカッション
ここでは、三次元マトリックスに細胞移動のメカニズムを研究するために生きた細胞のイメージングを使用するための方法を説明します。この手法の成功は、安定的にGFPタグ融合タンパク質を発現している"良い"のクローンを得ることに依存する。 GFPタンパク質の低レベルが高すぎるGFPのレベルは、セル上で望ましくない副作用を持っているが、細胞の健康を損なう過剰な励起の露出...
開示事項
利害の衝突は宣言されません。
謝辞
私たちは、原稿の重要な読書のためにグラント博士隅田川に感謝。この作品は、ベックマン若手研究者賞(SY)、ヘルマンファミリー新学部賞(SY)、NIH EUREKA、カリフォルニア州がん研究調整委員会の大学によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| コラーゲンは、ウシ、タイプI | BDバイオサイエンス | 354231 | 株価は3 mg / mlの約 |
| 3 - アミノプロピルトリメトキシシラン | シグマアルドリッチ | 281778 | 水で薄める |
| グルタルアルデヒド | シグマアルドリッチ | 340855 | PBSで希釈し |
| 1M Hepes緩衝 | インビトロジェン | 15630-080 | |
| Fluospheresのポリスチレン微小球を1μm、赤色蛍光(605分の580) | インビトロジェン | F13083 | |
| ジェネティシン(G418) | インビトロジェン | 11811-031 | |
| 文化メディアコンポーネント: | |||
| DMEM | インビトロジェン | 31600-034 | |
| ウシ胎仔血清 | アトランタバイオ | S115500 | |
| ペニシリン/ストレプトマイシン | インビトロジェン | 15140-122 | |
| カナマイシン | インビトロジェン | 15160-054 | |
参考文献
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved