このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
用いて、化合物の生理活性をスクリーニングするためのペアNanoinjectionと電気生理学的アッセイキイロショウジョウバエジャイアントファイバシステム
要約
急速な検定の巨大ファイバシステム(GFS)を使用して、神経調節化合物をテストするためのキイロショウジョウバエ記載されています。 GFSの電気生理学的記録と一緒に動物の頭の中でNanoinjectionsは、ニューロンや筋肉に対する化合物の生物活性を明らかにすることができます。
要約
in vivo活性のスクリーニング化合物は薬理学的作用物質1,2に開発することができる候補者を識別するための最初のステップとして使用することができます。我々は、仲介キイロショウジョウバエ 3,4のエスケープ応答を神経回路の機能に対する化合物の生理活性調節作用の検出を可能にする新たなnanoinjection /電気アッセイを開発しました。私たちの(GFS、 図1)ショウジョウバエの巨大な光ファイバシステムを使用してin vivoでのアッセイでは、このような小分子またはペプチドなどの化合物、さまざまな種類のスクリーニングを可能にし、最小限の量が効果を引き出すために必要になります。さらに、ショウジョウバエGFSは、ニューロンや筋肉の潜在的な標的分子の多種多様を提供しています。ジャイアント繊維(GFS)周辺Synapsing介在ニューロン(PSI)とTergo Trochanteral筋ニューロン(TTMn 5)上に化学的に電気シナプス(ギャップジャンクション)と同様に(コリン) (nAChRs)6に依存しています。最後に、ジャンプ(TTM)と飛翔筋(DLM)のTTMnとDLMnの神経筋接合部(NMJ)は7月12日グルタミン酸作動性である。ここでは、巨大な光ファイバシステム13とどのようにこの回路の機能に対する化合物の影響を監視するための電気生理学的な細胞内記録を得ながら、化合物のナノリットル量を注入する方法を示しています。我々は、接続をDLMnするPSIはなく、接続やジャンプや飛翔筋におけるNMJの機能をTTMnするGFを乱すmethyllycaconitineクエン酸(MLA)、のnAChR拮抗薬とのアッセイの特異性を示しています。
このビデオを開始する前に、それはあなたが注意深く見るとD.メランの巨大ファイバ経路からの"電気生理学的記録と題しJoveの映像に慣れていることが重要ですオーギュら 7からogaster "、ビデオはここで提示されるように、この既存の技術の拡張として意図されています。ここでは、唯一のペアnanoinjectionsとモニタリング技術のほかに詳細に電気生理学的記録法とフォーカスを使用しています。
プロトコル
1。電気生理学リグのセットアップ
- 電気生理学リグセットアップに必要な機器は、オーギュらによって詳細に記載されている。このジャーナル14インチ必要に応じて電気機器の詳細な説明については、この資料を参照してください。
- ナノインジェクタを保持する第六マイクロマニピュレータを追加することによって、前述した電気生理学リグのセット、最大14に変更します 。 図2に示すように、動物の頭に簡単にアクセスできるようにそれは2つの刺激電極のマニピュレーターとの間に配置する必要があります。
- 実験を開始する前に、すべてのマニピュレーターを持つ全ての回転軸上の快適な範囲を持っていることを確認し、全ての電極と同様にインジェクションピペット(ステップ2を参照)動物に達することができる。
2。 Nanoinjectionセットアップ
- nanoinjectionセットアップがNanoliter2000(世界Precisiが必要です。楽器、サラソタ、フロリダ州、米国)またはナノリットル量で制御された注射することができますインジェクタの類似したタイプ。
- 電極プラーで80から100MΩの抵抗にそれらを引いて、インジェクター付属のガラスマイクロピペットを用いて注射針を準備します。
- 滑らかな注射のためには、45度の角度( 図3)で11から17μmの開口部にベベルにマイクロピペットを必要とされています。
- ゆっくりに気泡が存在しないことを確認し、Nanoliter2000マニュアルの指示に従ってハミルトンシリンジを用いて合成油を注入ピペットのバックフィル。
- 慎重にナノインジェクタ上のマイクロピペットを確保し、Nanoliter2000マニュアルで指示された余分な油を空にして化合物をロードするための準備をします。
- マニピュレータにインジェクターを配置し、Nanoliter2000マニュアルで指示された化合物をロードします。マイクロピペットの先端がこの中に壊れないことを確認してください手順。
- Nanoliter2000マニュアルによって指示されるようにインジェクタのコントロールボックス内に注入されるナノリットルの所望量を設定します。注入された合計金額が100 NLを超えてはならないことに注意してください。我々は生理食塩水コントロールソリューションの大きな数量がGFS回路の機能に影響を与える可能性があることがわかった。
- ナノインジェクタの電源はバックグラウンドノイズ( 図4)として表示され録音、妨げので、それは、インジェクタが注入自体の例外を除いて記録取得時にコントロールボックスから外れていることが重要です。それを再設定しますしかし、コントロールボックスの電源を切断しないでください。
(3) キイロショウジョウバエの準備
- CO 2、または前述の14,15として氷上に2から6日齢のハエを麻酔。
- かつて不動の、小さなプレートwiに動物を転送するためにピンセットを使用その足からそれを拾うことによって目の柔らかい歯のワックス。男性のミバエは、約1.0 mgの重さと女性のミバエは、1.2 mgの重さは約、したがって、化合物対体重比は男性対女性のハエで異なっていることに注意してください。したがって、それは実験のためにのみ性別を使用することをお勧めします。
- 以前は14,15に記述されているように 、慎重にフライ背側をマウントし、胸部と頭部が体の周囲に配置ソフトデンタルワックスで固定していることを確認します。注意深く彼らは胸部( 図2、C)に対して垂直に置くように翼を広げて。フライは、できるだけ少ないダメージなどでマウントする必要があります。
4。ペアNanoinjection /電気生理学
- 刺激電極に向かって、その頭を電気生理学的リグに取り付けられたフライを置きます。
- 前述した14,15(Fとして対応する刺激、地面と記録電極と動物を突き立てるigure 2、C)。そうでなければ望まない限り、DLMとTTM筋肉に他に1記録電極を配置します。 DLM筋前部背中央毛、ハエの正中線との間の胸部に位置しています。 TTM筋肉はフライ7の後部と前部のスープラ·エイラーの毛の間に翼の添付ファイル、近くに位置しています。
- 頭部の内側後部に位置するが( 図2、C)はまだ注入しないでください3単眼の中心を有する化合物を含有する注射剤のマイクロピペットを合わせます。
- 化合物の注入は、脳の刺激を介して巨大な光ファイバシステム(GFS、 図1)の経路をDLMにTTMとGFにGFのベースラインの記録を入手してください。前これを行うには、10の刺激の10列車(40〜50 mV)で電車14,15( 図4)の間に1秒の遅延が100 Hzで0.03ミリ秒の持続時間のために与えられたそれぞれの持つ巨大な繊維(GFS)アクティブにします。野生型では、shを飛ぶウルドは、DLMとTTM経路の両方の刺激のこのレートで一対一に従うことができる。 TTM経路にDLMとGFにGFが1:1比で100 Hzの刺激に従わない場合、フライを破棄します。
- 1 Hzの( 図4)での単一パルスでGFの連続的な刺激に切り替えます。
- 迅速にコントロールボックスにインジェクタを差し込みます。バックグラウンドノイズが1 Hzの刺激の録音を妨害するにもかかわらず、それを中止しないでください。
- 慎重にだけcuticule以下ハエの頭部カプセルに注入ピペットを挿入し、1 Hzの刺激( 図4)を維持しながら、フライの体液中に化合物の所望の量を注入します。フライのオープン循環系のために、全体の神経系は、数秒以内に化合物にさらされる。特定の注射部位は、体液中に化合物を提供することが重要ではありませんが、我々は、ローカライズされている単眼の領域を見つける頭部カプセルの中で最も背側で内側のdは、化合物の迅速かつ均一な分布につながる簡単な注入を可能にする便利なサイトになる。
- 注射後1分( 図4)に1 HzのGFの刺激を続けながら、すぐに注射部位から注入ピペットを削除し、コントロールボックスからインジェクターを外してください。
- GFSに対する化合物のより微妙な効果を明らかにするために、列車の間に1秒の遅延では100 Hzで10刺激の10列車と巨大繊維(GFS)を強調する。最大15分( 図4)にこのパラダイム5分ごとにGF経路の機能をテストし続けています。しかし、短い間隔またはより長い監視期間も可能です。
- 化合物は、GFSの神経筋接合部(NMJs)で効果があり、おそらく化合物の影響を絞るかどうかをテストするためには、運動ニューロンを活性化する方向に進んでくださいTLY胸部刺激による。このためには、目から刺激電極を除去し、100 Hzで10刺激の10列車と運動ニューロンを刺激するために胸部の前方側にそれらを交換してください。
注:ビデオに示すように、電気トレースは、純粋な色素注入の効果に対応していません。
5。代表的な結果
ジャイアント·ファイバーシステムのシナプスをDLMにPSIに拮抗薬の効果
Methyllycaconitineクエン酸(MLA)はα7nAChRのサブタイプに特異的であるのnAChR拮抗薬である。 Dα7のnAChRサブタイプの遺伝子の除去はGF-TTM経路5,6に影響を与えませんしながらGF-DLM経路でシナプスをDLMnするPSIは、適切に機能するためのDα7のnAChRサブタイプに依存しています。我々のアッセイの特異性と感度を実証するために我々は、異なる濃度(0、0.02、0.04、0でMLAを注入した。生理食塩水治療のためにはn = 15)08、0.12 ngの/ mgで、46 nlは、動物の頭部(N = 10の化合物の治療ごとに)注入した。男性のみハエは(10E野生野生型の遺伝子型)を用いた、化合物の効果は注射後15分の合計をモニターした。
図5は、ベースラインの注入前に取得したレコーディングやMLAと生理食塩水制御ソリューションに対応して注入した後得られたものの違いを示しています。我々は、MLAのその注射がGF-TTM経路が影響を受けないままであっ脳内のGFSの刺激によって100 Hzで一対一に従うGF-DLM経路の無力をもたらしました。 ( 図5、トップとミドルのトレース、データはノンパラメトリック[テスト正常と分散が等しい]でない限り、生理食塩水コントロールの[0 / NG MG]と各時点でのMLAの異なる濃度との間で行われるt-検定、そうでなければ、使用マンホイットニー順位和検定* p <0.001)であった。しかし、一対一のR運動ニューロンは、DLMとTTMのNMJ機能がMLAによって影響されないことを示している( 図5、下のトレース)を直接刺激したときにDLMのesponseが観察された。 MLAは、それ以上の有意な変化は試験期間の次の15分の間には認められなかったとして、0.04、0.08、0.12 ngの/注入MLA mgのための注射後に最大の効果を1分に到達するために登場しました。強い応答が0.12 ngの/ mgの高用量で観察されなかったので、また、化合物は、0.08 ngの/ mgで最大の効果を達成しました。
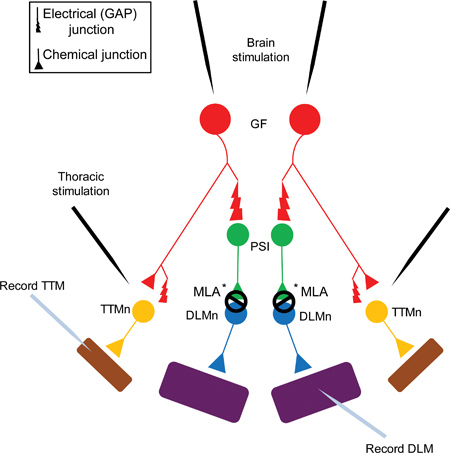
図1。ジャイアント·ファイバー·システム(GFS)の巨大ファイバシステム図。ジャイアント繊維(GFS、赤で表示)シナプスと電気的(ギャップジャンクション)と同様に化学的に(コリン)周辺Synapsing介在ニューロンへ(PSI、緑で示されている)とTergo Trochanteral筋肉ニューロン(TTMn、黄色で示されている)5。 PS私はDLMn(青で示さ背縦走筋の神経細胞)の接続にDα7のnAChRサブタイプ6に依存しています。最後にジャンプ(TTM、紫で示されている)と飛翔筋へTTMnとDLMn(DLM、紫で示されている)の神経筋接合部(NMJ)はグルタミン酸作動性である。
注:PSI接続へのGFは、電気的および化学的でもあります。しかし、shakB変異体(ギャップ結合を欠いている)で、応答は電気的な接続がない場合の化学成分は、アクションの可能性を呼び起こすのに十分でないことを実証し、脳内のGFSの刺激にDLMから記録することができませんPSI 5,16-18。 PSI接続にGFがギャップジャンクション依存しているため、この数字は単純の理由により、シナプスにおける唯一のギャップジャンクションを示しています。

図2。
マニピュレーターのらアップ。
- 以前に発行されたプロトコル14の変更されたセットアップは、同時nanoinjectionsと組み合わせるGFSの録音のための注入マイクロマニピュレータに適合するために使用されます。マウントされたハエの準備は、実験者に向かってハエの頭部を持つ指向です。注射マニピュレーター(#1)タングステン刺激電極(2#、#3)の2つのマニピュレータの間に、実験の前に置かれています。ガラスの記録電極(#4、#5)の2つのマニピュレーターは、それぞれ左側と右側に配置されます。タングステンの接地電極(#6)のマニピュレータは、左側(ここに示されている)または右側のいずれか後ろに遠くに配置されます。
- 各種電極と注入ピペットの準備の上からクローズアップビュー。
- 正しくマウントD.ショウジョウバエは、電極と注射の準備注射マイクロピペットで刺し。動物の体のことに注意してください水平に胸部を搭載し、その翼は広げられている。ワックスがしっかりと動くから動物を防ぐため、その体の周りにラップされています。さらに、接地電極(#6、腹部)、ガラスの記録電極(#4、#5、胸部で、暗いアウトラインでハイライト表示)し、刺激電極(#2と#3は、各目の1以前に14を説明したように)、代わりに突き刺されています。インジェクションピペット(#1)が正しく3単眼(円内)の中央に揃えて配置されます。インジェクションピペットの挿入は、この領域に配置する必要があります。
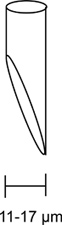
図3。ベベルインジェクションピペット。適切に面取りマイクロピペットの図がここに示されています。電極の開口部は45度の角度で面取りと11から17μmの間に開口部を持っている必要があります。適切な面取りインジェクションピペットには、最小限のdとスムーズに注入するために重要ですフライにamage。
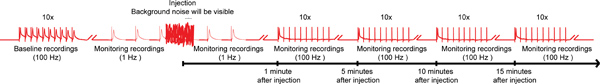
図4。 nanoinjection /電気生理学プロトコルの全体的なスキーム。nanoinjection /電気生理学プロトコルの全体的なスキームの代表的な図を示します。 10刺激ごとに(1つだけの列車がここに示されている)の10列車と100 Hzの巨大繊維(GFS)を刺激することによって、ベースラインの記録を取得することによって開始します。注射の前に、1 Hzの刺激間隔2番目のいずれかを開始します。噴射時間(インジェクタがコントロールボックスに接続されている間)中に、重要なバックグラウンドノイズを観察しますが、録音を中止していません。注射(とインジェクタがコントロールボックスから外れている)の後、約1分間以上の1 Hzの刺激を続けます。最後に、最大15分5分ごとに100 Hzで10刺激の10列車とGFSを強調し、このパラダイムでGF経路の機能をテストするために継続して進みます。注:録音ワットEREは、全体的なスキームを作成するために操作して得られた特定の結果を表すものではありません。スケールではなく、すべてのトレースが表示されません。 拡大するにはここをクリック 。
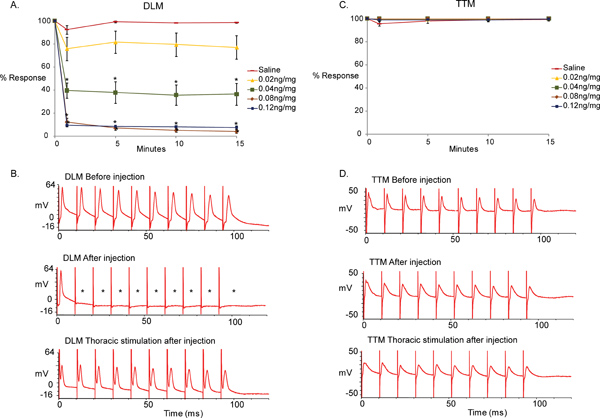
図5。 GFSにおけるMLAの効果。
- 異なる濃度でミバエ(0、0.02、0.04、0.08、0.12 ngの/ mgのGF-DLM経路上のα7nAChRの拮抗Methyllycaconitineクエン酸(MLA)の影響をグラフィカルにnの化合物の治療当たり= 10;生理食塩水治療のためにはn = 15)。注入後わずか1分、重要かつ即時の効果は、MLAの0.04 ngの/ mgで見られた。有意な効果は、GFSの100Hzの刺激で0.8ng/mgとMLAの0.12ng/mgが見られた。有意差は生理食塩水コントロールとMLAの0.02 ngの/ mgの間には認められなかった。さらに、iを変更しないnの効果は(15分)テスト期間中に1分後の注射後に認められた。 t-検定は、生理食塩水コントロール(0 / NG mg)と各時点でのMLAの異なる濃度との間で行われた。 SEM、* P <0.001 - レベルは+ /を意味するとして報告されます。
- 100 Hzの刺激でDLM応答のサンプルトレース。上のトレースは、脳内のGFの刺激によりMLA注入する前に筋肉の応答を示しています。筋肉は、各刺激は100 Hzで一対一に対応することがあることに注意してください。中央のトレースは、MLA注入(0.12 ngの/ mg)をした後にDLMの応答を表示します。筋肉は100 Hzで各刺激に1対1で対応することができないことに注意してください。 (アスタリスク)。下のトレースは、胸郭の運動神経の直接刺激を受けて、同準備(0.12 ngの/ mg)のDLMの応答を示しています。 DLMは、胸部刺激と100 Hzで1対1で応答するため、脳の刺激と応答の失敗は、コリン作動性PSI-DLMn接続に起因することができます。
- GF-TTM経路上の別のMLAの濃度(0、0.02、0.04、0.08、0.12 ngの/ mg)を備えたエフェクトをグラフィカルに描写。有意な影響は、任意の時点で生理食塩水(0 / NG mg)および化合物の注入の間に見られなかった。 t-検定は、* P <0.001、生理食塩水コントロール(0 / NG mg)と各時点でのMLAの異なる濃度との間で行われた。
- 100 Hzの刺激で、TTM応答のサンプルトレース。上のトレースは、脳内の刺激とGFの活性化時にMLA注入前の筋肉の反応を示しています。筋肉は100 Hzで、すべての刺激に応答することができることに注意してください。中央のトレースは、MLA注入(0.12 ngの/ mg)をした後DLMの応答を示しています。 TTM筋肉から脳内のGFの刺激に対する応答は、一対一のままになります。下のトレースは、胸郭の運動ニューロン(0.12 ngの/ mg)を100 Hzの刺激に同製剤のTTMの応答を示しています。
ディスカッション
ここに提示nanoinjection /電気生理学的アッセイは、ショウジョウバエの神経系の化合物の迅速なスクリーニングが可能になります。これは、よく特徴付けられた神経回路内での分子標的のさまざまな効果を引き出すために化合物の少量を必要とするin vivoでの技術の小説です。このメソッドは、未知の毒素から市販されている薬剤に応じて、異なる化合物の生物活性をテストするた...
開示事項
利害の衝突が宣言されません。
謝辞
我々はコメントを、特定のアリーン米沢では、マリラボとGodenschwegeラボのメンバーを認識し、このプロトコルを支援したいと思います。この作品は、神経疾患のための国立研究所とFMとTAGのストローク助成R21NS06637によって賄われていた。ABは、国立科学財団賞を受賞番号082925、URMによって資金を供給された:将来の研究者のための統合生物学。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 録音ガラス電極:ホウケイ酸ガラス毛細管 | 世界の精密機器 | 1B100F-4 | 1.0ミリメートルOD、0.58ミリメートルID |
| 刺激 | 草·インスツルメンツ | モデルS48 | |
| アンプ | インスツル株式会社の取得 | モデル5A | |
| データ収集ソフトウェア:Digidata | モレキュラーデバイス | モデル1440A | |
| データ収集ソフトウェア:pCLAMP | モレキュラーデバイス | バージョン10 | |
| 実体顕微鏡ワットi番目の光ファイバ顕微鏡リング照明 | AmScope | SM-4T モデルHL250-AR | |
| 取り付けの範囲を解剖 | AmScope | SM-2TZ | |
| カイトマニュアルマニピュレーター&チルトベース | 世界の精密機器 | モデル#M3301 カイト:モデル#KITE-M3-L | |
| キイロショウジョウバエの野生10Eの遺伝子型(野生型株) | ブルーミントンストックセンター | STOCK#3892 | |
| 垂直ピペットプラー | デビッド·Kopfは楽器 | 700Cモデル | |
| 注入のガラスマイクロピペット:ホウケイ酸ガラスキャピラリー | 世界の精密機器 | カタログ#4878 | 1.14ミリメートルOD、0.5ミリメートルID |
| シリコン油 | フィッシャー | カタログ#S159-500 | |
| Beveler | サッター計器(株) | KTブラウンタイプ モデル番号BV-10 | |
| Nanoliter2000 | 世界の精密機器 | カタログ#B203XVY | |
| 青い食品着色料 | マコーミック | N / A | 成分:水、プロピレングリコール、FD&Cブルー1、および0.1%プロピルパラベン(防腐剤)。 |
| Methyllycaconitineクエン酸(MLA) | バイオTocris | カタログ#1029 | |
| プラスチックワックススティック | 衛生的·コーポレーション (アクロンアメリカオハイオ州) |
参考文献
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved