Method Article
アダルトゼブラフィッシュ網膜にモルフォの in vivoエレクトロポレーションに
要約
条件付きで大人のゼブラフィッシュの網膜での標的タンパク質の発現をノックダウンする方法は、硝子体内アンチセンスモルフォを注入して網膜にそれらをelectroporating含まれ、説明されています。得られたタンパク質を再生成または無傷の網膜におけるタンパク質の役割をテストできるようになる、数日間ノックダウンされている。
要約
人間は網膜神経細胞を死にや病気の再生成することができないため、多くの壊滅的な継承された眼疾患は進行性かつ不可逆的失明につながる。対照的に、成人のゼブラフィッシュの網膜は、自発的に網膜穿刺、化学的ア ブレーション、集中高温、そして強烈な光治療1から8を含む様々な網膜損傷モデルの様々な、で失われている任意のニューロンのクラスを再生成するための堅牢な機能を有している。私たちの研究室では、広範囲に硝子体内ウアバイン注射2、5、9の後に一定の強い光の治療と内側の網膜神経細胞に続く光受容体の再生を特徴とする。すべてのケースでは、居住者ミュラーグリアの増殖とそれらが欠損ニューロンへの分化を適切網膜層、に移行し続ける神経前駆細胞を、生成するために細胞周期を再入力してください。
我々は、光玉の再生中に5さまざまな段階を特徴付け特定の細胞応答によって強調されたGED網膜。我々は、mRNAのマイクロアレイ解析10で網膜再生の各段階でいくつかの発現の異なる遺伝子を同定した。これらの遺伝子の多くは、眼の発達に重要である。網膜再生中に各候補遺伝子/タンパク質の役割をテストするために、我々は条件付きで大人の網膜の再生時にのみ回で候補タンパク質の発現を制限する方法を開発する必要がありました。
モルホリノオリゴは広くヒトの異種移植片11-14のマウス、ニワトリ、ゼブラフィッシュ、 アフリカツメガエルの開発中に特定のタンパク質の機能の喪失を研究するために使用され、腫瘍されています。これらは、いずれかのターゲットRNAのスプライシングや翻訳をブロックするように相補的なRNA配列とオリゴの塩基対を修正。モルフォは、細胞中で安定であり、排除または3〜5日12"ノックダウン"タンパク質発現することができます。
ここで、我々は、成人のゼブラフィッシュの網膜で効率的にノックダウンの標的タンパク質の発現に方法を説明します。このメソッドは、大人のゼブラフィッシュの眼の硝子体に注入されるlissamineタグ付きアンチセンスモルフォを採用しています。電極鉗子を使用して、モルフォリノは、背側と中央の網膜のすべての細胞型にエレクトロれる。 Lissamineは、エレクトロポレーション用モルホリノ上の電荷を提供し、網膜細胞におけるモルホリノの存在を評価するために可視化することができます。
網膜での条件付きノックダウンは、再生中に別々のタイミングで特定のタンパク質の役割を調べるために使用することができます。さらに、このアプローチは視覚伝達と二次ニューロンにおける視覚処理などのプロセスで、損傷のない網膜内の特定のタンパク質の役割を研究するために使用することができます。
プロトコル
1。モルホリノの準備:
- すべてモルホリノオリゴはGeneTools(学問好きの人、OR)を利用して、カスタマイズされた設計と発注する必要があります。我々は、負極に向かってエレクトロポレーションモルフォを駆動するために正に帯電lissamineタグ付きモルフォを使用。我々はこの手法を用いて正極に、負に帯電したフルオレセイン-タグ付きモルフォをターゲットに、失敗、試みた。 3mMの溶液を得たヌクレアーゼフリー水100μlのにモルフォリノの300 nmolのを希釈する。複数のパラフィン密封マイクロチューブに分注しモルホリノを。室温で光から離して保管する。
- 0.1NのHClを95μlにモルフォリノを5μl(または空白としてモルホリノを希釈するために使用される水)を希釈してモルホリノ濃度を決定する。分光光度計の波長(λ)265 nmまでを設定します。次の式を使用して、モルホリノの定数を計算します。
あなたのモルホリンに特定の定数=分子量O X 1000/molar吸光度。 - あなたは各モルホリノで提供される"オリゴのプロパティ"シートの分子量とモル吸光度データを検索します。ベースラインの測定値を確認し、各希釈モルホリノの読み取りを行うために空白を分析する。その定数とng /μlにで濃度を得るために希釈率を決定することにより、各モルホリノ265 nmの吸光度を掛けます。 mMで濃度を決定するために分子量がこの数を割る。ワーキング濃度に、必要に応じて、モルホリノを希釈します。
2。外側の角質層を削除します。
- ゼブラフィッシュのタンクの水の1.0 mg / mlの時Tricaineまたは2 - フェノキシエタノールの麻酔6〜12ヶ月の大人のゼブラフィッシュ。
- でラップゼブラフィッシュでは、エラをカバーする、しかし目は露出したまま、ペーパータオルの部分を湿らせた。眼の直径が約三分の一の一杯になるまでラップの魚は、ステレオスコープの下に配置され、倍率が上昇する視野(図1)。
- デュモン#5ピンセットを使用して、眼杯裂近傍外側の角膜をつかむ。この組織は赤色に着色されており、図1の"OC"というラベルが付いています。 "CL"というラベルの付いた矢印で示されているわずかな突起やリップがあります。外側の角膜を除去するために目で低い角度(すなわち、10度)で引っ張る。練習すれば、これは一つの動きで完了することができます。ピンセットスリップした場合、組織を再取得し、削除されるまで、再び低角度で引き抜きます。よく接続された角膜は引き下げると、目がソケットから外れされる可能性があります。あなたがピンセットの別のセットと安定さによって外れないから目を離さないことができる。
3。角膜切開およびモルホリノ注入:
- すぐに外側の角膜の除去後、瞳孔が虹彩(図2)を満たしている角膜に小さな切開を行います。これは、サファイア刃メスを(資料を参照)を使用して行われます。
- Hamiltに3.0mmのモルホリノ溶液0.5μlをロードするシリンジに33ゲージ取り外し可能な、平滑末端針(資料を参照)を装備。ライン中の気泡を除去するために上下にピペッティング。慎重に切開(図2)を介して硝子体に針を挿入する。遠く針を挿入したり、穿刺網膜の意志やレンズを変位しないでください。
- 徐々に硝子体空間にモルホリノソリューションを注入する。魚の年齢に応じて、硝子体のスペースは〜0.5μlを開催します。それはモルホリノソリューションによって変位されるように、切開から漏れ着色硝子体を可視化する必要があります。切開のモルホリノ液漏れが少量になるまで注入する。あなたは明らかに目の内側lissamineタグ付きモルホリノを視覚化する必要があります。
- 注射後、回復するために水槽に魚を戻す。我々は通常のみuninjectedコントロールとして右目を使用して、左眼を注入するが、両眼のエレクトロポレーションが可能です。
4。エレクトロポレーション:
- 以下約10魚の注入は、単にエラをカバーする、しかし目は露出したまま、注入された魚を再び麻酔し、ペーパータオルの湿らせた部分でそれをラップする。ペトリ皿に魚を移す。麻酔への曝露を避けるために、ラテックスまたは類似の手袋を着用してください。静かに皿の底に魚を押しながら、(図3、左パネル)麻酔で皿を埋める。
- 3mmの直径白金板電極は、(資料を参照してください)網膜の約半分にエレクトロポレーションパルスをローカライズします。我々は、一般的に背側網膜を対象としています。ゆっくりと眼の腹側半分に下向き正極を押してください。削除された外側の角膜で、眼は眼球の背の部分を露出させる、簡単に回転させる。
- 目の露出した背側半 - まだ目の腹側に押しながら、(2ミリメートル〜1)の近くに負極を配置する。損傷につながるどの、眼に直接負極に触れないように注意してください背側網膜。したらelectroporatingときにそのスプレッドを維持するために電極のハンドルで調整ネジを使用し、電極間の適切な距離を決定する。これは、負極に正極が位置に押されている眼球から最適な距離を保つ。
- CUY21方形波のエレクトロを使用して目をエレクトロ(資料を参照してください)。エレクトロポレーションのパラメータは、パルス間の1秒のポーズが75 Vで、つの連続した50ミリ秒のパルスに設定する必要があります。
- 水槽に魚を戻す。我々は通常、一定の光誘起網膜変性直後のエレクトロポレーションのために我々のプロトコルを起動します。
5。代表的な結果:
- エレクトロポレーション(モルホリノの安定性に応じて)以下の3〜5日間、lissamineのラベルは、区分網膜(図4)の網膜の層のすべてで可視化することができます。これは、存在の確認となりますラベル付けモルホリノ。
- 我々は、モルホリノの有効性(図5)の応じて、3-5日に、以下のエレクトロポレーションを完全なタンパク質のノックダウンを達成することができます。通常は、光治療の研究中に、我々は、モルホリノのエレクトロポレーション後3〜4日で目を収穫。と免疫組織化学15組織を処理する、これは、湾曲した端(資料図6)でデュモン#5Bの鉗子で全体の目を削除することによって行われます。任意のノックダウン技術の場合と同様、効率的なノックダウンのデモは、表現型を検証するために示されている必要があります。したがって、我々は目的のタンパク質のために取得する抗血清を示唆している。また、抗体が利用できないとモルホリノはpre - mRNAの中のスプライスアクセプタまたはドナーサイトのいずれかに指示されている場合、それは、mRNAの効率的なスプライシングをブロックします。この場合、それはmorphant RNAのフランキング配列を増幅し、通常のsplicをブロックの効率を決定するために逆転写酵素- PCRを使用することが可能です。INGのパターン。
- 網膜は、鼻から背腹軸上で時間的に切片化になると、影付きの青色のボックス(図6)は、最も頻繁にエレクトロポレーションイベント自体から破損している網膜の領域を表します。影付きのピンクのボックスには、エレクトロポレーションによって網膜細胞へのモルフォリノ導入を対象としている領域を表します。

図1回路図は、角膜の上皮層の除去を描いた。左側のパネルでは、レンズ(L)、硝子体(ビタミン)、網膜(R)、外側の角膜(OC)、内側の角膜(IC)、および角膜の突出部を含む眼の主要な構造的特徴を示しています( CL)。眼の向きは(V)最初のパネルの右下に示されていると前方()、後方(P)、背側(D)標識され、そして腹。赤色の着色が取り除かれている外側の角膜を示します。第二パンエルは、鉗子が角膜突起を把握するために、低角度(番目のパネル)に目を越え外側の角膜をプルするために使用される方法を示しています。右側のパネルには、角膜を引きながら鉗子の2番目のペアが安定した眼に使用することができる方法を示しています。

図2。モルフォリノの硝子体内注射に関連する手順の概略図。小切開は、瞳孔が虹彩を(左パネル)に適合目に行われます。生じるギャップが挿入されるモルホリノソリューション、(中央のパネル)で満たされている33ゲージの針、のための十分な大きさでなければなりません。徐々に硝子体(右パネル)に溶液0.5μLを注入する。硝子体は部分的にlissamineタグ付きモルホリノ(右パネル)に置き換えられるように、切開から出てくる硝子液の少量を視覚化する必要があります。
ig3.jpg"/>
図3。一般的なエレクトロポレーション手順の概略図。硝子モルホリノを注入された麻酔魚は、、静かに湿らせたペーパータオル(左パネル)にラップされています。ペーパータオルは、エラをカバーするが、(中央のパネル)目をふさがないでください。ゆっくりと眼の背側半分がソケットから抜けるできるように、眼の腹側の部分に正極を下に押します。眼の背側半分から負極約1mmを置き、エレクトロポレーション(右パネル)を起動します。

図4。硝子硝子lissamineタグ付きモルホリノ(B)を注入し、エレクトロlissamineタグ付きモルホリノ(A)、および網膜を注入することなく、エレクトロ網膜を比較する共焦点画像。 lissamineラベルは、すべての網膜の層および細胞型に含まれています。 ROS、ロッド外セグメント、ONL、外顆粒層、INL、内顆粒層、GCL、神経節細胞層。
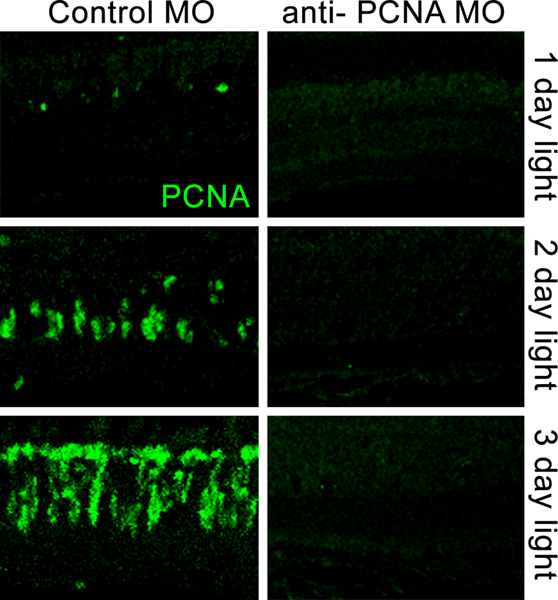
図5。網膜にPCNAの免疫局在を比較する共焦点画像は、前の光誘起光受容体細胞死に対する抗PCNAモルホリノ(右のパネル)とエレクトロ制御モルホリノ(左パネル)と網膜でエレクトロ。暗順応大人アルビノゼブラフィッシュは、モルホリノのエレクトロポレーション後1、2、または3日間一定の強烈な光の中に置かれた。コントロールモルホリノは、光損傷を受けた網膜で増加PCNAの発現を抑制するために失敗しました。抗PCNAモルホリノ、効率的に一定の強烈な光のダメージの三日間を通じてPCNAの蛋白質の発現をノックダウン。

図6。pのための眼球摘出を示す回路図(左パネル)背腹軸に沿って行われrocessingとcryosectioning、。ピンクの網掛けのボックス(右のパネル)は、この手法を用いたタンパク質のノックダウンの最大量と網膜の領域を示しています。青い影付きのボックスは最も頻繁にエレクトロポレーションイベントによって損傷されている領域を表します。眼の向きは(V)、()前方後方(P)、背側(D)、および腹ラベルが付けられています。
ディスカッション
最近、2つのマイクロアレイ解析は、光損傷を受けた網膜または外科的に摘出した網膜のパッチ10、16のいずれかの再生中に発生した遺伝子発現の変化を調べた。両方の研究では、どちらかの可能性などの細胞周期にミュラーグリアの再突入のような網膜再生中に発生したさまざまなイベント、ために必要とされる、増減、式の中で重大な変化を示した多数の遺伝子を明らかにしたの増殖と移動を続け、損傷した網膜層、および正しい神経細胞のタイプに神経前駆細胞の分化に神経前駆細胞。これら二つのマイクロアレイデータセットの直接比較は、これらの細胞イベントに関与する可能性がある候補遺伝子を明らかにしながら、最終的にこれらの遺伝子とその符号化されたタンパク質は、それらが神経再生のために必要かどうかを判断するためにテストする必要があります。ここで、我々はconditioに強力な機能喪失型のアプローチを説明します大人のゼブラフィッシュの網膜への関心のナリーノックダウンタンパク質。この手法は、DNA複製17から19に必要な細胞外および細胞内蛋白質だけでなく、シグナル伝達分子、転写因子とタンパク質の両方を研究するために使用されています。従って、この方法は非常にゼブラフィッシュで大人の網膜再生の根底にある分子メカニズムの理解を支援しています。
成功したプロトコルが達成される前に、我々は、複数のエレクトロポレーションパラメータ(電圧、パルス数、パルス間の時間)テスト。回生ゼブラフィッシュ尾鰭の鰭にelectroporatingモルフォの前回の報告書は、低電圧(15 V)20時10パルスを使用。大人のゼブラフィッシュの網膜は、複数の細胞層に囲まれ、ピンセット電極に容易にアクセスできないされているため、フィンで使用するパラメータは、効率的に大人の網膜にモルフォのelectroporatingで不成功だった。逆に、高電圧(100 V)、しばしば解像度魚の死にulted。最近、80 Vの5パルスは、新生仔マウス子犬網膜21にプラスミドDNAをエレクトロに記述されていた。我々は75のやや強い2パルスは、Vが治療を受けた魚の100%の生存率を持つ成人のゼブラフィッシュの網膜にモルフォの成功したエレクトロポレーションにあることが判明。さらに、我々は、角膜のコンポーネント(または外部最も)最も外側の除去は非常にエレクトロポレーションの効率を増加させることを発見した。パルスの数を増やすと、この組織の除去が不要なこともありますでなく、より大きな組織の損傷を引き起こす可能性があります。大規模な対照研究は、これらのパラメータは、任意の重要な網膜細胞死を引き起こしたり、光受容体再生19中に観察された特定の細胞応答を変化させなかったことが示された。機能獲得型研究は、 生体内でこのテクニックを使用して、現在一貫してすべてのRに大きなリボ核酸をエレクトロに私達の無力のために可能ではないetinal細胞。しかし、外植片の in vivoおよびゼブラフィッシュ網膜におけるマウスの網膜にプラスミドをelectroporatingの成功は、それはまだゼブラフィッシュ21、22の可能性を示唆している。
この技術の強みの一つは、エレクトロポレーションが効率的に異なる網膜細胞の種類のすべてにモルホリノを導入するように見えるです。しかし、ある潜在的な弱点は、エレクトロポレーションが効率的にのみ背と網膜中心領域にモルホリノを納入ということでした。すべてのレイヤーが、しばしば損傷の結果にターゲティング良いの網膜の結果の腹側半分に向かって第二エレクトロポレーションイベント。この空間的制約はおそらく、電極の形状と配置によるものであった。眼の周囲に配置することができるカスタム設計されたカップ状電極の使用は、この弱点が改善されることがあります。モルホリノ配信のこの空間的な制限は、この技術の使用を制限し、アッセイの成功の使用を排除網膜のグローバルな評価を必要とするERGの分析としてH。それはどんなモルホリノ実験と同様に、それが標的mRNAの二番目の非重複モルホリノを使用して、結果を確認することをお勧めであることに留意すべきである。場合によっては、それはまた、二つの異なるタンパク質の発現をノックダウンするために同時に二つの異なるモルフォをエレクトロすることが可能です。我々は、個別におよび組み合わせ18、Pax6aとPax6bタンパク質の両方の発現をノックダウンすることによってこれを実証。
我々は、光損傷モデルでは、このテクニックを使用することを示したが、それはおそらく他の損傷のモデル2-8の再生を研究するために使用されるか、または破損していない網膜のタンパク質の機能を調べるために使用することができる。例えば、モルフォのエレクトロポレーションは、神経節やアマクリン細胞でノックダウンするために特定のチャネルやシグナル伝達分子の発現を使用して、これらのシグナル伝達の機能を研究することができます視覚処理の経路。しかし、モルフォは、新しいタンパク質の翻訳に影響を与えるとして、一つは分析が実行される前に内因性タンパク質の代謝回転が発生するまで待つ必要があります。タンパク質の安定性に応じて、それは数時間から数日〜18の範囲があります。
開示事項
我々は、開示することは何もない
謝辞
著者らは、ゼブラフィッシュの彼らの手入れや、保守のためにゼブラフィッシュの研究スタッフのためにFreimannライフサイエンスセンターとセンターに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| CUY21 - EDITまたはCUY21 - SC方形波エレクトロ | プロテックインターナショナル | CUY21EDITまたはCUY21SC | 両方のユニットは、このプロトコルのために働く |
| 3 mm径のパドルの電極 | プロテックインターナショナル | CUY 650 - P3 | |
| モルホリノ | GeneTools、LLC | モルフォリノは、目的タンパク質にカスタム設計する必要があります。 | |
| 2 - フェノキシエタノール | シグマ | 77861 - 1L | 麻酔、手順については、魚系の水で希釈1:1000、安楽死のための1:500 |
| デュモン#5ピンセット | 世界の精密機器 | 14095 | 仕事を持つ任意の第5ピンセット |
| 角度のヒントとデュモン#5Bのピンセット | 世界の精密機器 | 500234 | 摘出の目は、次の安楽死に使わ |
| サファイアナイフの柄を持つサファイアブレード、ダブルエッジランス、幅1 mmの | 世界の精密機器 | ブレード:500314 ハンドル:500317 | |
| 取り外し可能な33ゲージの平滑末端針でハミルトンシリンジ | ハミルトン会社 | シリンジ:87930 針:7762〜06 | 注射器に付属の針を外して、33ゲージの平滑末端針を交換してください |
参考文献
- Fausett, B. V., Gumerson, J. D., Goldman, D. The proneural basic helix-loop-helix gene ascl1a is required for retina regeneration. J. Neurosci. 28, 1109-1117 (2008).
- Fimbel, S. M., Montgomery, J. E., Burket, C. T., Hyde, D. R. Regeneration of inner retinal neurons after intravitreal injection of ouabain in zebrafish. J. Neurosci. 27, 1712-1724 (2007).
- Hitchcock, P., Ochocinska, M., Sieh, A., Otteson, D. Persistent and injury-induced neurogenesis in the vertebrate retina. Prog. Retin. Eye Res. 23, 183-194 (2004).
- Raymond, P. A., Barthel, L. K., Bernardos, R. L., Perkowski, J. J. Molecular characterization of retinal stem cells and their niches in adult zebrafish. B.M.C Dev. Biol. 6, 36-36 (2006).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Wolburg, H. Time- and dose-dependent influence of ouabain on the ultrastructure of optic neurones. Cell Tissue Res. 164, 503-517 (1975).
- Wu, D. M., Schneiderman, T., Burgett, J., Gokhale, P., Barthel, L., Raymond, P. A. Cones regenerate from retinal stem cells sequestered in the inner nuclear layer of adult goldfish retina. Invest. Ophthalmol. Vis. Sci. 42, 2115-2124 (2001).
- Yurco, P., Cameron, D. A. Responses of Muller glia to retinal injury in adult zebrafish. Vision Res. 45, 991-1002 (2005).
- Vihtelic, T. S., Soverly, J. E., Kassen, S. C., Hyde, D. R. Retinal regional differences in photoreceptor cell death and regeneration in light-lesioned albino zebrafish. Exp. Eye Res. 82, 558-575 (2006).
- Kassen, S. C., Ramanan, V., Montgomery, J. E., Burket, C. T., Liu, C. G., Vihtelic, T. S., Hyde, D. R. Time course analysis of gene expression during light-induced photoreceptor cell death and regeneration in albino zebrafish. Dev. Neurobiol. 67, 1009-1031 (2007).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene 'knockdown' in zebrafish. Nat. Genet. 26, 216-220 (2000).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- London, C. A., Sekhon, H. S., Arora, V., Stein, D. A., Iversen, P. L., Devi, G. R. A novel antisense inhibitor of MMP-9 attenuates angiogenesis, human prostate cancer cell invasion and tumorigenicity. Cancer Gene Ther. 10, 823-832 (2003).
- Thummel, R., Kassen, S. C., Enright, J. M., Nelson, C. M., Montgomery, J. E., Hyde, D. R. Characterization of Muller glia and neuronal progenitors during adult zebrafish retinal regeneration. Exp. Eye Res. 87, 433-444 (2008).
- Cameron, D. A., Gentile, K. L., Middleton, F. A., Yurco, P. Gene expression profiles of intact and regenerating zebrafish retina. Mol. Vis. 11, 775-791 (2005).
- Craig, S. E., Thummel, R., Ahmed, H., Vasta, G. R., Hyde, D. R., Hitchcock, P. F. The zebrafish galectin Drgal1-l2 is expressed by proliferating Muller glia and photoreceptor progenitors and regulates the regeneration of rod photoreceptors. Invest. Ophthalmol. Vis. Sci. 51, 3244-3252 (2010).
- Thummel, R., Enright, J. M., Kassen, S. C., Montgomery, J. E., Bailey, T. J., Hyde, D. R. Pax6a and Pax6b are required at different points in neuronal progenitor cell proliferation during zebrafish photoreceptor regeneration. Exp. Eye Res. 90, 572-582 (2010).
- Thummel, R., Kassen, S. C., Montgomery, J. E., Enright, J. M., Hyde, D. R. Inhibition of Muller glial cell division blocks regeneration of the light-damaged zebrafish retina. Dev. Neurobiol. 68, 392-408 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci U.S.A. 101, 16-22 (2004).
- Kustermann, S., Schmid, S., Biehlmaier, O., Kohler, K. Survival, excitability, and transfection of retinal neurons in an organotypic culture of mature zebrafish retina. Cell Tissue Res. 332, 195-209 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved