このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経形態形成の研究のための方法:
要約
大脳皮質の発達における遺伝子の機能の迅速な評価を行うために、我々は関与する方法を説明 ex vivoでエレクトロポレーション。このプロトコルは、神経新生、神経細胞の移動と樹状突起と軸索伸長を含むニューロンの形態として、神経発達のさまざまな側面の研究に適している。
要約
大脳皮質は、より高い認知機能を指示します。この6層構造は、最後に生まれたニューロンは脳1の表面に向かって最初の生まれのニューロンを越えて移行する際、最初の生まれたニューロンは脳室に近いままでいる内に、最初に、外から最後の方法で生成されます。ニューロン移動2に加えて、正常な皮質機能のキープロセスでは、ニューロンの形態3の規制です。神経細胞の形態形成は初代培養の in vitro で検討することができますが、これらのプロセスは、組織の環境では規制されている方法から学ぶべき多くがあります。
我々は大脳皮質4,6の器官スライスの神経細胞移動および/ または形態を分析する手法について説明します。 pSilencer変更されたベクトルは、二本鎖ヘアピンRNAを駆動するU6プロモーターとbを駆動するGFP蛋白質をコードする別の発現カセットの両方が含まれている使用されている屋CMVプロモーター7-9我々のアプローチは、候補遺伝子の特定のノックダウンによって神経突起伸長の欠陥を迅速に評価することができ、正常に神経突起伸長の8レギュレータの画面で使用されています。細胞のサブセットのみがRNAiコンストラクトを表現されるため、器官のスライスは、潜在的な表現型のモザイク解析を可能にします。この分析は、 生体内環境に近い近似値で行われるため、また、それは未知の皮質機能の遺伝子のための低コストおよびトランスジェニックやノックアウト動物の世代への迅速な代替手段を提供します。最後に、in vivoでのエレクトロポレーション技術と比較して、ex vivoでのエレクトロポレーション実験の成功は、熟練した外科手術のスキル開発に依存しないで、短いトレーニング時間とスキルで行うことができます。
プロトコル
1。 (ないビデオで)培養液とメディアの準備
- 1X HBSS、2.5 mMのHepes緩衝液(pH7.4)、30mMのD-グルコース、1mMのCaCl 2、1mMのMgSO 4をおよび4mM NaHCO 3を含む完全ハンクス平衡塩溶液(HBSS)の1リットルを準備します。蒸留水(DDH 2 O)を追加します。 4で0.2μmフィルターや店舗℃で滅菌するフィルタリング
- 基礎培地イーグル培地の35mLの、完全なHBSSの12.9 mLを、20mMのD-グルコース(1 M溶液1.35 mL)を、1mMのグルタミン(200 mM溶液0.25 mL)を、ペニシリンの0.5ミリリットルを使用して、スライス培養培地を準備します。 - ストレプトマイシン100×ストック。 0.2μmのフィルターで滅菌ろ過し、次いで、5%の最終濃度に血清熱不活馬を追加します。
- 滅菌蒸留脱イオン水で1 mg / mLとラミニンのストック溶液を作ることによってラミニンワーキング溶液を調製します。 -80℃で0.5mlのエッペンドルフチューブに100μLのアリコートを準備し、凍結℃の
- ので、作業ポリ-L-リジンの準備1 mg / mLのストック溶液を作るためにポリ-L-リジンの5mgに滅菌H 2 O 5mLを追加することにより、lution。 -20℃で1 mLを分注し、凍結を準備します。
- 滅菌水で12 mLの最終的なボリュームにポリ-L-リジンの1 mLおよびラミニンの100μLに希釈してコーティング溶液を調製します。毎回新鮮なこのソリューションを作成します。
2。器官スライスを挿入します(ないビデオ)の準備
- よく滅菌ピンセットを使って1つのカルチャーインサートを持つ2つの6ウェルプレートを準備します。カルチャーインサート下に無菌のddH 2 O 2 mLを追加します。
- 穿刺に膜を気にしないながら膜の上にコーティング溶液の1 mLを加える。 37℃および5%CO 2の加湿インキュベーターで一晩インキュベートします。
- コーティングメディアを取り出し、滅菌H 2 0 3回膜を洗浄する。使用前に乾燥を挿入してみましょう。 37スライス培養培地と場所の1.8 mLを°Cインキュベーターを追加します。パラフィルムで使用されていないプレートをラップと4週間まで4℃で保存。
3。 (ないビデオ)エレクトロポレーションの準備
- エレクトロポレーションのためにRNAiコンストラクトを準備します。二重鎖RNAヘアピンインサートはpSilencerベクターにクローニングした。プラスミド含まれています:1)二本鎖RNAの生成を駆動するU6プロモーターおよび2)GFP発現カセットは、CMVプロモーター8,9によって駆動される。このプラスミドは、以前小西ら9と他の7,8で説明されている。プラスミドはキアゲンマキシプレップキットを用いて精製し、1 mg / mLの濃度で使用されています。
- それを注入しながらDNAを可視化するために、0.5%ファストグリーン染料溶液を調製し、(通常は速いグリーンの1μLのDNAの20μL)を注入するDNAで1:20でそれを使用しています。 DNA-ファストグリーン染料の混合物を介して左週間までは-20℃で保存することができます。
- きれいな解剖領域dissectingのツールと70%エタノールでビブラトーム容器。それは氷冷になるように、完全なHBSSを冷やす。急速な冷却のためのいくつかの水でビブラトーム内側にその周りに氷を詰めることによってビブラトーム容器を冷やす。完全なHBSSを用いて3%低融点アガロースを準備します。 1分間電子レンジ。沸騰する上で避ける。使用するまで42℃水浴中で保管してください。
- エレクトロポレーションパラメータは次のように設定されています。 E15胚を使用する35 V、5パルス、100 msの長さ、パルス間の900ミリ秒間隔の。古い動物については、エレクトロポレーションを確保するため、50 Vに高い電圧を使用するか、または最大8パルスにパルス数を増やします。若い動物では組織の損傷を防ぐために、25のいずれかに少ないパルスまたは最大2つのパルスと低い電圧を使用V.これらのパラメータは変化し、動物の年齢に応じて経験的に決定することができる。
4。解離およびエレクトロポレーション(ビデオで)
- 妊娠中の女性の安楽死した後、氷冷HBSSを完全に胚を解剖する。 KE個々の胎盤気嚢内の各胚をEP。
- 胚を解剖し、最初の椎骨の後に頭を切り落とした。氷冷HBSSを完全にしてください。
- 注射のために、ペトリ皿の上にパラフィルムの一部に頭を置きます。皮質の小胞の両方の側脳室を埋めるために第三脳室を介して高速の緑染料·ミックス( 表Iを参照)ハミルトンシリンジたカスタムを使用すると、DNAの約6〜8μLを注入します。また、注射は、それぞれの側脳室に直接行うことができます。
- ex vivoでのエレクトロポレーションでは、BTX-ピンセット白金電極を使用しています。あなたは背側皮質のヘッドすなわち上部をエレクトロポたい大脳皮質の側に向かって正極を配置します。
- エレクトロポレーションした後、解剖前に、少なくとも5分間氷上に頭をインキュベートします。
- 氷冷HBSSby頭部の側面に小さな切開を作り、頭の両側から皮膚を剥離の脳を解剖する。と、次のそっと皮離れて細かい鉗子脳からPIA。皮質に損傷を与えないように注意しながら、頭蓋骨から無傷の脳を削除します。
5。 (ビデオで)を埋め込むとエレクトロポ野のセクショニング
- 氷上に置いた大規模な金型に3%低融点アガロースを転送します。モールドの底部はモールドの底に沈んでダウンから脳を防ぐことができますどの速く固化し始めることになります。穏やかに、微細な鉗子キムワイプまたは濾紙で余分なバッファーを除去した後、一つずつで脳を転送します。アガロースと脳組織間の最大インタフェースを確保するために金型内の渦の脳を、10μLピペットチップを使用しています。
- すべての頭脳を確保するために東洋の脳は同じ向きに、アガロースでほぼ同じレベルである。アガロースは、約5分間固化しましょう。嗅球が立っされるようにアガロースブロックを接続する接着剤(クレイジー接着剤)を使用します。ブロックが接続されたら、すぐに私を追加CE冷HBSSと個々のスライスは、各脳に対して得られていることを確認するアガロースをトリミングします。
- ブロックをスライスするには、低速(約半分の最大値)にビブラトームの速度を設定し、最高設定でブレードの振動周波数を設定します。 250μmの厚さの冠状スライスを生成します。曲がった細かいへらを使用してスライスを取得し、微細なブラシや鉗子で組織のウェルに移す。
- 組織培養フードには、コーティングされたインサートにスライスを転送します。転送を容易にするために、各インサートにスライス培養培地の500μLを追加します。最大5つのスライスには、挿入ごとに配置することができます。スライスの上から余分なメディアを削除し、37℃で加湿インキュベーター中でインキュベートする。
6。文化や器官スライスの解析(ビデオで)
- 健全なスライスを維持するために、新鮮なメディアは、メディアごとに時間の半分を置き換えることにより、膜の下に少なくとも一日おきに追加する必要があります。
- Dの後にスライスを分析するために、文化のesired日、膜のスライスを修正します。 10分間°Cを3回、毎回37℃で1×リン酸食塩緩衝液(PBS)で洗浄する。次に、4℃または室温で1時間、一晩、4%パラホルムアルデヒド(PFA)で固定します。
- スライスは、異なる細胞のマーカーで分析またはエレクトロポレーションと非エレクトロポレーションした細胞を可視化するだけではヘキストで染色することができます。透過性、10%ヤギ血清、穏やかに振盪しながら1×PBS中0.1%のトリトン、室温で2時間のスライスをブロックします。
- 室温で1時間ヘキストで染色し、それぞれの時間が穏やかに振盪しながら1×PBSで10分間で3回洗浄します。
- マウントするにはスライスがメスで膜を切り取り、水チャンバ内の曇りガラスのスライドにスライスを含む膜を転送するために微細な鉗子を使用しています。最大5つのスライスは、スライドガラスごとに配置することができます。余分な水分を除去し、各脳切片へFlourmount溶液の液滴を追加します。穏やかに脳スライスの上にカバースリップを配置し、削除するyの気泡。共焦点顕微鏡を使用してスライスを分析します。
7。器官スライスの代わりにパラフィン包埋(いないビデオ)
- 器官のスライスはまた、上述したようにこの目的のために器官のスライスを含む膜を4%PFAで固定することができ、より細かい形態素解析のためにパラフィンのために埋め込むことができます。
- 固定のスライスは、1%アガロース(37℃にあらかじめ温め)に埋め込まれ、30分間氷中で固化されています。アガロースブロックは、その後30分間、4℃で4%PFAで後固定することができます。
- 器官スライスを含有するアガロースブロックはその後パラフィンに埋め込 まれており、前述の10のように免疫のために処理されます。
8。代表的な結果
器官のスライスのマウス皮質と文化のエレクトロポレーションの概略を図1に示されています。このメソッドは、RAPIのために有用な戦略である神経発達11に関与する遺伝子の機能のD評価。 DNAエレクトロポレーションの量とエレクトロポレーションでは胚の段階に応じて、トランスフェクション効率は異なる場合があります。スライスは、少なくとも8時間後にエレクトロポレーションと細胞は培養中の神経のイベント(増殖、遊走、初期の神経分化)の正常シーケンスを受けることになるGFPを発現するが開始されます。 図2は、pSilencer-GFPコントロールを発現しているエレクトロポレーションの脳スライスを示しています。ベクトルと1つの神経前駆細胞、移行するニューロンとスライスに分化したニューロンを観察することができます。彼らは膜上の優れたメディアのエア·インタフェースで維持され、培養中に少なくとも5日まで使用することができるように器官のスライスがあれば、その形態を維持します。
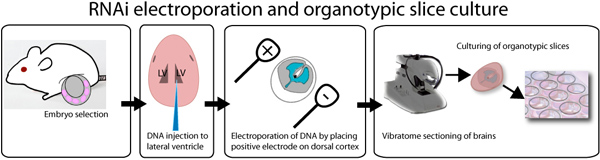
図1。 ex vivoでのエレクトロポレーションおよび器官スライスのイラスト培養アッセイ。E14.5胚を切り出し、個別に注射部位を可視化するために、速いグリーン染料を混合したDNAを注入されています。図や第三脳室に示すようにDNAは、側脳室を埋めるために、両方の側脳室に注入することができます。注入後、脳は、脳の所望の側に正極を配置し、方形波のエレクトロとエレクトロポレーションされています。脳は3%低融点アガロースとビブラトームを用いて切片に埋め込まれています。 250μmの脳スライスは、0.4μmのインサート上に配置され、週にまで培養されています。 GFPは、8時間後にトランスフェクション後に観察することができます。
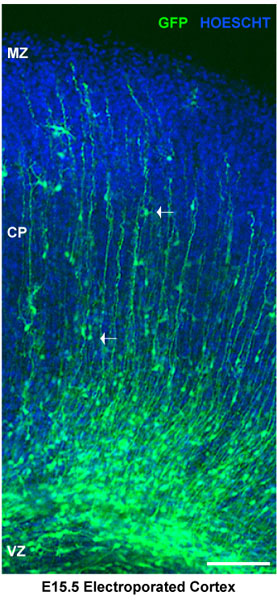
図2。エレクトロ脳スライスの分析。エレクトロポ脳スライスはHoescht染色した。背側皮質脳室帯(VZ)でエレクトロポレーション神経前駆細胞を示しています。コルティ内のニューロンCALプレート(CP)は辺縁帯(MZ)で区切られています。白い矢印は移行ニューロンを示しています。このケースでは、脳はE15.5で注入したとpSilencer GFPコントロールベクターでエレクトロポレーション。のセクションでは、4日、エレクトロポレーション後、皮質外植片を表しています。スケールバーは100μm。
トラブルシューティング:
- トランスフェクション効率が低い:少なくとも1μg/μLのに使用されるDNAの濃度を調整します。必要なDNAを精製するためにエンド - フリーQuiagen社のキットを使用する場合は、常に最大の準備から、非常にクリーンなDNAを使用しています。
- 細胞が所望のものとは異なる脳領域でトランスフェ:電極をエレクトロポレーションする脳の側に向かって正極の位置に正しく配置されていることを確認します。
- 毎日の変更、メディアやスライスがメディアに浮動小数点ではありませんを確認してください。器官のスライスは、形態を失う
- 彼らはviでカットされているようにスライスがアガロースから来るbratome:低融点アガロースで脳を埋め込 むときに良好な界面が行われていることを確認します。
ディスカッション
器官のスライスの二本鎖RNAヘアピン8と文化をコードするプラスミド4のex vivoでのエレクトロポレーションを含むこれらのメソッドは、いくつかの明確な利点を提供しています。最初に、これらのメソッドは、RNAiから派生した表現型の迅速な評価を可能にします。二本鎖RNAのヘアピンを駆動するU6プロモーターを含む同じpSilencerベクター中の発現カセットのエンコーディ...
開示事項
我々は、開示することは何もありません。
謝辞
我々はpSil-GFPコンストラクト、 図1の説明のために博士アルパーウズン、共焦点顕微鏡のためのルダックバイオイメージング機能を提供するための博士シリンBonniに感謝します。 EMMは、バロウズ·ウェルカム財団、NARSAD若手研究者賞、およびNIH NCRR COBRE P20 RR018728-01から医学のためのキャリア賞でサポートされています。 SBLは、NIH NCRR COBRE P20 RR018728-01でサポートされており、PHS NRSA 5T32MH019118-20からの支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ハミルトンシリンジ | HAMILTON | 80008 | 31ゲージ、長さ0.5インチ、PT-4(ポイントベベルのレベル)、10μlの体積 |
| プラチナtweezertrodes | BTX | 45から0489 | 5ミリメートルサイズ |
| ECM830エレクトロ | BTX | 45から0002 | |
| BTXフットスイッチ | BTX | 45から0208 | ECM830エレクトロで使用するために |
| 振動刃ミクロトーム | ライカ | VT1000 S | |
| 6 - インサートで使用するだけでなく料理 | FALCON | 353502 | インサートに適合するようにノッチが含まれています |
| 組織培養インサート | FALCON | 353090 | 0.4マイクロメートル |
| 速いグリーン | SIGMA | F7252 | |
| 低融点アガロース | FISHER | BP165-25 | DNAグレード |
| ラミニン | Sigma-Aldrich社 | L2020 | |
| ポリエルリジン | Sigma-Aldrich社 | P5899 | |
| 基礎培地イーグル | シグマアルドリッチ | B-1522 | |
| CaとMgせずに10倍のHBSS | GIBCO | 14180-046 | |
| HEPES-遊離酸 | Sigma-Aldrich社 | H4034 |
参考文献
- Angevine, J. B., Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved