このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロインジェクション分子およびそれらの真核生物の細胞内ターゲットを視覚化するツールに相関光学および電子顕微鏡(クレム)
要約
CLEMの技術はマイクロインジェクション分子の影響を受け、膜、細胞小器官、および細胞内構造の超微形態を分析するように適合されています。このメソッドでは、複数ナノメートルの分解能にミリメートルできるようにマイクロマニピュレーション/マイクロインジェクションの強力な技術、共焦点蛍光顕微鏡、電子顕微鏡を組み合わせたものです。この技術は、多種多様なアプリケーションに適している。
要約
真核細胞は、複雑に依存して高度に規制され、適切な細胞機能のために必要な生化学的な極性を維持する機能的に異なる膜結合コンパートメント。酵素、タンパク質、および細胞骨格成分がこの生化学的分離を支配し、維持する方法を理解することが極めて重要でことである。および/または混乱させる細胞内コンパートメントローカライズする蛍光標識分子の使用は、豊富な知識を得られたと携帯規制の我々の理解を進めてきた。蛍光、共焦点顕微鏡などのイメージング技術は比較的単純蛍光標識小分子の位置を確認し、しかし、非常に小さな構造の分解能は1に制限されます。
一方、電子顕微鏡は、非常に高い解像度で細胞内の形態の詳細を明らかにしたが、その静的な性質は、それが困難な高度に動的なプロを測定することができる精度2,3とcesses。したがって、同じ試料の電子顕微鏡と呼ばれる相関光学および電子顕微鏡と光学顕微鏡との組み合わせ(CLEM)4,5は 、電子顕微鏡6の高解像度を持つ超高速蛍光イメージングの二重の利点が得られる。この強力な技術は、細胞生物学5,7の多くの側面を研究するために実装されています。創業以来、この手順では、高解像度で細胞内のアーキテクチャや形態を区別するために我々の能力を高めている。
ここでは、CLEM( 図1)に続いて急速なマイクロインジェクションを実行するための効率的な方法を提示します。マイクロインジェクションのCLEMプロシージャが直接真核細胞の細胞質に小分子および/ またはタンパク質の特定の量を導入し、ミリメートルからマルチナノメートルの分解能( 図2)への影響を研究するために使用することができます。技術はマイクロインジェクションに基づいている細胞は両方共焦点蛍光顕微鏡および電子顕微鏡でライブセルイメージング料理との裏面に貼付レーザーエッチングされたガラスグリッド·カバースリップ上に成長させた。興味のあるセル(複数可)の局在を容易に試料の固定化に使用エポン樹脂に、目的の細胞と一緒に、転送され、電子顕微鏡分析( 図3)に先立ってセクショニングされるグリッドパターンによって促進される。蛍光およびEM画像のオーバーレイは、ユーザーが同様に関心のマイクロインジェクション分子( 図4)により誘導される任意の形態学的および/ または微細構造の変化などの細胞内局在を決定することができます。この手法は、マイクロインジェクション試料の性質に応じて、いくつかの時間≤5秒からまでの範囲の時間ポイントに適している。
プロトコル
1。哺乳動物細胞培養
- 正常ラット腎(NRK)、不死化子宮頸癌(HeLa細胞)、または他の適切な哺乳動物細胞株を37℃で培養される℃、5%CO 2は 、セル料理を生きるために貼付フォトエッチングガラスグリッド化されたカバースリップ上で(任意の試薬 については、 表1を参照するか、 DMEM中でこのプロトコルに使用される装置)+ 10%FBSおよび1%ペニシリン/ストレプトマイシン。哺乳類培養細胞を扱うときの注意事項は、無菌環境を維持するために取られるべきである。
- あなたの実験のタイムライン(0-5時間対 1から2日後に注射)に応じて細胞の密集度は約50%に調節したり、それぞれ、25%〜すべきである。
2。マイクロインジェクション
- 〜50μlの最終体積に、細胞培養への従順さに応じて、バッファのあなたの選択で目的のタンパク質、DNA、または小分子を準備します。例えばテキサスレッドまたはカスケードブルーなどの不活性の蛍光色素マイクロインジェクション、細胞をマークするために含まれており、注射染料と蛍光プローブの選択は非重複励起および発光波長を持つ必要があります。マイクロインジェクションのために必要な目的の分子の濃度は、経験的に決定されるべきであり、蛍光トラッキング色素は、一般的に0.5から1.0 mg / mlで使用されています。典型的には、ローダミンまたは別の蛍光色素分子は共有結合の検出が、他の方法は感度に応じて使用することができ、市販のキットを使用して興味のある分子に結合されています。詳細については、下記の重要な考慮事項を参照してください。
- 0.22μmの遠心フィルターを通して注入物質(〜50μl)をフィルタリングします。遠心フィルターは、真空および/またはデッドボリュームが関連付けられているシリンジろ過よりも優先されます。
- マイクロインジェクションニードルを生成するには、ホウケイ酸ガラスピペットは、メーカーのガイドラインに従って、フレイミング·ブラウンマイクロピペットプラーを使用してプルアップされています。代わりに、マイクロインジェクション針はfemtotipマイクロインジェクション針を作るエッペンドルフ含むベンダーから購入することができます。
- 慎重エッペンドルフ20 Femtotipsを使用してマイクロインジェクション針の悩まされていない端に注入物質の4μlをピペット。気泡が引っ張らマイクロインジェクションニードル内に存在しないことを確認します。倒立顕微鏡に取り付けられたエッペンドルフFemptoJet Injectmanのマイクロマニピュレータアームにマイクロインジェクションニードルをロードします。マイクロインジェクション手順の良いレビューのために、読者は可視化実験の資料8の以前のジャーナルに向けられている。
- 倒立ツァイス顕微鏡の皿ホルダーにグリッド化カバーガラスおよび培養細胞を用いた生細胞の皿を置きます。フォトエッチンググリッド内で増殖している細胞を見つけて、グリッドの英数字識別子の点に注意してください、これは、以降のすべてのステップで使用されます。以降の手順では、カバーガラスの縁でサンプル移送を制限するように理想的には、カバースリップの中心に細胞を見つけます。
- 手動で低くインジェクションカバースリップ上の所定の位置にアームと、先端が優しく培養細胞およびこのポイントを超えて針の動きを防ぐために、プレス 'Limitの表面に接触するまで、マイクロマニピュレータジョイスティックとコントロール、下注射針を下に使用して、したがって、脆いを壊すホウケイ酸ガラスを引っ張った。細胞のマイクロインジェクションの他のすべての側面を、エッペンドルフFemtoJet InjectManユーザーマニュアルに従って実行されます。マイクロインジェクション法は、最近細菌9から分泌される個々の病原性タンパク質を理解するために使用された。
- 選択されたグリッド内の他のすべての細胞を顕微注入する。コンフルエント〜50%で成長した細胞では、1は600μm2グリッドあたり〜80セル(例では、 図3(a)に示すように)期待することができます。従って、蛍光および電子顕微鏡検査により、30から40〜実験と対照細胞のnがあるでしょう。
- 目的のために哺乳動物細胞培養インキュベーターに戻し、生細胞皿を置き時間は、実験装置によって決まる。あるいは、一つは前固定に関心のある特定の細胞内構造の出現を待つためにマイクロインジェクションからタイムラプス顕微鏡分析に直接進むこともできます。
3。蛍光顕微鏡法
- 必要に応じて、マイクロインジェクション、細胞の生細胞タイムラプス蛍光測定を実行し、その後、0.1Mカコジル酸緩衝液(pH7.4)に2.5%グルタルアルデヒドでメディアを交換して、室温で10分間インキュベートする。生細胞の測定が必要とされない場合は、細胞増殖培地を廃棄し、10分間室温で1xPBSで5ミリリットル3.7%ホルムアルデヒドで細胞を固定します。固定液を捨て、5mlの1xPBSと交換して、3.2に進みます。注:それは蛍光顕微鏡が完了するまで、グルタルアルデヒドを追加しないように非常に重要です。
- 蛍光顕微鏡でフォトエッチンググリッド化されたカバースリップで生細胞の皿を置き(共焦点は、THIは必要ありません■ステップ)とセルの配置( 図4A)を文書化するために5月10日、明視野と適切なグリッドの蛍光画像を収集する。不活性の注入色素( 図4B)の励起および発光波長を用いて顕微注入された細胞を同定する。これは、電子顕微鏡を含む後続のステップでマイクロインジェクション細胞の同定を容易にするために、異なる倍率(例えば10xと65X)で画像を得ることが重要である。
- 共焦点蛍光顕微鏡を用いて、上記の手順2.5で識別されたグリッド内のマイクロインジェクション、細胞のZ-スタックを収集します。高倍率(100倍)は、電子顕微鏡で同定される細胞内構造と蛍光画像を相関させるために必要です。
- カバーガラスは、市販のカバースリップの除去液を用いて生細胞の皿の底から除去し、5 mlを含むバージン細胞培養皿に細胞側を上に配置されている1xPBS。以下に詳述するようにカバースリップを使い、電子顕微鏡用に処理されます。
4。透過型電子顕微鏡
- 0.1Mのカコジル酸緩衝液(pH7.4)で2ミリリットル2.5%グルタルアルデヒドで1xPBSバッファーを交換し、10分間室温でインキュベートする。長いインキュベーションは、必要ありませんが、細胞内構造の維持に役立ちます。注意:単独でホルムアルデヒドは電磁界解析のための十分な固定ではありません。
- カコジル酸緩衝液で3回洗浄し、続いて30分間の0.1Mカコジル酸緩衝液2 mlの1%四酸化オスミウムを加えて固定液と染色細胞を除去し、最後に蒸留H 2 Oですべてのバッファを置き換える
- 標準のEMプロトコルに続いて、エタノールで段階(70%〜100%)を直列にサンプルを脱水。エポン樹脂が充填されたチューブの上にエポン樹脂と場所のカバーガラスセル側を下準備します。 60℃で24時間重合を許可℃にセル側が行うフォトエッチンググリッド化されたカバースリップを置くことでエポン樹脂にWNは、目的の細胞だけでなく、グリッドパターンの両方が( 図に示した例3B)重合時エポン樹脂に転送されます。
- 速やかに液体窒素および/または熱湯に浸漬することによって、エポン樹脂からカバーガラスを外します。興味のあるグリッド(:グリッドパタパタは鏡像として転送されます注意してください)検索する双眼解剖スコープ内で樹脂の表面を点検してください。無菌のかみそりの刃またはメスを用いて、関心のある唯一のグリッドはエポン樹脂ブロックの頂点にあるようなエポンブロックを切り詰める。
- ウルトラミクロトームを使用して、所望の厚さ(断層TEM用従来のTEMおよび〜250nmの厚さのために〜70nmの厚さ)でトリミングブロックの連続切片を獲得。標準的なプロトコルに従って酢酸ウラニルとクエン酸鉛でセクションを比較してください。
5。相関光学および電子顕微鏡
- で、目的の細胞を再配置前の手順で得られた画像を用いて電子顕微鏡。興味のある回顕微注入した細胞の位置が特定されている、興味のあったセル内の領域を識別するために高解像度の共焦点蛍光画像を使用しています。 TEMを用いた高解像度の画像、これらを。蛍光zスタック画像がEMスライスに対応するかを決定するためにそのような細胞周囲や核膜などのランドマークを使用しています。
- お好みの画像処理プログラム(例えば画像Jは、Adobe Photoshopなど)を使用して、50%に蛍光画像の不透明度を下げると、それが相関するとTEM像の上に重ねます。スケールを調整することによって、画像(縦横比を固定することを忘れないでください)とTEM像と一致するように共焦点画像の回転を合わせます。蛍光画像のコントラスト、シャープネスなどを微調整し、アライメントを助けるかもしれない。注:私達はヘテロクロマチン、核膜、およびセルの周囲が支援するための優れた建造物を表すことを発見した2画像の向きインチ
6。重要な考慮事項
- 大幅に注入された小分子を識別しやすいように、例えばローダミンまたはフルオレセインなどの蛍光タグが共有結合し、市販のキットを使用して取り付けることができます。追加情報は、異所的にマイクロインジェクションの前に蛍光細胞内局在のマーカータンパク質を発現することによって得られる。したがって、蛍光体および不活性マイクロインジェクショントラッキング色素の選択が重要になります。
- 近くにカバースリップの中心に付着しているマイクロインジェクションのための細胞を選択し、エッジに近いグリッドを選択しないように。これは、目的の細胞を電子顕微鏡に使用エポン樹脂に転写されることが最大の確率を提示します。
- 細胞のコンフルエントI完全合流プレートとして、大事には電子顕微鏡でマイクロインジェクション細胞の同定は非常に困難になります。彼らは短い実験の当日〜50%コンフルエントに達するか、または長い(1-2日)実験当日の密集度25%〜ようではなく、種細胞。位置や形状の細胞と同様に配向させるランドマーク電子顕微鏡像として "空のスペースを使用します。
- 共焦点光学スライス厚は、実験のニーズに合わせて調整する必要があり、したがって、経験的に10を決定すべきである。
- 固定剤のホルムアルデヒドとグルタルアルデヒドは、利用可能な最も高いグレードである必要があります。ホルムアルデヒドは、細胞を固定し、さらにタンパク質や小さな蛍光分子(例えば、ローダミンまたはFITCなど)の両方の蛍光特性を保持します。しかし、それは高いEMの解像度を可能にするための構造が保持されません。グルタルアルデヒドはanaly EMに高度に膜や細胞内構造を保持SISが、かなり蛍光妨げるでしょう。したがって、2つのステップの固定は、蛍光顕微鏡法とEMの両方にとって重要です。最後の固定がグルタルアルデヒド処理によって行うことができるようにホルムアルデヒド固定ステップは、生細胞の測定を実行する場合は省略できます。
7。代表的な結果
この手順では、真核細胞の細胞質に直接目的の分子を提供し、ミリメートルからマルチナノメートルの分解能に対する細胞とorganellerアーキテクチャにその局在および/または効果をモニターする能力を与える。実験装置と手順の概略図を図2に示します。この手法は、共焦点顕微鏡の後、エポン樹脂( 図に目的の細胞だけでなく、グリッドパターンの両方を転送することができるレーザーエッチングされたガラスカバースリップグリッド化( 図3A)、上に成長させた細胞のマイクロインジェクションに依存している3B)。
典型的なマイクロインジェクションのCLEM手順は相関蛍光画像と電子顕微鏡写真を、もたらし、細胞内局在性および超微細構造解析の両方を可能にします。フォトエッチングガラスグリッド化されたカバースリップ上で培養した細胞は、明視野像が得られた後、目的の分子( 図4A)にマイクロインジェクションする。不活性トラッキング色素が非マイクロインジェクション細胞( 図4B)からマイクロインジェクション、細胞を区別するために組み込まれている。共焦点Z-スタックはフルオロフォアまたは関心のマイクロインジェクション小分子( 図4C)に接続された他の識別子を使用して得られる。サンプルは、グルタルアルデヒドで固定し、電子顕微鏡用に処理されます。電子顕微鏡写真は、それに対応するセル( 図4D)に取得され、オーバーレイされます。蛍光シグナルを宿す領域が( 図4Eより高い倍率で、より詳細に検査され)。

図1マイクロインジェクションのCLEM手続きのタイムライン。実験の設定に応じて、マイクロインジェクションし、蛍光測定は、同じ日に行うことができます。電子顕微鏡用の試料を準備する長いインキュベーション工程に最も時間がかかるためで、2〜3日続く。 TEM解析および電子顕微鏡画像を用いた蛍光信号を相関は一日で行うことができます。

図2マイクロインジェクションのCLEM手順の一般的な実例ステップ1:レーザーエッチングされたガラスグリッド·カバースリップ上に増殖している細胞を見つけ、目的の分子を顕微注入するステップ2:明視野画像とマイクロインジェクション、細胞の共焦点蛍光灯Z-スタックの両方をキャプチャステップ3:準備するEMのためのカバーガラスは、分析とエポン樹脂に埋め込む。転送されたグリッドパターンを用いて、目的のように細胞をブロックトリム頂点にあるステップ4:ウルトラミクロトームで切断し、シリアルのセクションでは、 ステップ5:EM画像と蛍光画像を関連付けます。
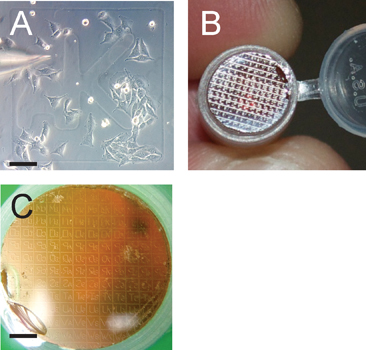
図3グリッドパターンは、目的の細胞の識別を容易にパネル 〜50%コンフルエントまで増殖させた細胞のマイクロインジェクションを示す。。グリッド識別子AKの点に注意してください。スケールバーは100μmである。 パネルBは、関心のあるグリッドは、解剖顕微鏡で同定された後、連続切片となる重合エポン樹脂ブロック上にカバースリップから転送グリッドパターンを示しています。 パネルCは、セクショニングの準備のために転送されたグリッドパターンを示しています。転送されたグリッドのパタパタは樹脂ブロックに逆であることに注意してください。SCAL電子バーは1200μmである。
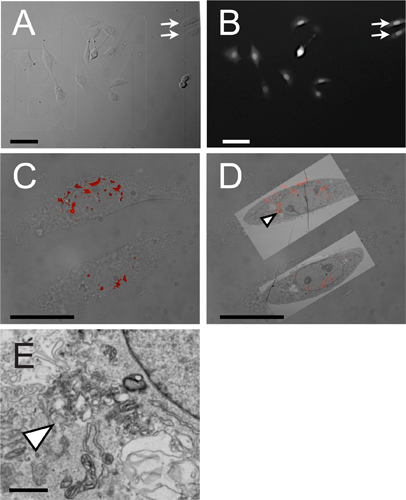
。図4マイクロインジェクション相関光と電子顕微鏡からの代表的な結果をパネルレーザーエッチングされたガラスグリッド·カバースリップ上で生育NRK細胞の明視野顕微鏡写真を示し、矢印は、パネル内のCDのCLEMによって可視化される二つのセルを示すパネルBは蛍光を示す。不活性トラッキング色素の、このケースでは、カスケードブルー、顕微注入した細胞を識別するために使用される。 パネルCは、明視野の重ね合わせとローダミン標識小分子の蛍光シグネチャを示しています。ここに示されている2つのセルはA&B パネルDは明視野、蛍光および電子顕微鏡のCLEMを表すパネルの矢印で示されます。矢先は蛍光punctaはパネルEで高倍率で結像を示しスケールバーは次式のとおりです。安値:パネル&Bは100μm、C&Dは50μm、E、100nmである。
ディスカッション
ここで紹介する方法は、真核生物の細胞質に精製されたタンパク質、核酸、または小分子を直接配信することを可能にし、蛍光および電子顕微鏡の相関関係により超高分解能分析を与える。このメソッドの使用方法はシンプルなもので、様々な既存のコア施設及び/または適切に装備され、電子顕微鏡の研究室で、社内で行うことができます。技術は、ユーザがリアルタイムで蛍光標識された...
開示事項
利害の衝突は宣言されていません。
謝辞
我々は有用な議論アルト研究室のメンバーに感謝。我々はまた、技術的な専門知識とアドバイスを博士クリス·ギルピン、トムJanuszewski、とローリーミューラー具体的には、UTの南西医療センターの分子細胞イメージング施設に感謝します。また、原稿の批判的な読みのために博士Xionanドンに感謝します。この作品は、NMAにNIHの助成金AI083359でサポートされています
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| フォトエッチングカバーガラスとライブセルプレート | マテック | P35G-2-14-CGRD | |
| テキサスレッド | インビトロジェン | D3329 | |
| カスケードブルー | インビトロジェン | D7132 | |
| ローダミン標識キット | サーモサイエンティフィック | 53002 | |
| 0.22μmの遠心ろ過ユニット | ミリポア | UFC30GV00 | |
| ホウケイ酸ガラスピペット | サターインスツルメンツ | BF100-50から10 | |
| マイクロピペットプラー | サターインスツルメンツ | モデルP-97 | ランプテストを実行した後にプログラム#4を使用 |
| FemtoJetのマイクロインジェクションシステム | エッペンドルフ | Injectman NI2 | |
| カバースリップの除去液 | マテック | PDCFのOS 30 | |
| Technai透過型電子顕微鏡 | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | ライカ | EM UC6 |
参考文献
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved