Method Article
個々の準備ショウジョウバエエッグチェンバース
要約
ザショウジョウバエ卵室は、mRNAの局在化のメカニズムを研究するための優れたモデルです。ローカライズのプロセスを支える動的なイベントをキャプチャするために、生きている組織の急速な高分解能のイメージングが必要となります。ここでは、最小限の中断でライブサンプルの解離およびイメージングのためのプロトコルを提示します。
要約
ライブセルイメージングは、このような軸仕様、細胞分化と器官形成1などのトピックを調べるためにモデルとして使用されるショウジョウバエの多くの組織に適用される重要なテクニックです。実験試料の正しい準備は非常に重要、しばしば無視され、ステップです。準備の目標は、生理学的な妥当性を確保するために、最適な撮影条件を確立することです。組織の生存を維持するためには、脱水、低酸素症、発熱、または媒体の劣化2を避けることが重要です。
ショウジョウバエの卵室は、体のパターニング、mRNAの局在と細胞骨格の組織3,4から、限られた関連はなく、疑問を調べるための十分に確立されシステムです。初期および中期段階の卵室では、ハロカーボンのオイルでマウントすると、それは酸素の自由な拡散を可能にすることで生存のために良いですが、脱水と低酸素症を防ぎ、顕微鏡検査のために優れた光学特性を持っています。イム蛍光タンパク質の老化と卵室または5月7日標識RNA、タンパク質または抗体の物理的な注入に導入遺伝子の導入によって可能性があります。たとえば、動物のゲノムにMS2の構造の追加は、卵母細胞8のmRNAのリアルタイム観測を可能にします。これらの構造は、コートタンパク質9 MS2バクテリオファージRNAステムループの相互作用を活用したmRNAのin vivo標識を可能にします。
ここでは、雌のショウジョウバエから個々の卵管と卵室を分離するだけでなく、卵巣の抽出のためのプロトコルを提示します。 ショウジョウバエの卵形成の詳細な説明については、アランC. Spradling(2009年再版1993年)10を参照してください。
プロトコル
解剖のために前に1。 ショウジョウバエの準備(E. Gavis、プリンストン大学によると)
- まばらに播種したボトルから大人を破棄し、°C、実験に先立って25日にボトルを転送します。新成人が出現し始めていたら、二日待ってください。
- 固形食品の約10ミリリットルを含むフライバイアルを取り出し、45度の角度に乾燥酵母の0.5〜0.7グラム(表を参照してください)を追加します。酵母でフライ食品の表面全体をカバーしていません。
- 水和物(図1A)に十分な、酵母に数滴の水を追加します。 45度の角度でバイアルを配置して、酵母の約3分の水(図1B)を吸収することができます。
注:別の方法として、プレミックス別の容器に貼り付け、酵母やスパチュラでバイアルにペーストを追加します。
- CO 2ガスを注入することにより、バイアル中にハエを麻酔。彼らは移動を停止すると、CO 2の上に無意識のハエを傾けるフライパッド(図1C)。
- 微細な先端ペイントブラシ(図1D)と解剖範囲で10から15人の女性と、目的の遺伝子型の男性5名を分離します。男性は、その後部にclaspers、暗い突き出た構造の存在によって明らかである。
- yeastedバイアル(図1E)、選択したハエを追加します。 24から60時間25℃の場所。中間段階の卵室と後期の卵室のために長い期間に若いの大きいパーセントのために短い期間インキュベートします。
(2) ショウジョウバエの卵巣切開
- 第1.5、22×50mmのカバースリップ(図2A)上にハロカーボンオイルの小滴を配置します。それが邪魔になりません側に準備されたカバースリップを設定します。
- CO 2パッドの上にCO 2ガス、チップを注入することによりyeasted下劣でハエを麻酔。
- (ない目の間に、個々の腹部の前で女性の肥育に把握する鋭い微鼻鉗子を使用します。eの腹部と胸郭)(図2B-C)。
- 準備されたカバースリップ上に約2〜3センチメートル、解剖顕微鏡下でピンセットとビューでメスを保持します。
- まだ前方に保持し、女性の極端な後方(図2D)で組織を削除するには、鉗子の2番目のセットを使用しています。注:ガットの組織は、通常、後端に引き出します。ピンセットから採取した組織を拭いてください。
- それでも前で女性を保持したまま、静かに後方に向かって前方から作業、腹部を圧迫したり、マッサージに拭いて鉗子を使用しています。チューブの端から歯磨き粉を削除するのと同じ方法で腹部をマッサージ。
- 二つの大きな不透明な構造体は、鉗子(図2E-F)の端に腹部とスティックからプッシュされます。これらはペアになって卵巣があります。
- 下のスライド上でハロカーボンのオイルに卵巣をタッチします。
- カバースリップ(Figur上の油に4から6卵巣の合計を与えるために解剖を1-2回を繰り返します。電子2G)。
3。の分離卵管
注:各卵巣は、文字列10のビーズのように配置の異なる段階の6から10卵室で構成された約16卵管が含まれています。
注:前に卵管を分離するため、照明は、試料に浅い角度で当たるように解剖顕微鏡で光源を調整します。これは、サンプルにコントラストを与え、若い段階の卵室の可視化を可能にします。
- 油で、閉じた鉗子(図3A)と後端(旧ステージ)で接続組織を除去して、2つの卵巣を分離します。
- オリエント左から右へと最年少のステージへの最古の段階で個々の卵巣。卵巣の若い段階の卵室は透明であり、卵巣のより多くの先端を形成しています。
- 利き手で鉗子のペアで、そっと目の残党、好ましくは卵巣の後部を把握する電子結合組織。鉗子の場所に卵巣を保持しながら、個々の卵管(図3B-D)引き出すために解剖プローブ(またはタングステン針)を使用します。
注意:古い段階が完全に卵巣から分離するには大きすぎるとして、個々の卵管が若い段階(ステージ10〜胚腺)の間に解除されます。
注:解剖プローブと後期の卵母細胞を穿刺すると、油中に漏れて細胞質になり、個々の卵管の抽出が非常に困難になります。後期段階の卵母細胞がパンクしている場合は、新鮮な卵巣に移動します。
- 卵巣管は卵巣の自由になると、実験のための所望の向きに油滴と東洋の中央にドラッグし解剖プローブを使用しています。注:油で卵管が安定し、ガラスに付着します。
- 15から25個卵管があるまで、このプロセス(3.3から3.4)を繰り返します。注:これはmultipの郭清が必要な場合がありますLEの卵巣。全体のプロセスは15分未満を取る必要があります。
注:これは、むしろ実験のためにハエのn個の数を増やすことが少なくハエから両側の卵巣を解剖よりも、いくつかのハエから一卵巣それぞれを詳細に分析することをお勧めします。
注:卵巣小管の乱暴に取り扱うと、不健康な卵母細胞になり、実験の成果物につながる可能性があります。
注:卵子は卵巣(Fを図7Eの比較)から解剖された後、40分を強調するため、表現型の変化を表示するために開始されます。
- 一度卵管に十分な方向(図3E)にある、油の過剰な卵巣組織を移動するために解剖プローブと閉じたピンセットを使用しています。この材料は、ペーパータオルの上にピンセットから一掃することができます。
4。分離し、個々の後期卵室(E. Gavis、プリンストン大学によると)
- DOMINで鉗子のペアを持つアリの手は、好ましくは、結合組織の残党によって、孤立した卵巣の後部を把握する。鉗子の場所に卵巣を保持しながら、鉗子の近くに卵巣(図4A)の後端に解剖プローブをご紹介します。後期の卵室との間でプローブを挿入することによって、任意の卵室を穿刺は避けてください。
- 初期段階の卵室(図4B)でそれが終了するまで卵巣を介して解剖針を引き抜きます。正しく行われた場合、プローブは、場所の卵管および後期段階の卵室を保持する結合組織を削除します。
- 卵管は、カバースリップ上に広がっされるまで、ステップ4.2を繰り返します。注:卵室はもはや互いの上に積み重ねされていない、このステップは完了です。
- 解剖プローブを使用して、簡単に画像(図4C)を可能にするために遅れて卵母細胞を分離します。
注:後期の卵室を解剖しながら卵をパンクチャリングは、iを解剖してのように非難するようではありません若いステージのndividual卵管。
注:ステージ14卵室では、オリエンテーションのための背の付属を把握するために鉗子を使用しています。
5。注射の準備
注:中間段階の卵母細胞の注入は、東洋卵管垂直にカバースリップの長軸に。
- [応用精密からDeltaVisionコア我々のケースで]イメージング顕微鏡をオンにし、適切な画像の設定(図5A-B)を読み込みます。
- 噴射装置(図5C)をオンにします。
- ローディングチップ(図5D-E)で注射針をロードします。注入するソリューションは、注射針をブロックする可能性があり預金を避けるために高速で短時間遠心する必要があります。
- インジェクタにロードされた注射針を取り付けます。針(図5F)を壊してしまわないように注意してください。
- unclogging針を支援するために、カットや壊れたカバースリップからガラス×10 mmの小片を配置卵管を含む油滴のt一面。このガラスの断片が油で覆われていることを確認してください。このガラスは、RAMに針を壊したり、unclogging用に対して針の先端サービスを提供します。
6。蛍光RNAの注入
始める前に:噴射装置と注射針が視野の中心上に配置されるように、マイクロマニピュレータの制御を設定します。
- 顕微鏡ステージ上に注入されるサンプルをマウントします。
- 20倍の目標を選択します。より高いまたはより低い倍率の目標を使用することもできます。
注:ポイント訪問機能を備えた自動ステージを使用している場合は、注射のため8月9日卵開始する前に、すべてのステージをマークすることをお勧めします。これは、簡単に訪問し、選択した卵母細胞の注入を可能にします。
- それは油に接触するまで注射針を下ろします。対物レンズの上にセンター針先。
- ターン部屋の照明を切り、顕微鏡の明視野光をオンにします。マークポイントリストの最初のポイント(卵)を選択します。接眼レンズをのぞきながら、卵母細胞(図6A)に焦点を当てています。
- それは卵母細胞と卵母細胞に見える次のように焦点の同一平面になるまで手動で針を下ろします。
- それは卵母細胞の内側になるまでマニピュレータコントロールを使用して、注射針のポイントを移動します。速い突き刺す動きがしばしば遅い、事前よりも成功しています。中に入ると、針から小さなボリュームを取り出して、視覚的効果を評価し、必要に応じて繰り返します。注入に成功した場合、これは繰り返し明らかでない場合は、卵母細胞内の細胞質は、避難されます。それは材料が注入されているかどうかを判断するために蛍光の画像にする必要はありません。注入後、卵母細胞(図6B-G)の内側から針を外します。
- 注入された流体の正確な量は、定量することは困難である。注入量、adjuを増やすには噴射パルスの圧力や時間ST、繰り返し注入パルスをわずかに開口部を増やしたり、使用する針の先端を破る。
注:正しく実行したときに全体の注入プロセスは10秒未満を取る必要があります。刺すまたは卵母細胞への針の内部に残る大規模な卵室への深刻なダメージになります。
- 次の顕著な卵母細胞を選択する前に、旅行パスに他の卵母細胞に接触しないように油に十分な注射針は、高上げる。
- 新しい卵母細胞では、手順6.6を繰り返します。必要なすべての卵母細胞が注入されるまで、このように上に運ぶ。
注:注入しながらミスが行われた場合は、次のマークされた卵母細胞に移動します。破損した卵母細胞に時間を無駄にしないでください。
注意:針は注射セッション中に目詰まりがあります。このケースでは、カバースリップ上に油でガラスの破片に隣接して針を移動します。ウィットHと同じ焦点面のガラスと針が、ゆっくりガラス(図6H)に針をRAM。針を注入ボタンを押すと任意の流体終了した場合、針の先端を見てuncloggedされていることをテストします。
- すべての卵母細胞が注入された場合は、手動で顕微鏡のビーム経路の油と向き、それをうち、針を上に移動します。それは眼の損傷を防ぐため、安全な方向にあることを確認します。
注:時間の延長期間は卵室の分離と卵母細胞の注入の間で経過した場合は、卵母細胞がストレスに関連付けられた表現型の変化を注入し、示すことが困難になります。同様の問題は卵母細胞または過剰量の注入(図は6Iを比較して、J、K)の乱暴な取り扱いで発生する可能性があります。
7。イメージング実験デザインを生きる
- リストから最初の注入された卵母細胞を選択します。注射は蛍光イメージング1フレーム(で卵母細胞の中にあったかどうかをテストします図6GのS)。
- 励起波長、放出経路、励起時間は、Z-スタックとコレクション間の時間を含む:実験的なパラメータを設定します。注:この方法の詳細については、パートンR.らを参照してください。 (2010年)2。
- データセットを収集します。
8。代表的な結果
in vitroで合成されたアレクサ-546 GRK RNAはMe31B :: GFP卵室(図7A)に注入した。 RNAは卵母細胞の背側前方に局在し、核の周りにキャップ(図7B)を形成する。 RNAの局在化の例についてはマクドゥーガルN.らを参照してください。 (2003)11。
蛍光標識タンパク質(タウ-GFP、図7C)またはRNAタギングシステム(GRK * mCherry、図7D)を発現半ばおよび後期段階の卵母細胞を注入することなく撮像することができます。

図1。

図2。
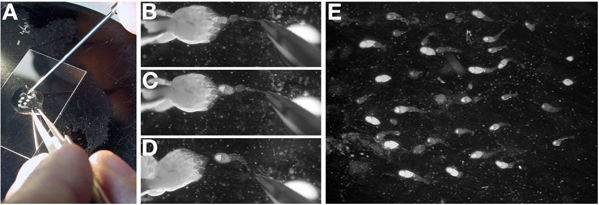
図3。
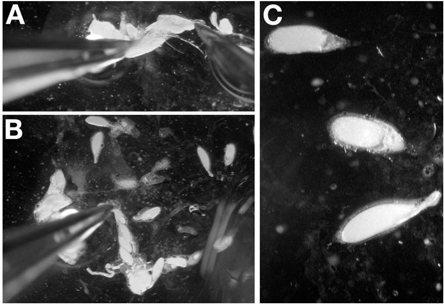
図4。

図5。
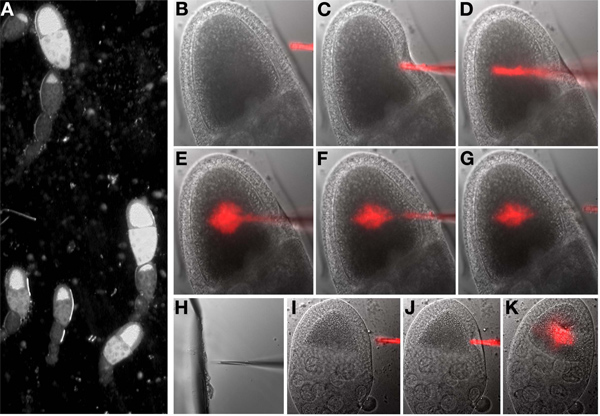
図6。
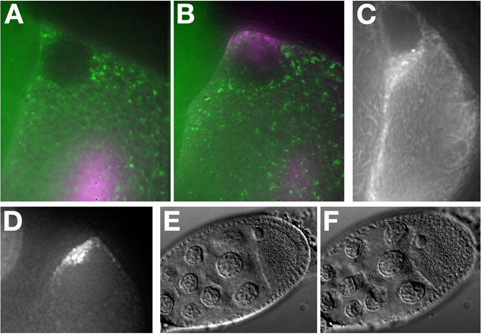
図7。
ディスカッション
ライブセルイメージングは、リアルタイムで細胞プロセスを調べるための強力なアッセイである。単純な明視野観察に加えて、興味のあるタンパク質とRNAの蛍光標識の添加は、多くのブレークスルーをリードしている。ここでは、遺伝的および生化学的アッセイと組み合わせて利用することができる画像個々の生きている卵母細胞のプロトコルを概説しています。
このプロトコルでは、我々はまた、実験的に注射することによって生きている卵母細胞を操作する方法について説明します。アッセイに直接RNAの局在化(ボールとデイビス、未発表)および蛋白質6の機能を阻害する抗体に二次構造の能力を蛍光標識したRNAを合成し、in vitroでを含む材料を注入するための多くの可能性があります。今後はおそらく他の標識成分との分子メカニズムをテストすることが可能になり生きている卵母細胞への細胞機械の導入が表示されます。
t "は>生きている細胞で作業する場合、組織の生存と健康が不可欠です。保存このプロトコルでは、我々は卵室のストレスにつながることができますステップの数を指摘している。たとえば、オイルがイメージングのための優れているにもかかわらず、油の拡張文化が卵室にストレスにつながることができます。これは簡単に核の形態と位置を調べることによって、明るい界曝露下で監視することができ、ストレスの下で歪曲水疱ます。卵母細胞膜は、(Figure7Fに(ストレスのない)図7Eの比較( ))を強調した。ステージ9卵室は、複数の時間にわたってRNAの局在化と境界細胞の移動12を示しています。ただし、ステージ7月8日卵室が卵巣の約40分から削除された後のハロカーボンオイルに悪影響を示すことが開始されます女性の後期段階の卵室、ステージ11から14は、ため、これらのステージ13で卵胞細胞から卵の殻の分泌油または水性媒体のいずれかで正常に開発することができます。これはレポされている水性昆虫培地にインスリンの添加は、最大で6時間14 germariaまでの14時間〜15のためにステージ9卵母細胞を維持することができますrted。それは卵母細胞を強調し、その可能性を低減し、すべてのケースでは、卵室の積極的な操縦は、避けるべきである。イメージング卵室が少ないと治療に注意しながらそれぞれが穏やかに最適な可能性を確保するための最良の方法です。開示事項
我々は、開示することは何もありません。
謝辞
この作品は、I.デービスにウェルカムトラストシニア·リサーチ·フェローシップによってサポートされていました。
資料
解剖に使用されるツールは、きれいになる必要がありますが、オートクレーブ滅菌する必要はありません。 EtOHでツールを拭いて、それらを開始する前に乾燥させます。
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ファイン先端ペイントブラシ (アーティストセーブル、ラウンド、サイズ00または0) | ほとんどの画材店から入手 | 質の良いブラシが重要である | |
| ハロカーボン製品株式会社は、シリーズ95 | ハロカーボン製品株式会社は、887 Kinderkamack道路、河川エッジNJ 07661 | ヨーロッパの代理店: Solvadis(社) 油を介して空気をバブリングすることにより酸素を送り込むにしてください。 | |
| スリップカバーなし。 50ミリメートル1.5、22× | 国際No1の-VWR猫= 631から0137-22〜50ミリメートル | メンツェル·グレイザー-22-40mmでMNJ 400-070T | |
| デュモン5番 - Dumostar | ファイン科学ツール | 11253から20 | "Biologie"チップも良いですが、より多くの脆弱な |
| 解剖プローブ | ファイン科学ツール | 10140から01 | |
| 解剖顕微鏡 | オリンポス | SZ61 | |
| CO2パッド | を通じて利用可能 http://www.flystuff.com / (ジェネシー·サイエンティフィック社の一部門) | 59から114 (789060 Dutscher) | ヨーロッパの代理店: Dutscher WWW。dutscherscientific。com / それはあなた自身のフライパッドをカスタムを構築することも比較的容易である |
| KimCare | KimberyクラークKimCare - 医療ワイプ | KLEW3020 | |
| 顕微鏡-DeltaVision | アプライドプレシジョン | DC-CORE | |
| マニピュレーター | バーレイマイクロマニピュレーター ルーメンダイナミクスグループ株式会社から。 2260 Argentiaロード、ミシソーガ、オンタリオ州、L5N 6H7カナダ | バーレイPCS-5000シリーズ、TS-5000から300 | http://www.ldgi-burleigh.com /(旧EXFO) |
| 噴射装置 | Tritechリサーチ株式会社 2961ベテランアベニュー ロサンゼルス、CA 90064 | MINJ-1 | エッペンドルフFemptotipsを取るホルダーを使用して変更 |
| 注射針 | エッペンドルフ滅菌Femtotips IおよびII | 930000043 | 別のヒントが別のアプリケーション用に優れている |
| ヒント20μLをロードする | エッペンドルフ | 5242956.003 | |
| 乾燥したアクティブな酵母 | フライシュマンの酵母 | #2192 |
参考文献
- Arias, A. M. Drosophila melanogaster and the development of biology in the 20th century. Methods Mol. Biol. 420, 1-25 (2008).
- Parton, R. M., Valles, A. -. M., Dobbie, I. D., Davis, I., Goldman, R. D., Swedlow, J. R., Spector, D. L. Pushing the Limits of Live Cell Imaging in Drosophila. Live Cell Imaging: A Laboratory. , 387-418 (2010).
- Johnston, D. Moving messages: the intracellular localization of mRNAs. Nat. Rev. Mol. Cell Biol. 6 (5), 363-375 (2005).
- Jansen, R. mRNA Localization: Message on the Move. Nat. Rev. Mol. Cell Biol. 2, 247-256 (2001).
- Van De Bor, V., Hartswood, E., Jones, C., Finnegan, D., Davis, I. gurken and the I factor retrotransposon RNAs share common localization signals and machinery. Dev. Cell. 9 (1), 51-62 (2005).
- Delanoue, R., Herpers, B., Soetaert, J., Davis, I., Rabouille, C. Drosophila Squid/hnRNP helps Dynein switch from a gurken mRNA transport motor to an ultrastructural static anchor in sponge bodies. Dev. Cell. 13 (4), 523-538 (2007).
- Jaramillo, A. M., Weil, T. T., Goodhouse, J., Gavis, E. R., Schupbach, T. The dynamics of fluorescently labeled endogenous gurken mRNA in Drosophila. J. Cell. Sci. 121 (Pt. 6), 887-894 (2008).
- Forrest, K. M., Gavis, E. R. Live imaging of endogenous mRNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159-1168 (2003).
- Bertrand, E. Localization of ASH1 mRNA particles in living yeast. Mol. Cell. 2 (4), 437-445 (1998).
- Spradling, A. C., Bate, M., Martinez-Arias, A. Developmental genetics of oogenesis. The Development of Drosophila melanogaster. 1, 1-70 (1993).
- MacDougall, N., Clark, A., MacDougall, E., Davis, I. Drosophila gurken (TGFalpha) mRNA localizes as particles that move within the oocyte in two dynein-dependent steps. Dev. Cell. 4 (3), 307-319 (2003).
- Tekotte, H., Tollervey, D., Davis, I. Imaging the migrating border cell cluster in living Drosophila egg chambers. Dev. Dyn. 236 (10), 2818-2824 (2007).
- Weil, T. T., Parton, R., Davis, I., Gavis, E. R. Changes in bicoid mRNA anchoring highlight conserved mechanisms during the oocyte-to-embryo transition. Curr. Biol. 18, 1055-1061 (2008).
- Prasad, M., Jang, A. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nat. Protoc. 2 (10), 2467-2473 (2007).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved