Method Article
同位体タグ質量分析法を用いたチオールレドックスプロテオームのプロファイリング
要約
細胞がストレス状況に遭遇すると活性酸素種のレベルが上昇している。ここでは、3'-3 'ジアミノベンジジン染色などcysTMTラベリングとの酸化還元プロテオームのプロファイリングを行うための質量分析の例を示します Pseudomonas syringaeのトマトの葉を処理した。
要約
Pseudomonas syringaeの PV。 トマトひずみ DC3000は、 シロイヌナズナ 、遺伝的に扱いやすい宿主植物1,2にトマトでなく、 アブラナ属の種の細菌斑点病を引き起こすだけでなく、だけではなく。 DC3000を接種した子葉における活性酸素種(ROS)の蓄積は、トマト3の細菌性斑点病の間に調節する壊死性細胞死におけるROSの役割を示しています。過酸化水素、ROSのコンポーネントは、 シュードモナス 3トマトの接種後に生成されています。過酸化水素は、組織化学的染色3'-3 'ジアミノベンジジン(DAB)4を使用して検出することができます。 DAB染色は、葉組織4茶色の汚れを生成する過酸化水素と反応します。 ROSは、5特定のタンパク質の酸化還元状態を変更することができます細胞のレドックス環境の調節の役割を持っています。システインに依存する重要なアミノ酸です。酸化還元変化します。軽度の酸化の下で、システインのスルフヒドリル基の可逆的酸化は生理的プロセス6,7の様々な規制レドックスセンサーとシグナルトランスデューサーとして機能します。タンデム質量タグ(TMT)の試薬 は同時識別を有効にして、タンデム質量分析法8,9を使用してさまざまな試料中のタンパク質の定量を多重化。システイン反応TMT(cysTMT)試薬は選択的標識と6の生物学的サンプルまでのペプチドをシステイン含有の相対定量を可能にします。各重体cysTMTタグは、同じ公称親の質量を持ち、スルフヒドリル反応性基は、MS-ニュートラルスペーサーアームとMS / MSレポーター10で構成されています。標識後、試料をプロテアーゼ消化を受けた。システイン標識ペプチドは、抗TMT抗体を含有する樹脂を用いて濃縮した。 MS / MS分析時に、レポーターイオンの系列(すなわち、126から131 DA)は相対定量に関する情報を提供し、低質量領域に出現する。ワークフローは、サンプルの複雑さを軽減するダイナミックレンジを向上させ、システイン修飾を研究するための効果的である。ここでは 、PST DC3000扱わトマトのレドックスプロテオーム解析を提示し(リオグランデ)cysTMT技術を使用して残します。このハイスループット法は、他の酸化還元調節の生理学的プロセスを学ぶに適用される可能性を秘めています。
プロトコル
1。成長実生と準備細菌
- 苗は成長チャンバー(22℃8時間の光の光周期160マイクロモル光子m -2 s -1でのMetroMix 500土壌の混合物(BWI会社)で発芽さ20ダーク°C、16時間℃で1週間。相対湿度が70%に設定されていました。ドライになってから土を保つために、必要に応じて苗木を水道水で水をまかれた。
- 類似した大きさの二つの苗は、その後MetroMix 500土壌を含む4 "径ポットに移植し、1.1と同じ条件で追加の3週間栽培されています。
- Pseudomonas syringaeの(PST)は、キングスB培地(KBM)プレート(1リットル当たり:20グラムプロテオースペプトン、0.1975グラムのMgSO 4、1%グリセロール、1.5グラム、K 2 HPO 4、18グラム寒天培地)に最初にT-縞であるために栽培28で2日間℃、シングルコロニーを300μL液体キングスB培地(20グラムプロテオースペプトン、0.1975グラムのMgSO 4に混合し、収集されを、10 mLのグリセロール、100倍、K 2 HPO 4株式の10 mLの(H 2 O 10mLのK 2 HPO 4 1.5 g)、およびキングスBミディアムプレート上に広げる。これは、28℃で一晩培養し、
- 細菌接種物を20mLのH 2 OにKBMプレートから培養した細菌をこすることによって調製される0.03(〜10 6 CFU / ml)のOD 600を接種緩衝液1 L(10mMのMgCl 2 + 400μLSilwett-70)で調製されています。接種バッファマイナス細菌は、コントロール·ソリューションのために準備された。
2。 PSTファイルとH 2 O 2とトマトの接種組織化学的染色
- 四週齢の植物が30秒、上記の接種液に浸漬することにより接種した。透明なビニール袋は、すぐに接種した後に植物の上に置かれた。
- 3'-3 'ジアミノベンジジン(DAB)は11(H 2 Oで1 mg / mlのDABは、pH 3.8(塩酸))3つのDを作製した染色AYSは、前の完全な可溶化を達成するために使用します。溶液を室温で混合するために揺り動かした。
- 二十四時間処理した後、完全に展開された葉は表皮面を上にして染色するDABに配置され、除去し、真空で15分間浸透させた。葉はその後、染色のために一晩、室温で暗所に入れられました。
- 葉は10分間95%エタノール中で煮沸し、次に75%エタノールに格納されていました。
3。タンパク質抽出
- 収穫した後、トマトの葉を乳鉢と乳棒を用いて液体窒素で微粉末に粉砕した。
- 組織0.5 gの場合、フェノール1.25 mLのトリスpH 8.8緩衝追加し、抽出緩衝液の1.25 / mLの0.5グラム(0.1 MのTris-HCl pHは8.8、10mMのEDTA、0.9 Mショ糖)は、その後にさらにいくつかの分間研削続けるヒュームフード。
- オークリッジ遠心チューブ(サーモフィッシャーサイエンティフィックナルゲン社)に抽出液を移し、室温で2時間振とうする。
- 5000×gで遠心分離と15℃で10分間。新しいきれいなチューブにトップフェノール相を転送します。
- 等量で逆抽出水相は、フェノールのバッファを抽出し、30分間シェーカーで撹拌します。新しいファルコンチューブに抽出液を遠心分離し、転送します。
- 上記のステップ1つのより多くの時間を繰り返して、新しいオークリッジチューブに抽出液を転送します。
- 100%メタノール(-20℃で保存)の0.1 M酢酸アンモニウム5ボリュームを追加することにより、フェノール抽出したタンパク質を沈殿させる。一晩-20℃でボルテックスし、インキュベートします。
- 20分、20,000×gで4℃で遠心分離によってタンパク質ペレットを収集します。
- 80パーセント冷アセトンとメタノールと2回の冷0.1M酢酸アンモニウムでペレットを2回洗浄します。ペレットに1.5 mLの冷70%エタノールを加えると一時停止します。 20分を2 mlのマイクロ遠心チューブ(米国サイエンティフィック)、14,000 rpmで遠心分離し、4°Cに転送されます。エタノールを除去します。
- SpeedVacコンセントレータでペレットを軽く乾燥させ、タンパク質のEXTRに溶解アクションバッファ例えば、ReadyPrepタンパク質抽出キット試薬3(8 M尿素、4%CHAPS、40mMのトリス塩基、2 Mチオ尿素)(Bio-Rad社)。ペレットを形成するために、30分間14,000 rpmで、20°Cで遠心します。上清を収集します。
- 製造元のマニュアル(ジェノ技術)によるCB-Xタンパク質アッセイを用いてタンパク質濃度を測定します。
4。 cysTMTsとサンプル調製およびペプチドのラベリング
- 2から5μg/μLの濃度でタンパク質試料を準備します。ここでは、それぞれの質量タグの20μlを、50μLのサンプルをタンパク質100μgを使用しています。この実験では全6タグが使用されました。
- 遊離のチオール基をブロックするタンパク質試料にアルキル化、等量のバッファー(100mMのトリス-HCl pH7.5、200mMのヨードアセトアミド)を追加します。バッファは、新鮮な準備する必要があります。アルキル化は、37℃で1時間で実行されます。
- 一晩-20℃で冷80%アセトン1 mLを加えることによってタンパク質を沈殿させる。 14,000遠心分離によってペレットのタンパク質回転、4℃で20分間。たびにボルテックスを80%アセトンでペレットを3回洗浄します。上清を除去し、氷の上で乾燥した中を放送することができます。
- 50μLの溶解バッファー(6M尿素、50mMのトリス塩基、1mM EDTA)にペレットを再懸濁します。 100mMのトリス(2 - カルボキシエチル)ホスフィン(TCEP)の0.5μL、その後室温で1時間インキュベートすることによりジスルフィド結合を還元するために追加されます。
- タグを可溶化する試薬チューブにアセトニトリル20μLを加えることによってタグを準備します。渦と底にスピンダウンする。
- マイクロコン3KD遠心フィルター装置(Millipore)を用いて余分なTCEPをよく洗ってください。マイクロコン3KD列に50μLのサンプルを追加し、列に50μLの溶解バッファー。 10,000×gで、4℃で15分間遠心合計3回のためにこの手順を繰り返します。列を除去してクリーンなチューブに反転させる。 1,000×gで、4℃で5分間遠心
- pHをチェックしてください。必要に応じて、1 M HClで7.0から8.0にpHを調整します。
- cysTMの5μLを追加します。各サンプルにT試薬(cysTMT試薬キットは、最大500μgのタンパク質を20μLタグを提供しています。このメソッドは、100μgのタンパク質を使用して、したがって、我々は、タグの五分の一使用)。反応は室温で2時間撹拌を続行することができます。
- サンプルは、1:1の比率でLaemmliサンプル緩衝液(Bio-Rad社)と組み合わせました。
5。非反応タグサンプルの分画の除去
- サンプルは、5分間煮沸し、プレキャスト12%ポリアクリルアミドゲル(Bio-Rad社)上で分離した。ゲルを濾過し、H 2 Oで5分間隔で3回リンスし、1時間クーマシーブルー(Bio-Rad社)で染色した。ゲルは、H 2 Oで一晩脱染色した
- 十二画分を各ゲルのレーンから採取した。画分は、タンパク質のバンドの濃度によって決定された。画分は、1mmの切り刻まと1.5 mlチューブに回収した。
- ゲル片を脱染色したH 2が50%アセトニトリル、0.1 M重炭酸アンモニウムを使用していた O.青色がゲル片(3〜4回、各15分の時間)から削除されるまで、この手順を繰り返す必要があります。
- 脱染色したゲル片を15分間100%アセトニトリル(ゲル片をカバー)を使用して乾燥させ、上清を除去し、作品はSpeedVacを使用して乾燥させた。
- 25mMの重炭酸アンモニウム、同体積の比(としてプールされたラベルのサンプル):1:10(タンパク質トリプシン)でトリプシン(Promega)を溶解する。たとえば、500μLの容積600μgのタンパク質サンプルを25 mM重炭酸アンモニウムの500μLに溶解した60μgのトリプシンを必要とします。
- ゲル片をトリプシン溶液を追加し、再水和するため氷の上で設定します。の部分がカバーされていない場合は、50 mM重炭酸アンモニウムバッファを追加します。水分補給した後、12〜16時間37℃でインキュベートする。
- 培養サンプルから液体のタンパク質抽出物を削除します。
- 反応を停止し、5%ギ酸、50%アセトニトリルでゲル片を被覆することにより、残りのタンパク質消化物を除去...部屋TEで20分間ゲル片を振るmperature。 5.7から抽出したタンパク質サンプルチューブに上清を移します。二回の抽出手順を繰り返します。 SpeedVacを使用して抽出したペプチドを乾燥させます。
6。 cysTMT標識ペプチドのサンプル濃縮
- 50%スラリーで0.5 mLチューブに抗TMT樹脂のグラデーションを追加します。 (勾配が分別ゲルのバンドの濃度から決定した。フラクションコレクションは暗いバンドで構成されている場合、より多くの樹脂が必要となります。少ないタンパク質があるとしても弱いバンドを有する画分が少ない樹脂を必要とします。)
- 次いで、樹脂を1Xトリス緩衝生理食塩水(TBS)(25 mMトリス、0.15MのNaCl、pH 7.2)(サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品)の1列のボリュームで3回洗浄されています。
- 各サンプルに200μL1xTBSを追加します。次いで、試料を抗TMT樹脂(サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品)に加え、4℃で一晩ロッキング続いて2時間室温で攪拌されている
- カラムにサンプルを追加(RMOサイエンティフィックピアスタンパク質構造·機能研究製品)。
- 1×200μLのTBSで各列に3回洗浄します。そして、これは0.05%CHAPS(1X TBSに溶解)で3回洗浄して続いています。
- 次いで、カラムを1×TBSで4 M尿素で3回洗浄されています。 H 2 Oの二百マイクロリットルをカラム3回洗浄するために使用されます。
- 各サンプルを200μLの50%溶出バッファー(50%アセトニトリル、0.4%TFA)で3回溶出される。
- 次いで、試料を真空コンセントレータで乾燥させる。
7。質量分析
- 0.1%ギ酸を3%アセトニトリル、12μLのサンプルを再懸濁し、EksigentナノLC-1D高圧液体クロマトグラフィーカラム(AB SCIEX、米国)に直接5μLを注入します。
- ペプチドはProteopep II C18カラム内径75μmで分離される4から60パーセントの勾配を(使用して、×20センチ(新しい目的、アメリカ):3%アセトニトリル、0.1%ギ酸、B:97%アセトニトリル、0.1%ギ酸酸)60分以上で3μL/分。
- サーモ科学LTQ Orbitrap XL質量分析計は、トップ2を使用してペプチドを検出するために使用した単段で構成された×3実験MS 3、MSに続いて高エネルギーC-トラップ解離(HCD)の断片化で3 MS / MSスペクトルの取得に続いてタンパク質同定のための衝突誘起解離(CID)と/ MS。このモードのパラメータは次のとおりだった:分離幅:3.0 m / zの、コリジョンエネルギー:50%(2つのステップを含む10%)。唯一の二重と三重に帯電したペプチドは、断片化のために選ばれた。動的な除外パラメータがに設定されていました:カウント= 1を繰り返します。繰り返し時間= 60;除外リストのサイズ= 500;除外期間= 28。目標値は次のとおりです。MS = 5 E 5; MS / MS(HCD)= 1 E 5。イオンの転送時間は、MS / MS(HCD)のFTMS、300は500に設定されています。二microscansはHCDスペクトルに必要であった。
8。データベース検索と定量
- 取得したCIDとHCDのデータがあった比を定量化するためにレポーターイオン量子化(フラグメントイオンの20 ppmの質量公差)を実装し分岐したワークフローを介してサーモ科学プロテオームDiscovererのソフトウェア1.2(サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品)を使用してnalyzed。独立したセグメントは、スペクトラムセレクタ、スペクトラムノーマ、およびスペクトラムGrouperのノードを介してMS 2スペクトルを処理しました。
- その後、データはSEQUESTの検索エンジンに対して検索した。 20 ppmの質量公差が使用されています。静的な変更がcysTMT試薬に設定され(304.18 Da)と動的な変更は、リン酸化およびメチオニン酸化(15.99 Da)を含まれていました。 トマトのカスタムデータベースは、13両方のケースで使用した(ハーバード大学から約35万のエントリを持つ)RNAデータを使用して構成されていた。
9。代表的な結果
コントロールトマト植物の葉および Pseudomonas接種葉の代表的なイメージがある図1に示す。処理されたコントロールおよびシュードモナス処理葉の間に差が観察される。葉を除去し、脱染色プロセスは葉組織内ROSの兆し( 図2)を表示するために組織化学的染色を可能にします。DABを用いて染色された後、 図2Aは無染色のコントロールの葉の代表である。 図2Bは、代表的であるH 2 O 2生産のためのシュードモナスおよび陽性で処理された葉の。差レドックス調節タンパク質のプロテオームディスカバー·データ出力の例を図3に示されています。このタンパク質は、既知のレドックス調節タンパク質のフェレドキシン-1 14であるとPseudomonas syringaeの PV トマト 15に対する防御に重要な役割を果たすことが示されている。コントロールと接種し、サンプル間のピーク強度はferredoxで有意に変化した相対的な定量化を、取得するために使用されin-1のレドックス制御(P <0.05)。高強度のピークがこのタンパク質は、病原体の治療に反応して酸化されることを示唆している。 図4は、制御と接種したサンプル間のタンパク質の類似したレドックス制御を有するタンパク質のプロテオームディスカバー·データ出力の例です。同様の強度のピークは、治療の変更によって規制されていないのジスルフィド結合の存在を示唆している。方法は、科学者たちは酸化還元反応するシステインとジスルフィド10を検出する方法を変革します。

図1。接種したトマトの代表的なイメージは、コントロール溶液(A)、 シュードモナス (B)の葉。

図2:接種したトマトのDAB染色の代表的なイメージは、コントロール溶液(A)、 シュードモナス (B)の葉。葉は3'-3 'ジアミノベンジジンを用いて染色した。クロロフィルは、95%エタノール中で煮沸して葉から削除されました。暗い染色はH 2 O 2の存在を示しています。唯一の暗い染色を示した細菌の培養を接種したままになります。
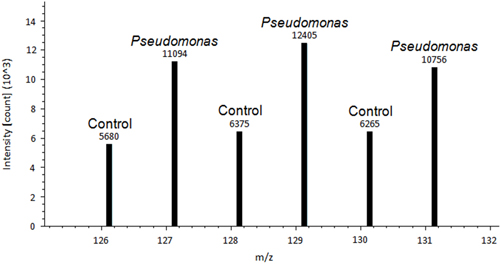
図3フェレドキシン-1のプロテオームディスカバー·データ出力、差動レドックス調節蛋白質14の例を示します。各ピークの上記のピーク強度は絶対的な定量化のために使用されています。コントロールと接種し、サンプル間のピーク強度が使用されます相対的な定量化を実行することができます。

図4コントロールと接種した試料との間の類似したピーク強度を有するタンパク質のプロテオームディスカバー·データの出力例を示します。同様の強度のピークは、治療の変更によって規制されていないのジスルフィド結合の存在を示唆している。
ディスカッション
このプロトコルは、DAB染色を行うことについての情報などcysTMTラベルレドックスシステインの定量化を提供します。これらの手順は、ROSの産生だけでなく、 トマトがPseudomonas syringaeのを接種された蛋白質の調節に及ぼす影響を検討する上で有益である。このプロトコルで提示方法は、葉組織への損傷の最低額を引き起こすように全体の葉のサンプルでROSを検証する方法を提供します。ラベリングの手順では、システイン標識法を利用することにより、潜在的にレドックス調節タンパク質を調べる方法を提供します。ストレス応答の初期段階を調べるときに、これは有益です。
このような同位体コード化された親和性タグ(ICAT)とcysTMTなどのメソッドは、生物学的サンプル中に潜在的な酸化還元の安定化タンパク質を調べることで使用することができます。 ICATは、標識2つのサンプル12を比較することができます。どちらの方法で遊離のシステインにラベルを付けquantificタンパク質を使用することができますation 10,12。しかし、cysTMT方法は、実験的な変動の減少と同様に10を多重化することができます。利用可能なタグの数は、研究者が実験的なデザインで複製または複数のサンプルを含めることができます。より多くのサンプルを持つことは、同定されたタンパク質の数の増加の可能性を提供します。 cysTMT技術の主な欠点は、それが原因cysTMTラベルペプチド(6.5から6.6)の選択的濃縮工程のタンパク質同定の全体的な品質を損なうことである。タンパク質同定のためのペプチドの数は、タンパク質配列中のシステイン残基の数に大きく依存します。この問題は、質量分析、タンパク質の同定のために濃縮する前に、トリプシンのサンプルの一部を提出することによって克服することができます。
実験的なデザインだけでなく、cysTMT方法が利用するラベリングメカニズムの性質上、特定の手順が重要です。タンパク質PRECIを実行している間pitationとペレット洗浄液(3.9)は、タンパク質の分解を低減するために氷上で冷却した試料を保持することが重要です。サンプルは逆ラベリングを受ける可能性があるためcysTMTラベリング時には、還元剤(4.6)の除去が重要である。試薬を減らすことでサンプルのままであれば逆にラベリングが可能です。サンプルはラベルの後に減少している場合は、cysTMTタグを削除することができます。ラベルはサンプルに追加されると、pHレベルを最適な標識効率を持つために(4.7)をチェックする必要があります。さらに、データ解析は、研究者とプロトコルを使用しての究極の目標に必要とされているものに依存しています。また、各ソフトウェアは、異なるアルゴリズムを持っているとして使用されているソフトウェアに依存しています。
この実験は、トマトの反応性酸化種の強化された生産のためのエリシターとして病原体を利用しますが、他の酸化還元反応の規制はそれに応じて測定することができる。この実験的なデザインは、他の植物や動物のシステムに適応可能です。
開示事項
利害の衝突が宣言されません。
謝辞
著者らは、DC3000株、トマトの種子、およびアドバイスを提供するために博士はグレッグ·マーティン(コーネル大学)と彼のグループに感謝します。彼らはまた、博士ZhonglinはDABプロトコルとメソッド開発の支援のためのバイオテクノロジー研究のためのUF学際センターでプロテオミクス部門のヘルプは覚書に感謝したいと思います。タンパク質抽出のためのプロトコルはHurkman田中16から変更されました。 cysTMTのラベル上のプロトコルは、手順4から6は、マニュアル17オリジナルのサーモフィッシャーサイエンティフィックピアスの製品に基づいて適応されました。この作品は、国立科学財団(SチェンにMCB 0818051)によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| MetroMix 500 | BWI会社 | TX-500 | |
| 3,3 ' - ジアミノベンジジン | Sigma-Aldrich社 | D8001 | |
| ReadyPrep逐次抽出キットの試薬3 | バイオ·ラッド | 163-2104 | |
| CB-Xタンパク質アッセイ | ジェノテクノロジー | 786-12X | |
| cysTMT試薬 | サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品 | 90071 | |
| Laemmliサンプルバッファー | バイオ·ラッド | 161-0737 | |
| バイオセーフComassie(G-250染色) | バイオ·ラッド | 161-0786 | |
| マイコン3KD列 | ミリポア | 42403 | |
| 固定化したアンチTMT樹脂 | サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品 | 90076 | |
| 遠心カラム | サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品 | 89896 | |
| Proteopep II C18カラム | 新たな目的 | PFC7515-PP2-10 | |
| ナノLC-1D HPLC | AB SCIEX | 90389 | |
| LTQ Orbitrap XL | サーモフィッシャーサイエンティフィック | 0020137580 | |
| SpeedVac | Labconco | 7812013 | |
| プロテオームDiscovererの1.2ソフトウェア | サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品 | ||
| トリプシン | プロメガ | V5111 | |
| オークリッジ遠心管 | サーモフィッシャーサイエンティフィックNalgeNE会社 | 3139-0050 | |
| マイクロ遠心チューブ(2ミリリットル) | 米国サイエンティフィック | 1620-2700 | |
| 12パーセントミニプロティアンTGXプレキャストゲル | バイオ·ラッド | 456-1043 | |
| フォームのトップ フォームの>バイオセーフクマStainBottom | バイオ·ラッド | 161-0786 | |
| TMT濃縮キット | サーモフィッシャーサイエンティフィックピアスタンパク質構造·機能研究製品 | 90077 |
参考文献
- Almeida, N. F. A draft genome sequence of Pseudomonas syringae pv. tomato T1 reveals a type III effector repertoire significantly divergent from that of Pseudomonas syringae pv. tomato DC3000. Mol. Plant Microbe Interact. 22, 52-62 (2009).
- Preiter, K. Novel virulence gene of Pseudomonas syringae pv. tomato strain DC3000. J. Bacteriol. 187, 7805-7814 (2005).
- Apostol, I., Heinstein, P. F., Low, P. S. Rapid stimulation of an oxidative burst during elicitation of cultured plant cells: role in defense and signal transduction. Plant Physiol. 90, 109-116 (1989).
- Orozco-Cardenas, M., Ryan, C. A. Hydrogen peroxide is generated systemically in plant leaves by wounding and systemin via the octadecanoid pathway. Proc. Natl. Acad. Sci. U.S.A. 96, 6553-6557 (1999).
- Tonks, N. K. Redox redux: revisiting PTPs and the control of cell signaling. Cell. 121, 667-670 (2005).
- Alvarez, S., Wilson, G. H., Chen, S. Determination of in vivo disulfide-bonded proteins in Arabidopsis. J. Chromatogr. B. 877, 101-104 (2009).
- Apel, K., Hirt, H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu. Rev. Plant Biol. 55, 373-399 (2004).
- Dayon, L. Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6- plex isobaric tags. Anal. Chem. 80, 2921-2931 (2008).
- Thompson, A. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Anal. Chem. 75, 1895-1904 (2003).
- Rosenblatt, M. A novel cysteine-reactive tandem mass tag reagent for subproteome labeling, enrichment and quantitation. , TP169 (2010).
- Clark, J. Phenotypic analysis of Arabidopsis mutants: diaminobenzidine stain for hydrogen peroxide. Cold Spring Harb. Protoc. , (2009).
- Sethuraman, M. Isotope-Coded affinity tag (ICAT) approach to redox proteomics: identification and quantification of oxidant-sensitive cysteine thiols in complex protein mixtures. J. Proteome Res. 3, 1228-1233 (2004).
- Asso, M. EPR and redox characterization of ferredoxins I and II from Desulfovibrio vulgaris Miyazaki. Biochem. Biophys. Res. Commun. 211, 198-204 (1995).
- Huang, H. e. Disease resistance to bacterial pathogens affected by the amount of ferredoxin-I proteins in plants. Mol. Plant Pathol. 8, 129-137 (2007).
- Hurkman, W., Tanaka, C. Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis. Plant Physiol. 81, 802-806 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved