このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アレルゲン誘発性喘息のマウスモデル
要約
アレルギー性喘息の実験モデルマウスは、疾患の病因を研究し、新しい治療法を開発するための新たな可能性を提供します。これらのモデルはよくアレルギー性免疫応答、気道炎症、肺病態生理を支配する因子を測定するのに適しています。
要約
喘息は世界中で約300万人に影響を与え、罹患率および死亡率の主要な原因である。米国の人口の1以上の8%が罹患率が増加すると、喘息を持っています。2を大幅に促進する他の疾患、アレルギー性気道疾患の動物モデルと同様に基本的な病態の理解は、潜在的な治療標的を特定するのに役立ち、可能な新しい治療法の前臨床試験を許可します。アレルギー性気道疾患のモデルは、いくつかの動物種で開発されたが、マウスモデルは、低コスト、準備ができて可用性、およびこれらの動物のよく特徴付けられた免疫システムに起因する、特に魅力的である。トランスジェニック系統の様々な3の可用性がさらに魅力を増加されましたここではこれらのモデルの4我々は、アレルギー性気道疾患の2マウスモデル、抗原として用いた卵白アルブミンの両方を説明します。腹腔内注射による初期作、一つのモデル配送は以下の噴霧による抗原チャレンジ、気管内送達による他はERS。これらの2つのモデルは、それぞれが人間の喘息の主要な機能を模倣して、相補的な利点を提供します。5
と好酸球豊富な気道の炎症、急性喘息の主要な機能は、メタコリン(AHR気道過敏性)などの刺激に対する誇張された気道の応答が含まれています。また、これらは私たちのマウスモデルにおけるアレルゲンチャレンジの顕著な効果、5,6であり、私たちはそれらを測定し、従って、実験操作の効果を評価するための手法について説明します。具体的には、気道過敏性を測定するだけでなく、気道や肺に炎症細胞の浸潤を評価するためのメソッドの両方7侵襲的および非侵襲的な8のテクニックを説明します。肺組織病理学は、臓器全体に炎症のマーカーを評価するために使用されている間に気道の炎症性細胞は、気管支肺胞洗浄によって収集されます。これらの技術は人間では不可能な方法で喘息を研究するための強力なツールを提供しています。
プロトコル
I.アレルゲンの感作とチャレンジ( 図1を参照)
気管内チャレンジA.
- 初期作では、卵白アルブミン20μgの(; Sigma-Aldrich社、セントルイス、MO OVA)を0日目にして、再度7日目の雄または雌C57BL / 6またはBALB / cマウス(6-8週齢)腹腔内に注入する2水酸化アルミニウムのミリグラム(Sigma-Aldrich社)またはコントロールとして滅菌PBS 0.2ml中2mgの水酸化アルミニウムとを含む緩衝生理食塩水(PBS)滅菌リン酸0.2 mlで乳化した。
- 適切な抗原とチャレンジ(例えば、日14、16、18、20ページ)。チャレンジ手順は次のとおりです。
- ケタミン(90 mg / kg)及びキシラジン(10 mg / kg)の混合物の腹腔内(ip)注射でマウスを麻酔。マウスは、少なくとも10分間完全に麻酔であることを確認します。
- 45度以上の角度で操作面。この上向きの腹側を保持面と上部の頭の上に置いてマウス。
- フックトン後頭部を保持するために、フロント歯下hread。レベル気管がまっすぐであることを確認して足を保持するためにラベル·テープを使用するには、互いに足。 70パーセントエタノールと綿棒で手術部位を浸す。
- 切開部位に局所的にbupivicaine(0.25%溶液0.1〜0.2ml)を適用します。
- ニップピンセットで喉の皮膚と外側にゆっくり引き出します。外科はさみ、小さな縦切開を行います。切開の大きさを最小限に抑えることができます。
- 50μlのPBSまたはPBSに0.1%のOVAで1 mlの注射器を準備し、繰り返しピペット(Tridakステッパー、トリントン、コネチカット州)に挿入します。片手でピペットを取り、ピンセットで戻って組織を保持し、気管を露出するために他を使用しています。
- できるだけ気管に平行に注射器を保持、気管壁を通して針を挿入して、ソリューションを注入します。
- 肺に解決するソリューションのための時間を確保するために注射を次の垂直方向にマウスを維持します。
- 穏やかに無菌的に創傷部を閉じ縫合とピンセットとシール。
- 場所は、加熱パッド上でマウス胸骨ダウン、それは完全に歩行可能まで回復することができます。回復後、動物のケア施設には、マウスを戻し、傷が完全に治癒するまで血清腫、炎症や感染症、創傷裂開の兆候がないか毎日それを監視することができます。
噴霧によるチャレンジB.
- 水酸化アルミニウムの2ミリグラム(Sigma-Aldrich社)を含む滅菌PBS 0.2 mlに、またはコントロールとして滅菌PBS 0.2ml中2mgの水酸化アルミニウムと乳化OVA20μgの(Sigma-Aldrich)を腹腔内注射により0日目にマウスを感作。
- 上記のように14日目に、腹腔内注射によって感作性を向上させます。
- 21日、22日、23日、24日と25日目に単独で超音波ネブライザー(Buxco研究システム、Wilmi経由で配信噴霧1%OVAまたはPBSに30分間曝露による最初の感作、チャレンジマウスの後にngton、NC)。
- WBPのメインチャンバー内にマウスを置くと、少なくとも10分間プレチスモグラフィチャンバー内でそれらを慣らす。
- 噴霧器のコップを経由して、下記の手順4-6に示すように滅菌PBSまたは単独で滅菌したPBSに0.1%OVAの代わり1ミリリットル。 30分間、霧状に。
- ネブライザーのカップを取り外し、残りのすべてのソリューションを破棄します。
- 噴霧は、噴霧チャンバを使用することによって、同時にすべてのマウスで実行することができます。
II。メサコリンに対する気道過敏性の決定
全身プレチスモグラフィーで気道過敏性のA.非侵襲計測(WBP、Buxco研究システム、ウィルミントン、ノースカロライナ州)
- 粉末メタコリンボトルが開く前に室温まで昇温することができます(メタコリンは非常に吸湿性であり、水を吸収するために許可されている場合は無駄な塊を形成します。)滅菌したPBSで200 mg / mlのストック溶液を調製し、シリアル2倍希釈(例えば、100、50、25、12.5、6作る0.25 mg / ml)を。ソリューションは、冷やしておく。
- 次のように機器を設定します。タイトフィットゴムチューブを用いたガスをトラップするネブライザー、エアーポンプへのバイアス流入口、およびWBPコンセントにWBPの主な入口を接続します。 WBPのメインと基準チャンバーの出口を埋めるために圧力変換器を取り付けます。付属のケーブルとプリアンプに圧力トランスデューサーを接続し、特定のデータ·アクイジション·カードを使用してPCにプリアンプを接続します。
- メーカーの推奨に従って、ソフトウェアを使用して、プリアンプのキャリブレーションを行います。
- WBPの主室に配置したマウスは、少なくとも10分間プレチスモグラフィチャンバー内でそれらを慣らすし、3分間のベースライン測定値(Penhbase)を記録。
- ネブライザーカップで滅菌したPBSの代わりに1ミリリットル。 2分間霧状にし、乾燥段階でさらに6分間の呼吸変数を監視することができます。ネブライザーのカップを取り外し、残りのPBSを捨ててください。
- ネブライザーカップとrの6.25 mg / mlのメタコリンの代わりに1ミリリットル2分を加えた6分間の監視サイクルのEPEATの噴霧。
- 同じ2分の噴霧時間と6分間監視サイクルを使用して、12.5、25、50および100 mg / mlのメタコリンで測定を繰り返します。
- チャンバーからマウスを削除し、それらのケージに戻す。
- 1ミリリットル滅菌PBSで補充ネブライザーカップとチューブをフラッシュするために別のシーケンスを実行します。
- 、空気の流れをシャットダウンして分解し、動物の2番目のセットを実行する前に、すべてのチャンバを拭いてください。
コンピュータ制御された人工呼吸による気道反応性B.侵襲計測(flexiVent。SCIREQ社、モントリオール、カナダ)
- マウスの重さと体重ペントバルビタールナトリウム60 mgの腹腔内(ip)注射により麻酔。
- 気管切開のための腹·背マウス十分な麻酔、位置を次に示します。
- 70%エタノールで首の皮膚を消毒する。 iに局所bupivicaine(0.25%溶液0.1〜0.2ml)を適用するncisionサイト。首の皮膚を切開して開きます。首の筋肉を分離し、気管を公開します。
- 細かいハサミで気管に2mmの切開(気管を切断しないように特定のある)にと慎重に気管チューブを挿入して - 1を作成します。空気漏れを防ぐために、気管の周囲に縫合糸を結ぶ。
- 体プレチスモグラフチャンバ内にマウスを置き、人工呼吸器に挿入し気管チューブを接続します。
- 機械的人工換気を開始します。適切な呼吸率と潮汐/ストロークボリューム(150ストローク/分および200μlの、それぞれ20 gのマウス用)を設定します。胸部は人工呼吸器と同期して動いていることを確認してください。マウスが人工呼吸器(自己呼吸)と "戦い"されている場合は、より多くの麻酔薬を注入し、同期を待ちます。
- ベースラインの測定に続いて、別の3分間のベースラインの換気下にマウスを維持し、インピーダンス測定値のセット2回目になります 。ベースライン測定値のセットは、この2回目は、calcのために使用されますベースライン時の平均値をulate。
- 超音波ネブライザーを介して人工呼吸器からのチャネリング吸気流量によってPBSまたはメタコリン(MCH)の課題(6.25、12.5、25、50および100 mg / ml)を提供します。
- MCH(6.25、12.5、25、50および100 mg / ml)をそれぞれファウル、120回/分で10ミリリットル/ kgのVtを提供することにピストンを戻し、インピーダンス測定を行う。
III。空域への細胞浸潤の測定
A.は、気管支肺胞洗浄(BAL)を実行
- AHRを測定した後、CO 2でマウスを安楽死させる、手術パッドの上に、その裏面にそれぞれのマウスを置きます。
- 70%エタノールで領域を浸す。
- 下腹部から始まる、腹腔を開いてカットしてリブに向かって上向きに移動し、肌/筋肉の上部を取り外します。
- リブが表示されていたら、慎重に穴を開けるには絞りをはさみを使用しています。肺は横隔膜から離れて崩壊する必要があります。特にカリフォルニア州であるrefulないニックネーム肺や心臓へ。
- 完全に肺/心臓を露出させ胸郭を切り取る(サイトの充填から血を保つためにすべての主要な血管を切断しないでください)。
- 27ゲージの注射針(BDシリンジ、フランクリンレイクス、ニュージャージー州)、穿刺心臓の心室、ゆっくりと慎重に血液を収集するために注射器を引き戻すと1mlシリンジを使用します。心の崩壊を避けるために注意してください。
- 標準プロトコルを使用して、この血液から血清を収集します。 -70℃で保存、使用するまで。
- 気管が明らかにされるまで、喉から皮膚や組織を切り取る。フィールド内で簡単に作業するのに十分な組織を一掃する(再度、すべての主要な血管を切断しないでください)。
- パスをクリアするために気管の下にカット湾曲したハサミを使用して、。
- 気管の下に湾曲した鉗子のポイントを通過して、縫合糸の部分の端をつかみます。気管の下に縫合糸を描画します。
- 喉の低い、気管約緩いハーフ結び目を作る。
- Carefully縫合糸の上に、カニューレのサイズに十分な、ノッチを切った。
- 慎重に縫合糸のポイントを過ぎて穴に、気管カニューレを挿入してダウン。カニューレだけ(;:BAL回復しようと折りたたみ気管短すぎる穿刺肺すぎ)、肺の入り口に出てくるまで、ゆっくりと前方に押します。
- カニューレの周囲に気管を密封するために縫合糸と完全な結び目を締めます。
- カニューレのロックシリンジ(1mlのPBSを含む)を、ゆっくりと肺に流体を押してください。肺葉は、個別に徐々に膨らませる必要があります。オーバーフィルしないでください。完全に成長したマウス0.9〜1.0ミリリットルの絶対最大値です。 0.8ミリリットルより安全かもしれません。カニューレに大まかに注射器をロックし、それ以外の場合は解除しようとしたときに損傷を引き起こす可能性があります。
- 肺から液体を引き出す。抵抗が発生した場合(カニューレに吸い込まれる組織)を押しカニューレが徐々に肺にさらにとすると、削除を再開します。また、場所にカニューレを回転させてみてください。もしすべてのELSeが失敗した場合、カニューレの途中を撤回し、気管は、はるかにこのケースでは崩壊する可能性があります。
- カニューレ、コンテナ内の預金BAL液から、注射器を切り離し、新鮮なPBS溶液で2回を繰り返します。
- スピンダウンまで氷上でBALソリューションを保持します。
- BAL液と市販のマウスIgE ELISAキット(MDのバイオ製品、セントポール、MN)を用いてOVA特異的IgEを測定するために血清を使用しています。
B.細胞をカウントし、格差を決定する
- 〜600×gでBAL液で5分間、4℃で遠心し
- PBSで穏やかに細胞ペレットを再懸濁し、氷上に保持します。
- 希釈細胞懸濁液で標準ノイバウアーの血球をロードし、細胞をカウントします。
- cytospins 10〜40μlの体積で2×10 4細胞のアリコートを削除します。必要に応じて細胞を希釈します。
- cytospins、ミックス2×10 4細胞、130μlのPBSと10μlのFBSのために。 DOUB全体を細胞混合物を追加します。ル·サイトスピンは、重複する試料について二重cytoslidesを使用して、700 rpmで10分間遠心分離漏斗と。
- スライドを染色する前に1時間室温で乾燥させます。
- (シーメンス、ニューアーク、デラウェア州)をDiff-Quick染色を使用してスライドを染色。
IV。代表的な結果
挑発的な刺激に続く過度の気道狭窄は、臨床喘息の顕著な特徴です。 flexiVentシステム( 図3)を使用して、全身プレチスモグラフィ( 図2)と強制振動:我々は、OVA感作とチャレンジマウスでメタコリン、このような気道過敏性を測定するための2つの方法について説明します。どちらの方法でも、OVA感作と課題は、マウスの気道過敏性をもたらすことを示しています。
好酸球豊富な気道炎症は、マウスの臨床喘息とアレルギー性気道疾患の両方の別の顕著な特徴です。 図4に示すように、 、OVA感作とチャレンジが大幅にBALによる気道から回収することができる細胞の総数を増加させます。好酸球の数がより少ない程度に、好中球は、特に増加している。
証拠は、感作抗原に対するIgE抗体の過剰産生からのアレルギー性気道疾患の結果を示します。我々は記述プロトコルを使用して、OVAで感作と課題は、( 図5)投与したマウスの血清およびBAL液の両方でIgE値が増加します。
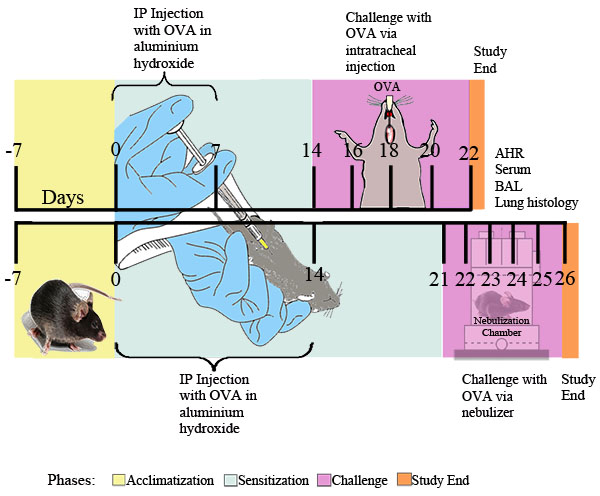
図1。 OVA誘発性アレルギー性喘息のための実験的なスキーマです。マウスではでは、続いて滅菌したPBS単独で0.2 mlの滅菌PBS 0.2 mlの水酸化アルミニウム2mgの、または水酸化アルミニウム2mgの中で乳化OVA20μgので2回IP感作したそれによって指定された時点では0.1%OVAまたは滅菌したPBS溶液を用いて、または日常の元で挑戦 PBSまたはPBSに噴霧1%OVA〜30分間posureは、単独で超音波ネブライザー(Buxco)を介して配信されます。最後のOVA暴露24時間後には、気道過敏性を決定した。その後、BAL液、血液サンプル、肺細胞、および組織をさらなる分析のため収集した。
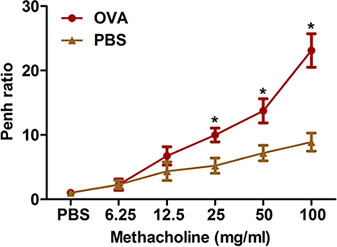
図2。非侵襲的方法によるアレルゲン誘発性気道過敏性の評価。マウス(n = 4/group)は、感作し、OVAでチャレンジした。最後のファウル二十四時間では、メサコリンに対する気道過敏性は、プロトコルで説明したように全身プレチスモグラフィを用いて決定した。プノンペンを決定し、プノンペン比(PBSで8分間隔で平均プノンペンで割ったメタコリンの8分の時間間隔の平均値プノンペン)として表した。 * P <0.05対PBS。
iles/ftp_upload/3771/3771fig3.jpg "/>
図3。侵襲的な方法(強制振動)によるアレルゲン誘発性気道過敏性の評価。マウス(n = 4/group)は、感作し、OVAでチャレンジした。プロトコルで説明したように最後の挑戦に続く24時間後、吸入メサコリン濃度の増加に気道過敏性は、強制振動(flexiVent)メソッドによって決定された。 A、B)の気道抵抗、C)の肺エラスタンス。 * P <0.05対PBS。
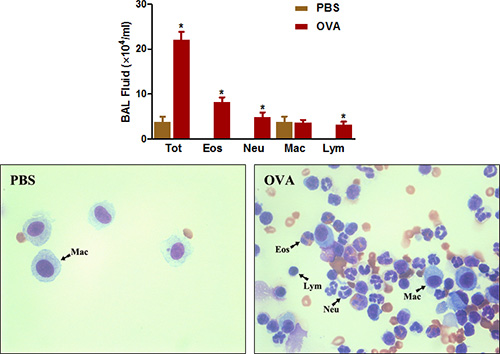
図4。 BAL液の細胞数。マウス(n = 4/group)を感作したとOVAでチャレンジ。最後のファウル二十四時間、( 上 ) BAL細胞を回収し、プロトコルに記載された全細胞を計数した。 ( 下 )サイトスピンスライドはpであったreparedとをDiff-Quickで染色した。 TOT =総細胞;イオス=好酸球、ノイ=好中球、マック=マクロファージ、リンパ球=リンパ球。 * P <0.05対PBS。
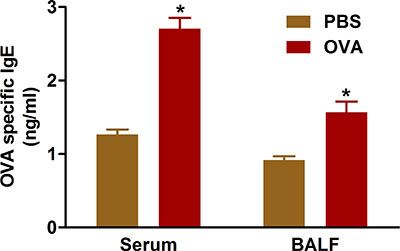
図5。 OVA特異的IgE。マウス(n = 4/group)は、感作し、OVAでチャレンジした。最後のファウル二十四時間では、IgEがBAL液中に、プロトコルで説明したように心臓穿刺により採取した血液から血清中で測定した。 * P <0.05対PBS。
ディスカッション
アレルギー性気道疾患の動物モデルは、臨床的喘息に関連する研究のための重要なツールを提供しています。様々な種や抗原を用いて様々なモデルの数は、開発されている。マウス、魅力的で、頻繁に使用される実験動物はまた、アレルギー性気道疾患のモデルに対して多くの利点を提供しています。9,10このようなモデルが再現することが特に困難である慢性疾患の側面とあら?...
開示事項
動物実験は、プロトコル#V010-10でアトランタVAMC IACUC委員会が定めたガイドラインと規則に従って行われた。
謝辞
この作品は、NIHグラントHL093196(RCR)とアトランタ研究·教育財団(AREF)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 材料名 | 会社 | カタログ番号 | コメント |
| オボアルブミン | Sigma-Aldrich社 セントルイス、ミズーリ | A5503 | |
| 水酸化アルミニウム | Sigma-Aldrich社 | 239186 | |
| アセチル-β-methylcholine塩化 | Sigma-Aldrich社 | A2251 | |
| ペントバルビタールナトリウム塩 | Sigma-Aldrich社 | P3761 | |
| 全身プレチスモグラフィー (WBP)システム | Buxco研究システム ウィルミントン、ノースカロライナ州 | http://www.buxco.com | |
| FlexiVent | SCIREQ株式会社 モントリオール、カナダ | http://www.scireq.com | |
| 光学顕微鏡 | ライカマイクロシステムズ株式会社 バッファローグローブ、イリノイ州 | ||
| サイトスピン4 | サーモフィッシャーサイエンティフィック アッシュビル、ノースカロライナ州 | ||
| をDiff-Quick染色 | ジーメンス ニューアーク、デラウェア州 | B4132-1A | |
| 反復的なピペット | Tridak トリントン、コネチカット州 | STP4001-0025 |
参考文献
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved