このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの長い持続時間の全身温熱療法のためのプロトコル
要約
本稿では、最大12〜24時間の条件のように熱を刺激することができ、マウスにおける全身温熱療法のためのプロトコルについて説明します。
要約
温熱療法は、通常、上記の中核体温の上昇を定義するために使用される一般的な用語です。それは頻繁に発熱時に観察される増加中核体温を記述するために使用されます。アジュバントとしての温熱療法の使用は癌生物学の分野での腫瘍退縮のための有望な手法として浮上している。この目的のために、最も重要な要件は、信頼性が高く、均一な加熱·プロトコルを持つことです。我々は、マウスの温熱療法(全身)のためのプロトコルを開発してきました。このプロトコルでは、動物は、15分の休止期間が続く90分間の温熱療法のサイクルにさらされている。この期間中にマウスが食料や水への容易なアクセスを持っています。最初のいくつかの温熱曝露サイクル中にマウスで、高体温の上昇が、動物を固定化することによって防止される。また、生理食塩水は、脱水の影響を最小限に抑えるため、最初の数サイクルで投与される。このプロトコルは、最大12〜24時間にマウスでの条件のような発熱をシミュレートすることができます。我々は持っているプロトコルを実証するために8〜12週齢のBALB / CJ雌マウスを使用していました。
プロトコル
1。動物の倫理
マウスで長時間温熱療法を行う前に手順が施設内動物のケアと使用委員会によって承認されていることを確認してください。このホワイトペーパーで説明とそれに付随する映像で示されているすべての手順は、免疫学の国立研究所の動物実験倫理委員会によって承認された。
2。理解ハイパーサーミア
全身温熱療法(WBH)は39.5に維持インキュベーターに置かれたケージ℃に温めておいた動物を置くことによって、配信されプロトコルの標準化の間に、温度センサは、外科的にマウスに移植され、彼らの体温は、異なる実験条件で監視した。それが加熱された環境で動物を置くことによって、それらの温度は徐々に37まで増加することが観察された℃〜最大42℃まで100分( 図1)の期間にわたって。木曜日内部体温が外部環境温度よりも高い温度で撃たとして "スパイク"結果の電子は興味をそそられる。
体温が40℃を超えた場合、動物はストレスや鼻の周りに濡れなど脱水症状の兆候を示すでしょう。 40を超えて体温を高める°Cは、湿潤かつ不可逆的なストレスあるいは熱応力に起因する動物の死につながる。だから温熱療法の過程で温度の急上昇を防ぐことが重要です。
高温スパイクのこの現象は、温熱療法、露光中に動物の物理的な多動性に関連付けられています。同様の温度上昇が、あまりにも他のグループによって観測された、より高い温度10を有する環境に導入される時に動物の物理的な多動と関連していた。
我々のプロトコルでは、マウスの温熱療法露光中に固定化されている。として図2に示すように、動物の固定化は、温度の急上昇を防ぎます。
我々は、このプロトコルを実証するための8-12週齢のBALB / CJマウスを使用している。プロトコルは、特定のタイプ/マウスの系統に限定されるものではない。
3。実験の準備
3.1インキュベーター
彼らは優れた温度制御を持っているとして、この実験は通常のCO 2インキュベーター中で行うことができる。 CO 2ガスの供給を切断し、CO 2インキュベーターの保水トレイを取り外します。インキュベーターの一部のモデルでは、CO 2のコントローラをオフに切り替えることができます。マウスケージは便利な内側に配置することができるようにインキュベーターの棚を配置します。 39.5℃でインキュベーターの温度を設定し
3.2ケージ
典型的には、温熱実験を一度に4匹のマウスで実行されます。二つのケージが必要です。上eはインキュベーターの中に置かれ、他は常温で外に配置されている。寝具のパッチが入っているケージの不均一な温度をもたらす時間でウェットになるとケージの寝具は、回避されます。外ケージは食物ペレットと水のボトルを持っている必要があります。
3.3マウスの固定化チューブ
温熱マウスの最初の4サイクルの途中で穴のあいたチューブに固定化されている。これらの固定化チューブはそのすべての体の上にピアスをして50ミリリットル "遠心分離機"チューブから3mmの穴を作ることができ、このようなチューブの4つが必要となります。 50ミリリットル管は便利に8週間以上経過したBALB / CJマウスを固定することができます。適切なサイズのチューブは、マウスのいくつかの異常に異なる株にまたは非常に若いか、50週以上経過したマウスが必要な場合があります。
場所固定化チューブやインキュベーター内部ケージは39.5℃に維持ケージのように少なくとも2時間待つとimmobilization管はインキュベーターの温度を達成する。
4。温熱療法の最初のサイクル
マウスは温熱露光中に脱水症状が発生する可能性があります。したがって、実験を開始する前に、すべてのマウスに0.5ミリリットル生理食塩水を腹腔内投与する。 1mlシリンジで26 Gの針を使用します。
迅速場所、各固定化チューブ中1動物をインキュベーターに入れ、ケージを取り出して、インキュベーターにケージ背面に配置します。時間を記録します。それはインキュベーター内の同じ場所で毎回ケージをおくことが非常に重要です。
90分後、インキュベーターからケージを取り出します。固定管から動物を解放し、食料や水に簡単にアクセスでき、常温でケージの中に置いてください。インキュベーターに戻し、空の固定化チューブを置きます。
15分後、温熱療法の第2サイクルは0を提供することによって開始されます。すべてのマウスに腹腔内に生理食塩水5ミリリットル。
彼らはその後50ミリリットルあき固定化チューブに固定し、インキュベーター内に配置されます。
5。その後の温熱サイクル
最初の4サイクルでは、それはハイパーサーミア露光中に、最初の2つのサイクルのためにマウスを固定化するために不可欠であり、生理食塩水注入は温熱療法の期間を開始する前に、与えられている。
残り続いて温熱療法のこれらのサイクルが完了した後、マウスを慣らす取得し、温熱暴露中に非常に活発になることはありません。マウスが容易に休憩時間中に食べ物や水を取る場合の生理食塩水を腹腔内注射は必要ないかもしれません。
6。すべてのサイクルが完了した後、最後のステップでは、動物を調べることです
温熱療法サイクル中にいずれかの死があってはいけません。すべての動物は、最初は非常に注意深く監視する必要があります数サイクル。急速に鼻周辺で湿潤を探してください。この症状は、脱水の署名である。このような症状を持つマウスはすぐに室温で0.5ミリリットル生理食塩水ipと休息を与えられるべきである。固定化されたマウスのほとんどは、任意の追加のケアを必要としませんし、正常にストレスの温熱療法のご負担になります。
必要なサイクルを完了した後、動物は弱いと脱水見えるかもしれませんが、彼らはすぐに数時間以内に回復します。
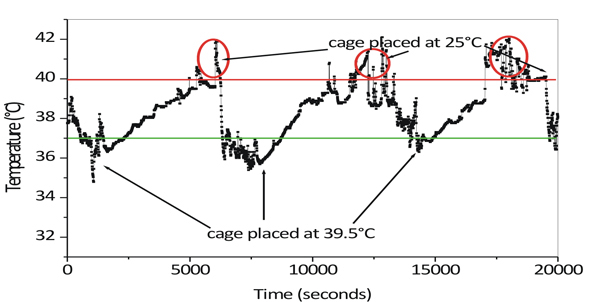
図1ケージは39.5℃のインキュベーター中に置いたマウスの深部体温の変化90分後、ケージをインキュベーターから取り出し、25℃に置か℃、赤丸は高温スパイクを示しています。
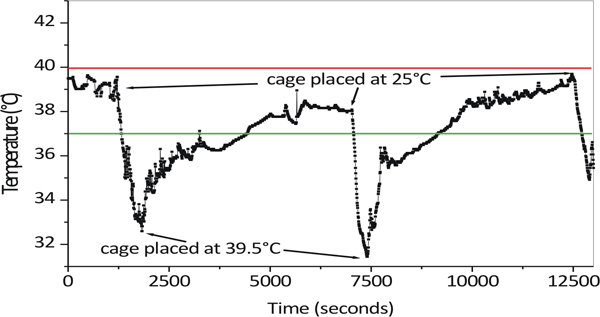
図2コアボディtemperatuのバリエーション温熱療法サイクル中に固定化されたマウスの再。動物を固定した後、高温のスパイクはケージが39.5℃に置かれたときに観察されなかった
ディスカッション
にまでさかのぼる5000 BCとして、エジプトの医師は熱で腫瘍を治療した。ギリシア人はいくつかの医学的治療における熱の価値を認識した。モーセの律法の中で最も古いテキストは、治療的に体温を上昇させる温泉(創世記36:24)を言及する。
以前の技術は温熱療法1の誘導のための発熱や温水浴の誘導のための発熱性微生物抽出物の使用のいずれかを採用し?...
開示事項
我々は、開示することは何もない。
資料
| サーミスタ | RSコンポーネンツ | 528-8558 | |
| CO 2インキュベーター | ヘレウス | B5060 EK-CO2 | |
| マウスケージ | 市民産業株式会社。 | タイプB 365X207X190センチメートル | |
| 動物飼料 | Provimiインド | ||
| ケージ用水筒 | ローカルサプライヤー | ガラス瓶 | |
| はんだごて | Solderon、インド | ||
| 50mlの遠心管 | BD Biosciences社 | 352070 | |
| タイマー | ローカルサプライヤー | ||
| 26G針付き1mlシリンジ | BD Biosciences社 | 309602 | |
| 生理食塩水 | ローカルサプライヤー |
参考文献
- Braude, A. I., Beck, J., Zalesky, M. Febrile response to bacterial pyrogens in leukemia. Blood. 16, 1279 (1960).
- Dovern, E. Hyperthermic intraperitoneal chemotherapy added to the treatment of ovarian cancer. A review of achieved results and complications. Eur. J. Gynaecol. Oncol. 31, 256 (2010).
- Gaworek, J., Mayer, C. T. Systemic whole body hyperthermia in oncology: fatal heat for tumor cells. Pflege. Z. 56, 15 (2003).
- Hegewisch-Becker, S. Effects of whole body hyperthermia (41.8 degrees C) on the frequency of tumor cells in the peripheral blood of patients with advanced malignancies. Clin. Cancer Res. 9, 2079 ( ).
- Jia, D. Inhibition of B16 murine melanoma metastasis and enhancement of immunity by fever-range whole body hyperthermia. Int. J. Hyperthermia. 27, 275 (2011).
- Maluta, S., Dall'oglio, S., Nadalini, L. Treatment for intermediate and high-risk prostate cancer: controversial issues and the role of hyperthermia. Int. J. Hyperthermia. 26, 765 (2010).
- Moyer, H. R., Delman, K. A. The role of hyperthermia in optimizing tumor response to regional therapy. Int. J. Hyperthermia. 24, 251 (2008).
- Muthana, M., Multhoff, G., Pockley, A. G. Tumour infiltrating host cells and their significance for hyperthermia. Int. J. Hyperthermia. 26, 247 (2010).
- Ostberg, J. R., Repasky, E. A. Comparison of the effects of two different whole body hyperthermia protocols on the distribution of murine leukocyte populations. Int. J. Hyperthermia. 16, 29 (2000).
- Pritchard, M. T. Protocols for simulating the thermal component of fever: preclinical and clinical experience. Methods. 32, 54 (2004).
- Repasky, E. A. Characterization of mild whole-body hyperthermia protocols using human breast, ovarian, and colon tumors grown in severe combined immunodeficient mice. Infect. Dis. Obstet. Gynecol. 7, 19 (1999).
- Willnow, U. Treatment of otherwise incurable tumor diseases in childhood using whole-body hyperthermia and chemotherapy. Dtsch. Med. Wochenschr. 114, 208 (1989).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved