このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ハイスループット抗真菌薬スクリーニングのためのカンジダバイオチップ( カルシウム BChip)
要約
我々は3次元ナノバイオフィルムから成る高密度マイクロアレイプラットフォームを開発しました C.カンジダと呼ばれる Caの BChip。上でテスト薬剤の感受性プロフィール Caの BChipは、真菌チップは理想的な抗真菌薬の真のハイスループットスクリーニングに適していることを示唆し、従来の96ウェルプレートモデルに匹敵するものです。
要約
カンジダ·アルビカンスは現在、米国の病院1の第四の最も一般的な院内血流感染を表すカンジダ症の主な病因物質が残ります。これらの日和見感染症は、標的の個人の増加のために成長して脅威を与えると、容認できないほど高い死亡率を運ぶ。これは、抗真菌薬の限られた武器にだけでなく、最も一般的に使用される抗真菌剤に対する耐性の出現に起因する部分である。さらに治療を複雑にしてカンジダ症の症状の大部分がバイオフィルムの形成に関連付けられているという事実であり、これらのバイオフィルム内の細胞は、最も臨床的に使用される抗真菌剤2に対する抵抗性のレベルの増加を示しています。ここでは Cで構成され、高密度マイクロアレイの開発を記述する我々 は 、Ca BChip 3名前を付けて アルビカンスナノバイオフィルム、。簡単に言うと、ロボットのマイクロアレイは、t使用されますCのOプリント酵母細胞固体基板上にカンジダ 。印刷中に、酵母細胞は、50 nLのように低く、適切なコーティングを施したガラス基板上に固定化されたボリュームを用いた3次元マトリックスで囲まれています。最初の印刷後、スライドはバイオフィルムの開発を可能にするために24時間37℃でインキュベートする。この期間中にスポットが成熟したC.に関連付けられている典型的な構造と表現型の特性を表示し、完全に開発した"ナノバイオフィルム"に成長albicansのバイオフィルム( すなわち形態の複雑さ、三次元アーキテクチャと薬剤耐性)4。全体としては、Ca BChipは〜750と同等と空間的に別個のバイオフィルムから構成され、複数のチップを印刷して同時に処理することができる付加的な利点である。細胞の生存率は、fun1の代謝の蛍光強度マイクロアレイスキャナーを用いて染色を測定することによって推定されています。この菌のチップは、理想的にはuのに適しています抗真菌薬創薬のための真のハイスループットスクリーニングにおけるSE。現在の規格( すなわち、バイオフィルム形成5の96ウェルマイクロタイタープレートモデル)に比べ、菌のバイオチップの主な利点は、自動化、小型化、量と試薬と分析時間のコストの節約だけでなく、労働の撤廃です。集中的な手順を実行します。我々はこのようなチップが大幅に抗真菌薬の創薬プロセスをスピードアップすると確信しています。
プロトコル
1。官能スライドの準備
- 取り外し可能なスライドラックに顕微鏡スライドを配置し、99%エタノール(組織学的悪性度)を含む染色瓶に浸漬することにより2回洗浄する。スライドは、圧縮窒素ガスのジェットを使用して、ペーパータオル(紙粉を生成しないように確保)、および乾燥を使用して拭いてください。
注:それは上質紙の塵を生成するようにスライドを拭くためにキム·ワイプを使用しないでください。
- 室温で一晩濃硫酸とインキュベートで満たされた染色瓶にスライドを含むスライドラックを浸します。
注:濃酸と有毒で腐食性の化学薬品での作業中に皮膚との接触を避けるため、耐薬品性手袋や安全ゴーグルを使用しています。
- 30分間、スライドを超音波処理し、30分間のMilli-Q(MΩ18)水で洗浄し、内の別の洗浄に従う5分間cetone。この治療法は、ガラス表面のシラノール基を公開します。
- コート30分間APTESのスライドラックを浸漬し、3 - アミノプロピルトリエトキシシラン(APTES)溶液の2.5%(水中vol / vol)を、クリーンなスライド、15分各洗浄のためにMilli-Q水で3回洗浄し、ベーキング110℃炉内でスライド℃で15分間。ベーキングは、表面の-NH2機能化、その結果、APTESの架橋ができます。
注:ガラス容器の壁に優先的にAPTES預金以来、プラスチック容器にAPTESのソリューションを作成します。
- 1%(トルエン中wt / vol)の疎水性コーティング6の単層を達成するために、ポリスチレン-コ-無水マレイン酸(PS-MA)(Sigma社製)で被覆スライドを、スピンコーターを用いて。 30秒のために3,000 rpmでスピンコーターとコートに搭載された清浄なガラススライド上にPS-MAの2.0 mLを加える。これらの条件は、そのようなコーティングとしてスピンコーティングのパラメータに基づいて異なる場合がありますlution、基板、コーティングの厚さは、次の式(7)によって支配さ
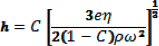
hはフィルムコーティングの厚さであり、eは蒸発率、η、C、ρはそれぞれ、塗布液の粘度、濃度と密度であり、ωは角速度である。
注:ヒュームフードの長い時間と使用するための吸入時にトルエンが有害であることをお勧めします。
- 8℃ - スライドは2で、乾燥した無塵の条件で一ヶ月までのスライドラックに格納することができます
2。酵母の接種とコラーゲンのカプセルの調製
- Cの一晩培養を準備します。 Cの単一コロニーを接種することにより液体培地、酵母ペプトンデキストロース[10 g / Lの酵母エキス、20グラム/ Lペプトン及び20g / LデキストロースYPD]のカンジダ菌株SC5314、 アル10にbicans - YPD 8の20 mLの。 30℃で一晩 - オービタルシェーカー(200 rpmで約150)の文化をインキュベートします。 10mMリン酸緩衝液、2.7 mMの塩化カリウム、、収穫一晩YPD培養液から1 mLのカンジダ酵母細胞(5〜10分間5,000 rpmで遠心分離することによって)、滅菌リン酸1mL中に10分間2回洗浄するには(PBS緩衝生理食塩水洗浄ごとに137 mMの塩化ナトリウム、pH7.4)中(シグマ)。収穫は10分間1900 rpmで遠心分離することによっても、細胞を洗浄した。 1 mLの再建バッファー(2.2%と0.2 NのNaOH溶液(wt / vol)の重炭酸ナトリウムと4.8%(wt / vol)のHEPES、pH7.2)中で洗浄した細胞を再懸濁します。
注:C.カンジダは、リスクグループ1/BSL1微生物である。常に、この微生物と作業のために良い無菌/滅菌技術を使用して、バイオハザード物質の適切な処分のための制度の手続きに従うことを覚えています。
- hemocytを用いて細胞数を数える明視野顕微鏡でometerと5の細胞密度×10 7細胞/ mLに調整します。
- さらに10の添加により懸濁液を10倍希釈×RPMI-1640、L-グルタミンおよびモルホリン(MOPS)酸(pH7.2)で緩衝。
- コラーゲン(1.8 mg / mL)を含むRPMI-1640で細胞懸濁液を混合することによってコラーゲンの酵母細胞をカプセル化した(ラットの尾からタイプ1、BD Biosciences社、ベッドフォード、MA)は、/ 4の最終濃度×10 6個の細胞を得るためにmLである。印刷前にコラーゲンのゲル化を防ぐために氷の上でコラーゲン細胞懸濁液を保持します。
3。 カルシウム BChipの調製
- きれいにし、70%イソプロパノールで拭いソースプレート駅、洗浄と真空ステーション、真空スライドの盛り合わせや印刷室を含むマイクロアレイの全ての表面を、消毒。
- マイクのスライドデッキにPS-MA-コーティングしたガラススライドを、所望の数を配置し、真空で保持するroarrayer。
- 積極的にコラーゲンの渦細胞懸濁液を、単に印刷する前に、96ウェルプレートのウェルによく混合した懸濁液100μLを吸引除去する。ローディングステーションで、このソースプレートを配置します。
- 印刷工程全体のマイクロアレイチャンバ内で100%の相対湿度を維持するために、加湿器のスイッチをオンにします。
- 円錐テーパー190μmのオリフィスセラミックチップを使用して非接触蒸着法によりマイクロアレイスポッター(Omnigridマイクロ、Digilab株式会社ホリストン、MA)を使用して、1.2ミリメートル間隔をあけスポットで48行と16列の配列内の細胞懸濁液を50 NLを印刷(Digilab)。
- 首相は、印刷の各ラウンドの後に二回のヒントを、洗浄し真空乾燥させます。
- 印字直後、気密、加湿チャンバー(ハイブリダイゼーションカセット、ArrayIt株式会社サニーベール、カリフォルニア州)でスライドを配置し、37℃でバイオフィルムの形成を可能にするため、24時間インキュベートします。
4。 Prの感受性試験抗真菌剤に対するCaの BChipでeformedバイオフィルム
- 抗真菌薬の原液または粉末から、RPMI-1640培地中での作業溶液を調製する。ワーキングソリューションの典型的な最大濃度は、フルコナゾールのために1024μg/ mLで、アムホテリシンB 5の16μg/ mLである。他の濃度が異なるエージェントに使用することができます。
- 真ん中の化合物の推定IC 50を含む範囲をスパニング、2倍希釈で原液を希釈することにより、化合物の8つの異なる濃度を準備します。
- バイオフィルムの成長の24時間後、少なくともでは、プラス(メディアのみで無薬剤、すなわち細胞)とマイナス(20分間次亜塩素酸ナトリウム処理)コントロールと共に、薬物の8つの異なる濃度の50 NLを印刷するためにマイクロアレイを使用し6は、バイオフィルムの上に複製されます。
注:追加しながら、スポットの乾燥を防ぐために100%の相対湿度を維持薬を優先します。
- すぐに薬を追加した後、24時間、37℃で加湿チャンバー内での薬剤とチップをインキュベートします。
- PBSで毎回2分間3-5回をCaBChipをダンクで薬を洗い流し、37で0.5μMfun1の℃で30分間9 Cとカルシウム BChipをインキュベートすることにより染色。
- 1〜3分ごとにダンクシュートをPBS中の Ca BChip 3-5回をダンクではオフに染色し、窒素気流を使用してCA BChipを乾燥させ洗浄します。 380のPMTゲインを持つ532nmの波長でのマイクロアレイスキャナ(GenePix 4100A、アクソンインスツルメンツ、CA)を使用して蛍光強度を読み取る。
- 陽性対照(無薬剤)と100%と0%で死んだ(漂白処理)バイオ·スポットの蛍光強度は、それぞれを設定します。
- 次の式を使用して、制御点の平均値からの相対蛍光強度(F)の減少によって阻害率を決定する

ここで、F、F maxとF oは 、それぞれの薬剤処理、無薬物コントロールと漂白処理されたスポットの生の蛍光強度である。スキャナの設定はそれぞれF maxと30000 4000 RFUのF oを取得するために調整されました。
- グラフパッドプリズムソフトウェア(カリフォルニア州ラホーヤ)を使用して可変スロープヒル式をフィッティングすることにより50%阻害濃度またはIC 50を計算します 。
5。代表的な結果
48で構成される代表的なカルシウムBChip、×Cのナノバイオフィルムの16列の配列カンジダは、 図2に示されています。明視野顕微鏡は、ナノバイオフィルムの全体的な建築の特徴を示しています。菌糸があるのマトリックス内に埋め込まれているバイオフィルムショーの走査型電子顕微鏡画像直径約2μmと100 nmであるコラーゲン繊維は、それぞれ。 fun1の染色マイクロアレイスキャナー画像は、真菌バイオフィルムの特徴である酵母と菌糸の形態を示しています。 fun1の染色バイオフィルムの2Dおよび3D共焦点蛍光画像は、細胞外マトリックス(によっても製造exopolymeric材料の封止材料と最も可能性が高いとコラーゲンから成る内に散在して代謝活性を有する細胞の領域で、空間的な異質性を持つように見ることができます代謝染料で染色されていないバイオフィルム細胞)。バイオフィルムの厚さは約50μmであると推定された。 カルシウム BChipは二つの薬、フルコナゾールやアムホテリシンBの抗真菌薬感受性を推定するために使用し、その結果を図3に示されています。業界標準96ウェルプレートアッセイでパブリッシュされたレポートと一致して、バイオフィルムはフルコナゾール10と計算したIC 50に対して耐性があるアムホテリシンBは、0.3μg/ mLで11です。

カルシウム BChipの製造のために図1のフローチャート。

図2印刷高thoughput カルシウム BChipの画像がロボットのマイクロアレイを使用してPS-MA-コーティングしたスライド上の768箇所を含む。各半球のスポットは、直径約700μmであり、スポット間の1.2ミリメートルの分離と、そのボリュームに50 nLのです。また、(時計回り)に示す光学顕微鏡、マイクロアレイスキャナ、2Dと3D-蛍光顕微鏡、 および Ca BChip上の個々のバイオフィルムの電子顕微鏡画像をスキャンしている。 25000 xの高倍率でのSEMの図は、幅2μmの菌糸フィラメントを示しています。
図3 "SRC =" / files/ftp_upload/3845/3845fig3.jpg "/>
図3 の Ca BChipを使用して、(A)フルコナゾールと(B)アムホテリシンBのIC 50値の抗真菌薬感受性試験と測定の結果。アムホテリシンB投与バイオフィルムの蛍光顕微鏡画像は、(C)に示されています。結果は平均±10を含む2つの別々のチップの標準誤差の平均は、それぞれの条件を複製します。
ディスカッション
我々は、 カンジダ·アルビカンスバイオフィルムのナノリットルボリュームで構成されるセルベースの高密度マイクロアレイは、Ca BChipを開発しました。マイクロアレイは、非拡散、半球状3Dゲルのために必要な疎水性を提供しながら、コラーゲンゲルスポットの堅牢な添付ファイルで許可される変更されたガラス基板上に印刷された。 単一のCA BChipは約8、96ウェルプレー...
開示事項
ホセL.ロペスリボーと抗真菌剤を開発していますMicrobeHTS Technologies、Inc。のでアナンドK. Ramasubramanian自己資本。 MicrobeHTSテクノロジーズ社は、これらの研究のための財政的支援を提供しなかった。
謝辞
この作品は、サウス·テキサス·技術経営(POCrr 2009.041)、研究資源のナショナルセンター(UL 1RR025767)から医学と科学の統合のための研究所からの補助金によって、歯科·頭蓋顔面研究所国立研究所(から一部で賄われていた5R21DE017294)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 3 - アミノプロピルトリエトキシシラン(APTES) | Sigma-Aldrich社 | 440140 | |
| ポリスチレン - コ - 無水マレイン酸(PS-MA) | Sigma-Aldrich社 | 426946 | |
| ガラス顕微鏡スライド | フィッシャー·サイエンティフィック | 12-549-3 | |
| ラット尾コラーゲンI型 | BDバイオサイエンス | 354236 | |
| ロボットのマイクロアレイ | Omnigridマイクロ | MICROSYS4000/4100A | |
| マイクロアレイスキャナ | Genepix個人4100A | GENEPIX4100A | |
| ハイブリダイゼーションカセット | ArrayIt株式会社 | AHCXD | |
| fun1の[2 - 塩素RO-4-(2,3 - ジヒドロ-3 - メチル - (ベンゾ-1,3 - チアゾール-2 - イル) - メチリデン)-1 - フェニルquinoliniumiodide] | インビトロジェン株式会社 | F-7030 | |
| フルコナゾール | Sicor製薬株式会社 | J02AC01 | |
| アムホテリシンB | シグマ | A2411 | |
| RPMI-1640 | メディアテック株式会社 | 50から020-PC | |
| セラミックチップ190μmのオリフィス | Digilab | 60020441から00 | |
| グラフパッドプリズムソフトウェア | グラフパッドソフトウェア株式会社 | ||
| GenepixプロV4.1 | モレキュラーデバイス |
参考文献
- Edmond, M. B. Nosocomial bloodstream infections in United States hospitals: a three-year analysis. Clin. Infect. Dis. 29, 239-244 (1999).
- Ramage, G., Bachmann, S., Patterson, T. F., Wickes, B. L., Lopez-Ribot, J. L. Investigation of multidrug efflux pumps in relation to fluconazole resistance in Candida albicans biofilms. J. Antimicrob. Chemother. 49, 973-980 (2002).
- Srinivasan, A., Uppuluri, P., Lopez-Ribot, J., Ramasubramanian, A. K. Development of a High-Throughput Candida albicans Biofilm Chip. PLoS ONE. 6, 19036-19036 (2011).
- Ramage, G., Vandewalle, K., Wickes, B. L., Lopez-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Rev. Iberoam. Micol. 18, 163-170 (2001).
- Pierce, C. G. A simple and reproducible 96-well plate-based method for the formation of fungal biofilms and its application to antifungal susceptibility testing. Nat. Protoc. 3, 1494-1500 (2008).
- Lee, M. Y. Three-dimensional cellular microarray for high-throughput toxicology assays. Proc. Natl. Acad. Sci. U.S.A. 105, 59-63 (2008).
- Meyerhofer, D. Characteristics of resist films produced by spinning. Journal of Applied Physics. 49, (1978).
- Ramage, G., Vande Walle, K., Wickes, B. L., Lopez-Ribot, J. L. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms. Antimicrob. Agents Chemother. 45, 2475-2479 (2001).
- Chandra, J. Biofilm formation by the fungal pathogen Candida albicans: Development, architecture, and drug resistance. Journal of Bacteriology. 183, 5385-5394 (2001).
- Jabra-Rizk, M. A., Falkler, W. A., Meiller, T. F. Fungal biofilms and drug resistance. Emerg. Infect. Dis. 10, 14-19 (2004).
- Tobudic, S., Lassnigg, A., Kratzer, C., Graninger, W., Presterl, E. Antifungal activity of amphotericin B, caspofungin and posaconazole on Candida albicans biofilms in intermediate and mature development phases. Mycoses. 53, 208-214 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved