このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
in vitroで中皮クリアランスアッセイでそのモデルの卵巣がんの転移の初期段階を
要約
ここで説明した中皮クリアランスアッセイは、蛍光標識細胞とタイムラプスビデオ顕微鏡可視化と定量的に卵巣癌多細胞スフェロイドと中皮細胞単層の相互作用を測定するために利用しています。このアッセイは、卵巣癌転移の初期段階をモデル化します。
要約
卵巣癌は、米国1の癌関連死の第五主要な原因である。治療への積極的な初期応答にもかかわらず、卵巣癌の女性の70〜90%が新たな転移を開発し、再発はしばしば2致命的である。それは、中間と後期段階の卵巣癌のためのより良い治療法を開発するために、二次転移が起こるかを理解するため、必要がある。悪性細胞が原発腫瘍部位から切り離し、腹腔内全体に普及させるときに卵巣がんの転移が発生します。播種細胞が腹腔3(図1、動画1)内の臓器に多クラスタ、または回転楕円体のいずれかのまま添付されていないか、またはインプラントを形成することができる。
腹腔内臓器のすべてが中皮細胞4-6(図2)のシングル、連続、層が並んでいます。しかし、中皮細胞は下から不在であるとして摘出したヒト腫瘍組織切片3,5-7(図2)の電子顕微鏡の研究によって明らかにされた腹膜腫瘍塊。これは中皮細胞が未知のプロセスによって、腫瘍塊の下から除外されていることを示唆している。
in vitro実験前の8中皮細胞に対するよりも原発性卵巣癌細胞は細胞外マトリックスへのより効率的に取り付けることが示され、さらに最近の研究では、原発性腹膜中皮細胞が実際に接着および浸潤に比べて卵巣癌細胞の接着および浸潤(に障壁を提供示した中皮細胞で覆われていない基板)9,10ます。これは中皮細胞は、卵巣癌の転移に対する障壁として作用することを示唆している。卵巣癌細胞は、この障壁を突破し、持っている皮を除外したことにより細胞および分子メカニズムは、最近まで不明であった。
ここでは、目を記述するin vitroアッセイのためのeの方法論をモデル生体内 (図3、映画2) の卵巣癌細胞のスフェロイドと中皮細胞との相互作用。我々のプロトコルは、中皮単層8月16日卵巣腫瘍細胞の相互作用を解析するための前述の方法から適応され、最初に卵巣腫瘍細胞はの排除を促進するためのミオシンとトラクション力のインテグリン依存性活性化を利用して表示するレポートに記載された腫瘍回転楕円体17の下から中皮細胞。このモデルは、相互作用の空間的および時間的な情報を提供し、リアルタイムで2つの細胞集団を監視するタイムラプス蛍光顕微鏡を利用しています。中皮細胞が緑色蛍光タンパク質(GFP)を発現しながら卵巣癌細胞は、赤色蛍光タンパク質(RFP)を発現する。 RFP発現卵巣癌細胞のスフェロイドは、GFPを発現する中皮単層に接続します。スフェロイドの広がり、侵入し、脇に単分子層に穴を作成中皮細胞を強制します。この穴は、GFPイメージの負の領域(黒)として可視化される。穴の面積は、次に定量的に制御および卵巣癌および/または中皮細胞の実験的集団の間のクリアランス活性の違いを分析するために測定することができます。このアッセイは、卵巣癌細胞(条件ごとに回転楕円体X 20から30回転楕円体当たり100細胞)のごく少数を必要とするので、貴重な原発腫瘍の細胞サンプルを使用して、このアッセイを行うことが可能である。さらに、このアッセイは、簡単にハイスループットスクリーニングに適応することができます。
プロトコル
1。卵巣癌細胞スフェロイドの形成
- RFP発現卵巣癌細胞は10%の基本培地(199 MCDB105の50:50混合物、10%不活化ウシ胎児血清および1%ペン連鎖球菌を含むカスタム細胞培養培地)で培養されています。ラベルが付いていない卵巣癌細胞にRFPを表現するために、プラスミドを含むRFPで細胞をトランスフェクトし、RFPを発現する細胞に対して選択されます。また、ウイルスベクターを一過的に蛍光タンパク質を発現するために使用されたり、細胞が赤色蛍光細胞トラッカー色素(Invitrogen)とプレインキュベートすることができます。
- 前の卵巣癌細胞スフェロイドの形成には、低接着96ウェル丸底培養皿を準備する必要があります。低接着培養プレートを生成するために、30μlのポリHEMA(1ミリリットル95パーセントエタノールで6mgをpolyhydroxyethylmethacrylate)溶液を96ウェルコーニングの細胞培養皿の各ウェルに添加されています。 96ウェルプレートは、L、°C非加湿インキュベーターは、エタノールを蒸発させるために37でインキュベートされる各ウェルにポリHEMAのフィルムをeaving。このポリHEMA膜は、細胞は、懸濁液18に成長すると、強制的に井戸の底に付着するから細胞を防ぐことができます。 [別の方法として、超低添付培養プレート(Corning)は、ポリ-HEMAコートディッシュの代わりに使用できます。]
- 低接着培養プレートが用意された後、卵巣癌細胞、ペレット3分間900 RCFで卓上遠心機(ヘレウス)の細胞は、上清を吸引し、10%の基本培地に再懸濁のプレートをトリプシン処理。
- 血球計算板を用いて細胞をカウントします。
- 10%の基本培地50μlの100細胞が存在するような細胞の濃度を調整します。
- 96ウェルのポリHEMAコーティングした培養皿の各ウェルに均一に懸濁希釈細胞懸濁液50μlのを追加します。
- 16時間37℃細胞培養インキュベーター中で96ウェルプレートをインキュベートします(この時間は、それがためにかかる時間の量に応じて増減されるべき各ウェル内の単一の多細胞スフェロイドを形成し、一緒にクラスタに卵巣癌細胞を可能にする多細胞スフェロイドまたは所望の実験条件)を形成する特定の細胞株。いくつかの腫瘍細胞は、この期間中にアポトーシスを受けることができるので、前のアポトーシスの誘導までの時間を選択することが重要です。
2。中皮細胞単層の形成
- 皿の各ウェルに5μgのフィブロネクチン/ mLのPBS溶液2mLのを追加し、室温で30分間インキュベートすることにより細胞培養フード、プレコートにフィブロネクチンで6ウェルガラスボトムマテック皿の井戸。マテック皿にガラス底の光学的品質は、高解像度顕微鏡イメージングを可能にします。
- GFPを発現する中皮細胞は、10%の基本培地中で培養されています。中皮細胞のプレートをトリプシン処理、3分間900RPMで卓上遠心機(ヘレウス)にスピンダウンし、上清を吸引し、10%の基本培地に再懸濁する。ザここで使用される中皮細胞は、それらが得られた時にすでにGFPを発現していましたが、ラベルが付いていない中皮細胞のcDNAを含むプラスミドでトランスフェクションGFP、緑色蛍光細胞トラッカー色素(Invitrogen)中で細胞をプレインキュベートすることによって製造することができる。
- 30分フィブロネクチンのインキュベーション(ステップ2.1)の後、2mLのPBSでマテック皿のウェルを洗浄する。
- 6ウェルマテック皿の各ウェルにウェルあたりPBSと板6×10 5中皮細胞を吸引除去する。中皮細胞がディッシュにアタッチし、単分子膜を形成できるようにするために一晩37℃のインキュベーター内でマテック皿をインキュベートします。
3。中皮細胞クリアランスアッセイ
- 96ウェルポリ-HEMAコートプレートから卵巣癌のスフェロイドを収集するためのピペットを使用しています。
- 中皮細胞単層を含む6ウェルマテック皿の1つのウェルから培地を吸引除去する。 2mLのPBSで1回洗浄します。 96ウェルpから回転楕円体のすべてを追加します。マテック皿(撮像することはできません料理の一部にスフェロイドの着陸を考慮してイメージを作成しようとしている回転楕円体の〜3倍の数)1つのウェルに遅い。
- 少なくとも8時間の期間タイムラプスイメージングを行うことができる反転広視野蛍光顕微鏡のステージ上でマテック皿を置きます。回の実験では、複数の回転楕円体のインターカレーションイベントで、皿の中のイメージを複数の位置に電動ステージを使用しています。我々は統合されたパーフェクトフォーカスシステムとニコンのTi-E反転電動広視野蛍光タイムラプス顕微鏡を使用して、低[20X-0.75の開口数(NA)]倍率/ NA微分干渉コントラスト(DIC)光学、0.52 NAニコンハロゲンネーター長い作動距離(LWD)コンデンサー、ニコンに高速(<100ミリ秒の切り替え時間)は励起および発光フィルタ(GFP例40分の480、エム50分の525、RFP-mCherry例50分の575エム50分の640)、サッターは、高速送信と落射蛍光光路スマートシャットダウンTERS、ニコン線形でエンコードされた電動ステージ、浜松ORCA-AGは、電荷結合素子(CCD)カメラ、温度とCO 2制御と特注の顕微鏡のインキュベーション室、ニコンNIS-ElementsシリーズARソフトウェアバージョン3を冷却し、 TMCの防振台。
- 卵巣癌細胞のスフェロイドは、皿の底に沈殿し、中皮細胞単層にアタッチされます。 8時間に20のGFP、RFPと位相画像+回転楕円体/単層相互作用、10分ごとに収集します。
- RFP発現卵巣癌細胞のスフェロイドは、単層の穴を作成するGFPを発現する中皮細胞単層に侵入します。 8時間後には、Elementsソフトウェア(またはそのようなイメージJなどの別の適切なソフトウェア)を使用して、GFP画像のブラックホールをトレースすることによって穴の大きさを測定します。時間ゼロで対応するRFPイメージの回転楕円体の大きさによって8時間で穴の大きさを分割することによって初期回転楕円体の大きさに穴の大きさを正規化します。この元の十分な、穴のサイズは一度しか測定されたが、それは優れたインターカレーションのダイナミクスを理解するために8時間の実験を通して複数回測定することができます。
4。代表的な結果
この例では、OVCA433スフェロイドを制御するために、タリン-1の減衰式を持っているOVCA433卵巣癌細胞スフェロイドの皮クリアランス能力を比較した。各グループからOVCA433スフェロイドは、ZT中皮細胞単層を含むマテック皿に追加されました。各グループから六スフェロイドは8時間(図4、映画3、ムービー4)は10分ごとに撮像した。拡散スフェロイドで単分子層で生産さの穴を測定し、各グループから6つの位置を平均した。タリン1ノックダウン細胞スフェロイドによって作成された平均隙間面積が制御スフェロイドで作成された平均面積よりも有意に小さかったことが図4に示すように、タリンはO皮クリアランスために必要であることが示唆されたVCA433卵巣癌細胞スフェロイド。
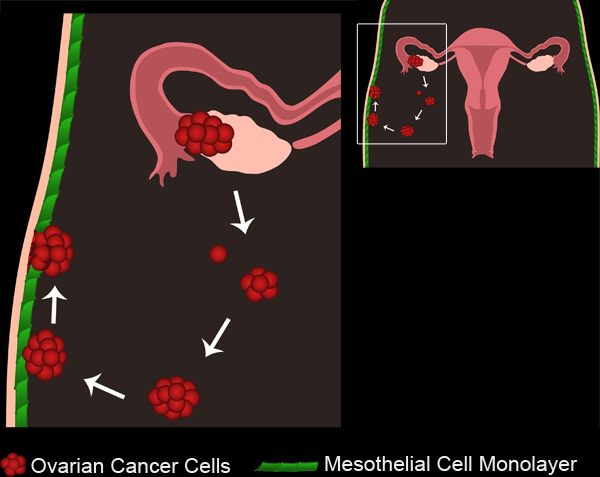
図1卵巣がんの転移。原発性卵巣腫瘍は卵巣表層上皮または卵管のいずれかから開発しています。腫瘍細胞/クラスタでは、原発腫瘍から離れると腹腔内に収集されます。腫瘍細胞は多細胞スフェロイドを形成するために集計してすることができます。スフェロイドは、腹腔の内側を覆う中皮細胞単層に接続します。中皮細胞は、スフェロイドは、基礎となる基底膜へのアクセス権を取得することができ、接続された卵巣癌の回転楕円体の下から除外されています。
ムービー1。卵巣がんの転移は、ムービーを表示するには、ここをクリック 。
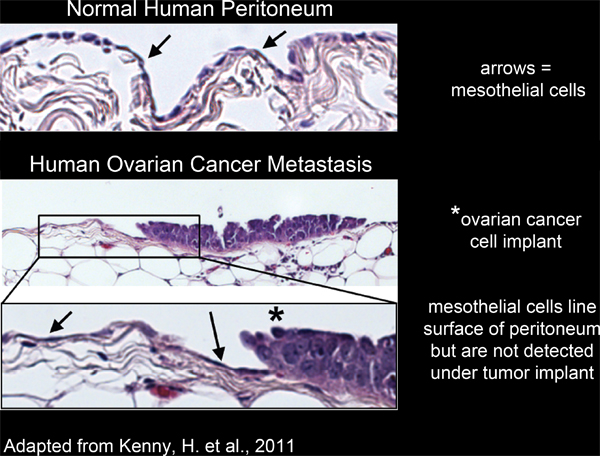
図2。 中皮細胞は、ヒト腹膜組織の表面を整列および卵巣癌細胞のインプラントの下から除外されています。
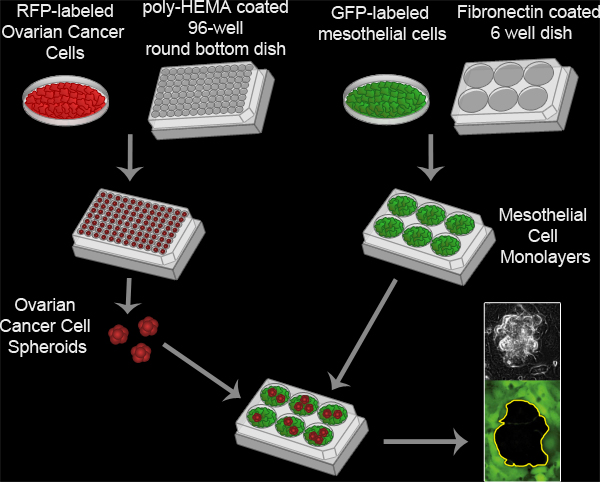
図3中皮クリアランスアッセイ。卵巣癌のスフェロイドは、100をインキュベートすることによって形成されたRFPを発現している16時間37℃で、ポリ-HEMAコート96ウェル丸底培養皿に、ウェルあたり卵巣癌細胞を。ポリHEMAは、細胞懸濁液中に残り、ウェルあたり単一のクラスタを形成するためにお互いに付着することができ、培養皿に付着するから細胞を防ぐことができます。中皮細胞単層をフィブロネクチンコーティングした6ウェルマテック皿にウェルあたり6×10 5中皮細胞をプレーティングし、16時間37℃でプレートをインキュベートすることによって調製される。スフェロイドは、その後中皮単分子膜でマテック皿に移しており、2つの細胞集団は、ニコンのTi-E Iを用いて8時間、10分ごとに結像さnverted電動広視野蛍光タイムラプス顕微鏡および要素ソフトウェア。
映画(2)中皮クリアランスアッセイは、ムービーを表示するには、ここをクリック 。
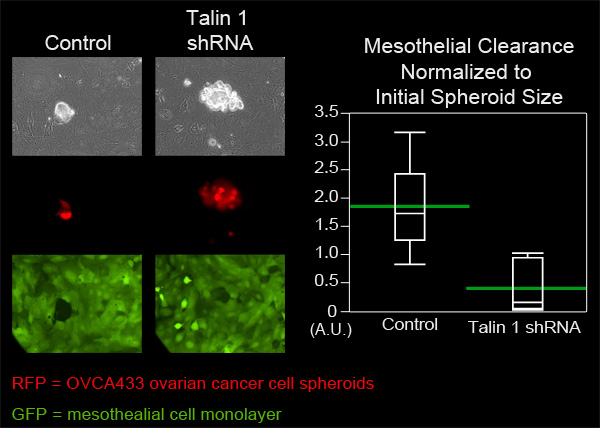
OVCA433スフェロイドにおけるタリン1発現の図4減衰は皮クリアランス能力を減少させます。タリン1の減衰発現の有無にかかわらずOVCA433スフェロイド(赤)に接続し、ZT中皮組織化単分子膜(緑色)に侵入することができました。 2つの細胞集団は、ニコンのTi-E反転電動広視野蛍光タイムラプス顕微鏡と要素ソフトウェアを使用して8時間10分ごとに撮像した。グラフは、タリン1減衰を示しています。大幅に中皮細胞のクリアランス(手段で緑色のバーが分位点プロット)を減少させます。
映画は、3。中皮組織化単分子膜(緑色)に侵入OVCA433スフェロイド(赤)を制御します。 ムービーを表示するには、ここをクリック 。
OVCA433スフェロイドにおけるタリン1の発現(赤)の映画4。減衰は(緑)クリアランス能力を皮が減少します。 ムービーを表示するには、ここをクリック 。
ディスカッション
ここで紹介する "中皮クリアランスAssayは、"偉大な空間的·時間的に詳細に、卵巣癌多細胞スフェロイドと中皮細胞単層の相互作用を監視するためのタイムラプス顕微鏡を使用しています。以前は、いくつかのグループ8-14卵巣癌細胞にアタッチし、中皮細胞単層に侵入することを示すためにエンドポイントアッセイを使用していた。このアッセイは、これら2つの細胞集団のダ?...
開示事項
我々は、開示することは何もありません。
謝辞
私たちは、ハーバード大学医学部ニコンイメージングセンターは、特にジェニファー·ウォーターズ、ララペトラークとウェンディサーモン、訓練のため、それらのタイムラプス顕微鏡の使用を感謝したいと思います。また、貴重な議論のためにローザNgとアヒム·Besserに感謝します。この作品は、NIHグラント5695837(M. Iwanickiまで)とJSBにGM064346によってサポートされていました、博士ミリアムとシェルドンG.アデルソン医学研究財団(JSBまで)からの助成金によって。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ番号 | コメント |
| OVCA433卵巣癌細胞 | 博士デニスSlamonからの贈り物 | ||
| ZT中皮細胞 | 博士タンからの贈り物はインス | ||
| 培地199 | ギブコ | 19950 | |
| MCDB105 | セル·アプリケーション株式会社 | 117から500 | |
| FBS-熱不活性化 | ギブコ | 10082 | |
| ペン連鎖球菌 | ギブコ | 15070 | |
| 96ウェルプレート | コーニングコースター | 3799 | |
| Polyhydroxyethylmethacrylate(ポリHEMA) | シグマアルドリッチ | 192066-25G | ポリHEMAソリューションでは、95%エタノール1mlので6mgをポリHEMA粉末を溶解 |
| エタノール | Pharmco-aaper | 111ACS200 | のdH 2 0で95%に希釈する |
| 細胞培養フード | Nuaire | NU-425から300 | |
| 組織培養インキュベーター | サーモフィッシャーサイエンティフィック | 3110 | |
| ポリHEMAプレートのインキュベーター | Lablineインスツルメンツ | 帝国III 305 | |
| 卓上遠心機 | ヘレウス | 75003429/01 | |
| 6ウェルガラスボトムディッシュ | マテック株式会社。 | P06G-1.5-20-F | |
| フィブロネクチン | シグマ | F1141-1mgの | |
| PBS | Cellgro | 21から040-CV | |
| タイムラプス顕微鏡: | |||
| 顕微鏡 | ニコン | 統合されたパーフェクトフォーカスシステムとしたTi-E電動倒立蛍光タイムラプス顕微鏡 | |
| レンズ | ニコン | 20X-0.75の数値apeture | |
| ハロゲンネーター | ニコン | 0.52 NA長作動距離コンデンサ | |
| 励起および発光フィルター | ニコンハウジング内のクロマ単一パス·フィルタ | GFP例40分の480、エム50分の525 RFP-mCherry例50分の575エム50分の640 | |
| 送信され、光路をEpifluoresce | サッター | スマートシャッター | |
| 線形符号化された電動ステージ | ニコン | ||
| 冷却電荷結合素子カメラ | 浜松市 | ORCA-AG | |
| 温度とCO 2制御と顕微鏡インキュベーションチャンバー | 特注の | ||
| 防振台 | TMC | ||
| NIS-Elementsシリーズソフトウェア | ニコン | バージョン3 |
参考文献
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved