このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
から卵を使用して、
要約
マンソン住血吸虫の卵は、Tヘルパー2型(Th2型)免疫応答、寄生虫感染症、喘息とアレルギー性炎症の特性の強力な刺激剤である。このプロトコルはS.を利用卵の周りの肺肉芽腫形成、好酸球とマクロファージの代替活性化により特徴付けられる肺のCD4 Th2サイトカインによって誘導される炎症反応を生成するために、 マンソンの卵注入。
要約
住血吸虫の寄生虫は1世界中で推定200万人に感染する血液吸虫です。 住血吸虫 、肝線維症と脾腫を含む重篤な病態、慢性感染症ではなく、寄生虫自体は2よりも寄生虫の卵に対する免疫応答によって引き起こされます。寄生虫の卵IL-4の産生によって特徴づけTh2応答を誘導し、IL-5およびIL-13、マクロファージおよび好酸球の動員の代替活性化。ここでは、寄生虫に固有の肺におけるTh2サイトカイン応答および所属リンパ節、卵を周囲の肺肉芽腫の形成、気道の炎症を調べるためのモデルとしてマンソン住血吸虫卵の注入を説明します。
腹腔内感作および静脈内チャレンジ、S.以下マンソンの卵は、それらが肺実質内に閉じ込められている肺動脈を経由して肺に運ばれる肉芽腫でリンパ球、好酸球と交互に活性化マクロファージ3-6の構成。気管支肺胞スペースで肉芽腫形成、炎症に関連付けられている、所属リンパ節およびCD4の拡大は、T細胞の活性化を観察することができる。ここでは詳細は、感染した肝臓(7から変更された)から、 マンソン住血吸虫卵を分離したマウスを感作し、挑戦し、分析のための臓器(気管支肺胞洗浄(BAL)、肺と所属リンパ節)を回復するためのプロトコルです。我々はまた、追加の免疫学的分析のための代表的な組織学的および免疫学的データとの提案が含まれています。
全体的に、このメソッドは、in vivoモデル寄生虫感染症、線維症、アレルギー性炎症や喘息を含むTh2の炎症性疾患の研究に広く適用可能である肺に寄生虫によって誘発される免疫応答を調査するために用意されています。標準の研究のためのこのモデルの利点肺のE 2炎症が肺の中の強力なTh2の炎症反応の再現性と所属リンパ節、卵を周囲の肉芽腫の組織学的検査によって炎症の評価の容易さ、および寄生虫の長期貯蔵の可能性を含む卵。
プロトコル
1。 マンソン住血吸虫卵を浄化する
- 住血吸虫のライフサイクル8の感染段階である住血吸虫セルカリア、とスイス-Websterマウスに感染します。また、NIAID住血吸虫症リソースセンター(から住血吸虫感染マウスを得るhttp://www.schisto-resource.org/~~V )。その時点で、卵は肝臓内に存在し、後述するように( 図を参照してください。1)を回復することができ、感染後6から7週間のマウスにしておきます。
- CO 2でマウスを安楽死させると、70%エタノールでぬれた。背中の上にマウスを置きます。皮膚の基礎となる腹膜を切り取るために鈍い鉗子とハサミを使用しています。消費税肝臓、胸郭と横隔膜の下にある。
- 細かく肝臓をミンチし、PBSでコラゲナーゼ/ディスパーゼ(0.5 mg / mL)は、ペニシリン(100 U / mL)およびストレプトマイシン(100μg/ mL)を構成される消化液、肝臓あたり20 mLを追加します。 mixtを置く50mLのファルコンチューブにUREと37°Cシェーカーで一晩インキュベートする。
- 400 XG / 3分/ 20℃で混合物を遠心分離優しく余分な液体を捨て、PBSでチューブを記入してください。再び遠心分離し、PBS洗浄を繰り返します。最後の遠心分離、25mLのPBSでペレットを再懸濁し以下。
- 細かいふるい(目の細かいふるいを通して混合物をプッシュするために10mLのシリンジを使用して混合物を渡すことによって、続いて標準的なキッチンの金属ストレーナー(ガラスビーカーを介してマッシュ肝臓片に50 mLのシリンジプランジャを使用)を介して再懸濁したペレットを痛める第2のガラスビーカー)。
- 50mLのファルコンチューブに緊張した混合物を入れてください。 400 XG / 5で遠心分/ 20℃ペレットを失うことなく、上清を注意深く注ぐ。 3 mLのPBSでペレットを再懸濁します。
- オーバーレイは、20%パーコール、8 mLのパーコールおよび32 mLの0.25Mスクロース(FW = 342.3ので、8.56グラムsucrose/100 mLのH 2 0)を40mLの勾配の上に静かに混ぜる。
- 10分/ 800 XG / 20℃遠心オフピペットdは、肝細胞のゼラチン最上層を破棄します。ピペットの下部にある卵ペレットを除去し、15mlファルコンチューブに入れられます。
- 10 mLのPBS / 1mMのEDTA / 1 mMのEGTAを使用して遠心分離設定の洗浄ペレット3X:3分/ 30 XG / 20℃ 500μLのPBSに再懸濁します。
- 10分/ 800 XG / 20℃:新しい25%パーコール遠心機の設定を使用して10 mLの濃度勾配(2.5 mLをパーコールと7.5mLの0.25Mスクロース)上にオーバーレイミックス
- 遠心分離の設定を使用して10mLのPBSで3倍の洗浄:3分/ 30 XG / 20℃
- 最後の10 mLの洗浄では、卵をカウントするために100μLを削除します。卵はすぐに解決する、ファルコンチューブはサンプルを削除する前に十分に混合する必要がありますので。 900μLのPBSに100μLのサンプルを希釈する。ミックスの100μLを解剖顕微鏡(10倍希釈)を使用して、顕微鏡スライド上に液滴としてカウントする必要があります。ワイドボアピペットチップを使用する必要があります。
- PBSで50,000卵/ mLで卵を再懸濁します。卵は-80℃で数ヶ月間保存され、一回またはTWIC解凍することができます使用のためのe。ご使用になる前に、卵が( 図1を参照 )が無傷であることを確認するために顕微鏡下で検査します。
2。 S.と腹腔内感作マンソンの卵:0日
- 5mLのsnapcapチューブに5000μlのPBS eggs/100で卵を準備します。注射のために、必要以上に50%以上の卵を推定する。
- マウス当たりの卵懸濁液100μLを23ゲージ針3/4inch、1 mLシリンジをロードします。卵は、落ち着くので、使用直前に卵で針をロードします。
- 前に、各注射に卵を混ぜて、マウス当たりの懸濁液を腹腔内に100μLを注入する前後にロックシリンジ。
3。 S.と眼窩静脈チャレンジマンソンの卵:14日
- 5000 eggs/100μLで上記のように卵を準備します。
- (4%)イソフルラン、またはキシラジン(10 mg / kg体重)とケタミン(120 mg / kg)を腹腔内で特殊なチャンバー内でマウスを麻酔。 anestの深さhesiaは、足蹠のピンチとは物理的な応答を確保しないで決定されます。
- 卵を1 mLのシリンジと23ゲージ針3/4inchの読み込みに続いて、角度に下向きに面取り90°の角度で針を曲げるために鉗子を使用しています。気泡が存在しないことを確認してください。
- 一方の側にマウスを置きます。目が突出、鼻に45°の角度で眼球の後ろに容器に100μLを注入しますので、皮膚を引き戻します。
- 針を撤回し、出血を制御するために軽い圧力を適用します。
これらの手順のすべてが慎重に行わなければならない、彼らは麻酔から回復するまでマウスを監視する必要があります。これらのプロトコルは、ペンシルベニア州制度動物ケアの大学によって承認され、委員会(IACUC)を使用していた。
4。実験的な収穫:22日目
- CO 2を持つマウスを安楽死させる。
- ぬれた70%エタノールでマウス、および背面の場所。
- 鈍ゲストフォースドバイを使用して、EPSは、マウスの腹部を把握し、皮膚に小さな切開を行います。慎重にはさみで皮膚を除去し、胸郭と腹膜を公開します。
- 腹膜を開き、カットします。パスツールピペットを用いて血液を回復するために腹部大動脈を切断します。氷上で保管してください。
- ダイアフラムを公開するために肝臓を下に移動します。横隔膜をカットし細かいハサミを使用しています。慎重に肺組織を露出させ胸郭を開いてカット。
- 微細な鉗子で肺をドレイン摘除リンパ節を回復します。これらは胸腺9のいずれかの側に、胸郭の下に隠れています。 1mLの滅菌媒体中で氷上店(DMEM、10%熱不活化ウシ胎児血清を補充し、100 U / mlペニシリン、100μg/ mlのストレプトマイシン、2mMのL-グルタミン、50μM2 - メルカプトエタノール、Invitrogen社からのすべての使用可能)。
- BALを回復し、組織学的分析のために肺を膨らませるために、気管内挿管を実行する必要があります。側に唾液腺を移動することにより気管を露出し、placi気管の下NG細かい鉗子。細かいハサミを使用して、気管の中央に穴をあけて、肺にチューブを挿入します。手術のスレッドと接続することによってチューブを固定します。
- チューブにPBSで満たされた1 mLのシリンジを接続し、1 mLのPBSで肺を膨らませる。慎重にシリンジで洗浄BALを取得します。氷上で保管してください。
- チューブにPBSで満たされた1 mLのシリンジに4%パラホルムアルデヒド(PFA)を添付して肺を膨らませる。
- チューブを外し、PFAの漏洩を防ぐため手術のスレッドを締めます。
- 慎重に5 mLの4%PFAで50mLのファルコンチューブに肺組織と場所を分析する。
5。回収した組織の準備
- 血清:血液凝固のために30分〜2時間氷上で以下のストレージ、血清を遠心分離(13000×gで/ 10分/ 4℃)により血液から回収される。血清は-20℃で保存されており、サイトカインのELISA または Sに使用することができますマンソン卵抗原特異的IgGアイソタイプELISA法 6、10。
- リンパ節:単一細胞懸濁液を調製し、細胞数は免疫応答の大きさを評価するために使用されています。 Th2細胞の偏光を調べるために、細胞がSで再刺激されている72時間マンソン卵抗原。 Intracellarサイトカイン染色、フローサイトメトリーにより検討することができ、上清を回収し、-20℃で保存できますTh2サイトカインのELISA(IL-4、IL-5、IL-13)6 C。
- BAL:細胞は(400 XG / 5分/ 4℃)でペレット化しています。 BAL液はELISA法によるTh2サイトカインの分析のために回収し、-20℃で保存されています。 BAL細胞数は気道炎症の読み出しとして使用されています。 Diffquik染色に続いて10,000-100,000細胞(500回転/ 5分/ 4°C)のCytocentrifuge製剤は、炎症性浸潤物4の列挙、6が可能になります。また、BAL細胞はフローサイトメトリー6で調べることができます。
- 肺組織:肺組織はSTORです。一晩4℃のED固定組織はパラフィン包埋し、切片と組織学的および免疫蛍光分析のためのスライドにマウントされています。
6。代表的な結果
このプロトコルの詳細は、(i)in vivoでの使用のためのマンソン住血吸虫卵 ( 図1)、(II)増感し、これらの卵を持つマウスに挑戦し、精製、および(iii)肺の炎症反応の検査のために臓器を回復する準備をするために必要なすべての手順を実行します。 in vivoモデルこれは、再現性、強力なTh2の肺の炎症反応を駆動します。これは、BAL細胞数とcytocentrifuge製剤( 図2)によって可視化した気道炎症と好酸球増加によって示されている。 H&E染色肺セクションは、卵誘発性肉芽腫( 図3a)を調べ、肺切片の免疫蛍光染色は、代わりに活性化マクロファージや抵抗などのTh2サイトカイン誘導性遺伝子の可視化を可能にすることができます錫のような分子(RELM)α( 図3b)。抗原特異的CD4 Th2サイトカイン応答は、IL-5、IL-4および抗原刺激摘除リンパ節細胞( 図4)のIL-13 ELISAによって検査されます。
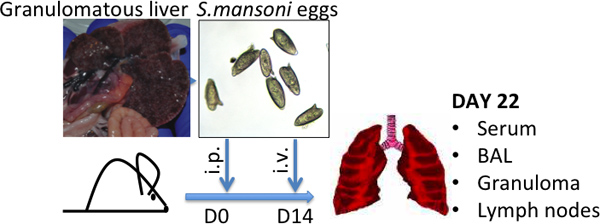
図1はマンソン住血吸虫卵の注入モデル代表高S.mansoni卵負担の特性肉芽腫肝臓の画像、およびS.mansoniの卵が示されている- 。平均サイズ(L)(W)は50μmから120μmの。
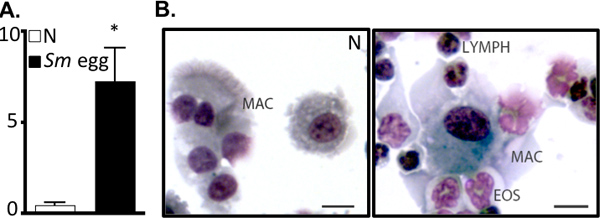
図2。S.マンソンの卵注入、気道の炎症を駆動します。A.ナイーブ(N)またはS.mansoni(SM)卵注入したマウスからのBAL細胞数(×5)。 * P <0.05。 BAL細胞のBのCytocentrifugeの準備。マック、マクロファージ、EOの好酸球、リンパ液、リンパ球。バーは10μm。
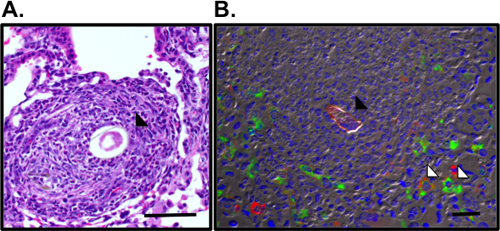
図3肺肉芽腫の可視化とS.mansoni卵を囲む代わりに活性化マクロファージ。A. Smの卵(黒い矢印)を取り囲む肺肉芽腫は、H&E染色肺切片で可視化した。 RELMαのためにB.免疫染色(緑)、マンノース受容体(赤)およびDAPI(青)の自家蛍光のSm卵(黒い矢印)周囲の肉芽腫で交互に活性化マクロファージ(白矢印)を明らかにする。バーは50μm。
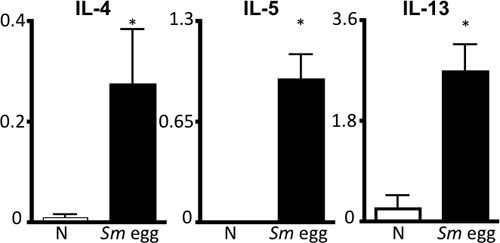
図4。S.mansoni卵抗原特異的Th2サイトカイン応答。卵注入ナイーブ(N) や Smマウスから摘除リンパ節細胞の排水が SMで刺激した</ IL-4の上清のELISA、IL-5およびIL-13に続く72時間のem>卵抗原、。スケール、ng / mLで。* P <0.05。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここでは、2型肺の炎症を誘導するマンソン住血吸虫卵を採用したモデルが記載されています。このモデルの特徴は、強力なTh2免疫応答は、気道の炎症や肺の肉芽腫形成が含まれています。これらのパラメータはCD4 Th2細胞応答を11に依存しているので、これはTh2細胞応答に関するタンパク質固有または系統特異的欠失の影響を調べるために有用なモデルである。ここでは読み出?...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突が宣言されません。
謝辞
この仕事は健康(NIH)AI091759とクローン病とアメリカのウィリアム·アンド·シェルビーModellファミリー財団研究賞(MNまで)の大腸炎財団の国民の協会によってサポートされていました。住血吸虫感染マウスは、NIAID住血吸虫リソースセンター(NIAID契約N01 A130026)によって供給された。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | サイズ/説明 | 会社 | カタログ# |
| コラゲナーゼ/ディスパーゼ | 500 mgの | ロシュ·ダイアグノスティックス | 11 097 113 001 |
| 差分Quikのヘマ3染色 | パック | フィッシャー·サイエンティフィック(株)LLC | 122から911 |
| DMEM | 液体 | ギブコ | 11965 |
| ファルコン50mLを | パック | ファルコン | 352070 |
| Intramedic PEチューブ | 0.58ミリメートル | ベクトン·ディッキンソン·アンド·カンパニー | 427410 |
| イソフルレン | 250 mLの | アボットアニマルヘルス | 52600405 |
| ケタミン | 100 mg / mLの | フォートドッジ、アニマルヘルス | N / A |
| マンノース受容体抗体 | ビオチン | ABD Serotec | MCA2235B |
| 金属製のストレーナー | 標準のキッチンストレーナー | ターゲット | ラウレンティス |
| パラホルムアルデヒド | 16パーセント | 電子Microsc。科学 | 15710 |
| ペニシリン/ストレプトマイシン | 100倍 | ギブコ | 15070 |
| パーコール | 1リットル | GEヘルスケアバイオサイエンス社 | 17 0891 01 |
| RELMα抗体 | 50μgの | Peprotech社製 | 500-P214 |
| 手術のスレッド | 2.0 USP 100ヤード | 手術の専門株式会社 | SP118 |
| 注射針 | 23グラム、3/4インチ | BDバキュテイナラボ。 MED。 | 305143 |
| 米国標準試験ふるい | 150μm以下、0.0059 " | WSタイラー社 | ASTME-11仕様。 100号 |
| キシラジン | 20 mg / mLの | バトラー | N / A |
参考文献
- World Health Organization. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO Technical Report Series 912. , Geneva. (2002).
- Pearce, E. J., MacDonald, A. S. The immunobiology of schistosomiasis. Nat. Rev. Immunol. 2, 499-511 (2002).
- Sandler, N. G. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and th2 responses in tissue repair. J. Immunol. 171, 3655-3667 (2003).
- Perrigoue, J. G. IL-31-IL-31R interactions negatively regulate type 2 inflammation in the lung. J. Exp. Med. 204, 481-487 (2007).
- Sandor, M., Weinstock, J. V., Wynn, T. A. Granulomas in schistosome and mycobacterial infections: a model of local immune responses. Trends Immunol. 24, 44-52 (2003).
- Nair, M. G. Alternatively activated macrophage-derived RELM-{alpha} is a negative regulator of type 2 inflammation in the lung. J. Exp. Med. 206, 937-952 (2009).
- Dalton, J. P. A method for the isolation of schistosome eggs and miracidia free of contaminating host tissues. Parasitology. 115, 29-32 (1997).
- Lewis, F. A. Large-scale laboratory maintenance of Schistosoma mansoni, with observations on three schistosome/snail host combinations. J. Parasitol. 72, 813-829 (1986).
- Tilney, N. L. Patterns of lymphatic drainage in the adult laboratory rat. J. Anat. 109 (Pt. 3), 369-383 (1971).
- Lewis, F. Schistosomiasis. Current protocols in immunology. Coligan, J. E. Chapter 19, Unit 19(2001).
- Kaplan, M. H. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response. J. Immunol. 160, 1850-1856 (1998).
- Wynn, T. A. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat. Rev. Immunol. 4, 583-594 (2004).
- Cheever, A. W. Variation of hepatic fibrosis and granuloma size among mouse strains infected with Schistosoma mansoni. Am. J. Trop. Med. Hyg. 37, 85-97 (1987).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved