このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
臨床試験および筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄の除去
要約
筋萎縮性側索硬化症(ALS)のマウスモデルは、臨床的および行動的に検討されている。付随する免疫組織学的分析のための前提条件として、脊髄の調製は、詳細に描かれています。
要約
筋萎縮性側索硬化症(ALS)は運動ニューロンの進行性変性をもたらす致命的な神経変性疾患である。発症のピークは散発的な疾患および家族性疾患のため50歳前後60歳前後である。その進行性の経過により、患者の50%は、発症から30ヶ月以内に死亡する。この病気のための新たな治療の選択肢を評価するために、ALSの遺伝子のマウスモデルは、そのようなSOD1(G93A)突然変異としてSOD遺伝子の人間の家族の変異に基づいて生成されています。モデルで評価しなければならない最も重要な側面は、全生存期間、臨床経過と運動機能があります。ここでは、臨床評価を示し、二つの行動モーターテストの伝導を示し、すべてのパラメータの定量的なスコアリングシステムを提供しています。 ALSモデルマウスの深さ分析の通常脊髄の免疫組織化学的検査を必要とするため、我々は何を適用する詳細にその準備を実証rsal椎弓切除術の方法。典型的な組織学的所見が実証されています。 ALSのモデルマウスの研究で示され検査法の包括的なアプリケーションは、研究者が確実に後でヒト臨床試験のための基礎を提供することができ、将来の治療オプションをテストすることが可能になります。
プロトコル
動物は、ジャクソン研究所(#002726)1から購入した。それらは臨床的に獲得し、運動機能(ロータロッド試験)と筋力(ワイヤ試験をぶら下げ)の試験に供されています。すべてのこれらの試験や動物の殺害後脊髄を準備するためには、動物実験の適正な実施のためのローカルガイドラインに非常に近くに基づき行われてきた。
1。臨床スコア
別に体重マウスの評価から以下の4点のスコアリングシステム2運動障害の兆候がないか調べられます:
4点:通常(運動機能障害の兆し)
3点:尾によって中断されたときに後肢の震えは明白です
2点:歩行異常が存在
1点:少なくとも一つの後肢のドラッグ
0点:対称麻痺自体右側にできない、または最大体重の20%の損失が、この場合には動物は直ちに安楽死させ、実験が終了した
2。運動機能のテストと筋力
ワイヤーハンギング
このテストは、筋力3、4を評価するために使用されています。すべての動物は、少なくとも1日か2日ロータロッドテストの後にこのテストを実行します。各マウスは0.8 cmの間隔でカスタムメイドの線の蓋の上に置き、慎重に逆さまになっている、藁上に60 cmの底部を覆った。少なくとも180秒の3回連続しての訓練の後に落ちるように遅延が測定されます。各マウスは、180秒の最大かつ最長の期間が記録されているため、反転蓋を保持するには、次の3つの試行までに与えられます。
ロータロッドテスト
ロータロッド装置(ウーゴ·バジーレ、Comerio、イタリア)運動協調性、バランス、運動学習能力3、4を用いて測定した。優れた性能は感覚調整の高い学位を必要とします。マシンがテストされた動物の気を散らす刺激を避けるために、穏やかな、非妨害環境に配置する必要があります。それはコンピュータ制御のモーター駆動回転スピンドルと5匹のマウスのための5つのレーンで構成されています。マウスの滝は下部のプラスチック板に圧力を自動的に検出されます。 15 rpmの一定速度で少なくとも180秒の3回連続しての訓練後、動物は回転棒上に残ることができるの時間が測定されます。各動物は、3つの試験と立ち下がりが記録されずに長い待ち時間を受ける。運動協調性に有意差の大半がこの時間枠内で検出されているため、180秒の時間がカットオフ時間として選択されます。
3。脊髄の準備
- 動物は、地元のガイドラインに従い、CO 2吸入によって殺されており、すぐに4%パラホルムアルデヒド溶液、続いてPBS溶液でtranscardially灌流されています。
- 犠牲にマウスの脊髄を準備するために、動物は、操作テーブルの上に配置され、四肢は、マウスの裏面を露出させるために側に固定されています。
- 70%エタノール溶液で短い洗浄は、解剖部位をきれいにし、髪のコートを平坦化します。
- その後、皮膚は正中線に鋭いメスで切開されています。皮膚を切る容易にするために両側に延伸される。脚の筋肉が準備されなければならない場合は、その皮膚が切開されることもあります。
- 皮膚切開が完了したら、それはボディの基本的な表在筋膜を露出させるピンセットで脇にプルアップされています。
- 首の筋肉と項靱帯を除去しなければならないとCAです。refully用意しました。深く病変脊髄に切開しないように注意してください。肩の筋肉にも優れた脊柱を露出させるために削除することができます。
- その後、傍脊柱筋全体脊柱から削除されます。
- 脊柱を開くためには、いくつかのlaminectomiesは、実行する必要があります。一つは、環椎後頭関節のサイトで上位脳神経の部分から開始する必要があります。
- 上部の2肢の固定を削除し、最初の脊椎の椎弓切除を行うことが良いことができるように首を引き伸ばし過ぎるのが最も簡単です。これらが露出し脊髄に触れずに引き離されています。
- 多くの脊椎は、最初の角度をハサミで両側に脊椎のアーチをtransectingし、背側のプロセスに引いて削除されます。椎骨の残りの側面部分は脊髄の後の完全な除去を容易にするために削除する必要があります。
- 腰部脊椎の解剖学的ランドマークlのコードはまた、頚部脊髄に存在して腫れることがあります。
- 全体脊髄の椎弓切除を終え、あなたもすべての腹根を横断すると髄膜の硬膜から脊髄を解放することを確認してください。
- その後、脊髄は頭側カットとは、脊髄を除去するために開始されています。
- 最後に、脊髄も完全に解放される遠位馬尾·馬尾で切断されています。
- 最終的に、脊髄を一晩postfixating溶液(例えば4%パラホルムアルデヒド)に配置され、さらに処理することができます。我々は通常、免疫組織学的解析のためにそれを準備する脊髄凍結切片。
4。代表的な結果
脊髄の準備のテクニックは、このビデオの記事の焦点を表しています。これは後に組織切片のために、最終的には脊椎の免疫組織学的解析のために必須の前提条件です。lのコードのセクションを参照してください。最終結果の一例として、野生型マウスの腰部脊髄(WT)およびSOD G93Aトランス(TG)マウスの前角領域の免疫組織化学的後処理が実証されています。運動ニューロンは、一次抗ChATの抗体および二次Cy3標識抗体を用いて、後続の蛍光標識を識別することができます。さらに、DAPI(4,6 -ジアミジノ-2 -フェニル)核カウンター染色( 図1)が実行されています。
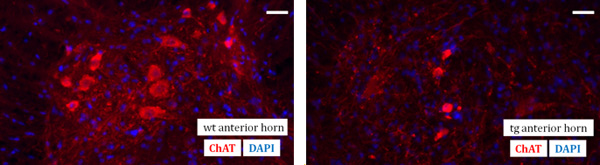
図1抗ChATの抗体(赤)と野生型(WT)マウスの腰部脊髄前角(左側)とのDAPI(青)による細胞核のカウンター染色と運動ニューロンの免疫を可視化する蛍光顕微鏡SOD G93Aトランスジェニック(Tg)(右)130日齢のマウス。スケールバー:40μm以下。
の免疫組織化学的分析などSOD G93Aマウスは、この記事のプライマリスコープではありませんこれらのトランスジェニックマウスが特徴づけられているた元の出版物、さらに、参照1、5、6のために治療法を勉強し、より最近のものを参照してください。治療効果が明確に定義された免疫組織学的レベルで区別されなければならない場合、定量的な評価アルゴリズムは、立体的なソフトウェア(例えば、7を参照)でサポートされて適用されるべきである。
ディスカッション
SOD1(G93A)の遺伝的マウスモデルはヒトの筋萎縮性側索硬化症8に匹敵する進歩的な運動ニューロン損失の疾患経過を研究する貴重な動物モデルである。異なる治療パラダイムの様々なこのモデルでは評価され、後で人間の臨床試験8-10にテストするための基礎を表すされています。これらのマウスの実験的治療の研究では有意差を検出することができるようにするためには、?...
開示事項
利害の衝突が宣言されません。
謝辞
LTは、大学医学部ゲッティンゲンForschungsförderungsprogrammから助成金を受けています。 PLとMBは脳の分子生理学(CMPB)、ゲッティンゲンのためのDFG研究センターによってサポートされていました。著者らは、オーディオとビデオ編集のヘルプのためのビデオ撮影とビルギットLiebauの支援については博士ラースTatenhorstに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| メーカー | オーダ情報 | ||
| 行動実験 | |||
| マウス用ロータロッド | ウーゴ·バジーレ、Comerio、イタリア | #47600 | |
| Wireデバイスをぶら下げ | カスタムメード | ||
| 脊髄の準備 | |||
| 演算表 動作ランプ 保護手袋 | |||
| 側に角度 "アイリス"はさみ、 | ファイン科学ツール、ハイデルベルク、ドイツ | 14063から09 | |
| コーハン-Vannas春のはさみ、ストレート | ファイン科学ツール、ハイデルベルク、ドイツ | 15000から10 | |
| マイクロ鉗子 | Hammacher、ゾーリンゲン、ドイツ | HWC 111から10 | |
| メス "präzisaプラス" | Dahlhausen、ケルン、ドイツ | 11.000.00.510、図10 | |
参考文献
- Gurney, M. E. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Weydt, P. Assessing disease onset and progression in the SOD1 mouse model of ALS. Neuroreport. 14 (7), 1051-1054 (2003).
- Crawley, J. N. Behavioral phenotyping strategies for mutant mice. Neuron. 57 (6), 809-818 (2008).
- Miana-Mena, F. J. Optimal methods to characterize the G93A mouse model of ALS. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 6 (1), 55-62 (2005).
- Zhong, Z. Activated protein C therapy slows ALS-like disease in mice by transcriptionally inhibiting SOD1 in motor neurons and microglia cells. J. Clin. Invest. 119 (11), 3437-3449 (2009).
- Pitzer, C. Granulocyte-colony stimulating factor improves outcome in a mouse model of amyotrophic lateral sclerosis. Brain. 131 (Pt. 12), 3335-3347 (2008).
- Gowing, G. Ablation of proliferating microglia does not affect motor neuron degeneration in amyotrophic lateral sclerosis caused by mutant superoxide dismutase. J. Neurosci. 28 (41), 10234-10244 (2008).
- Scott, S. interpretation of studies in the standard murine model of ALS. Amyotroph Lateral Scler. 9 (1), 4-15 (2008).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Corse, A. M. Preclinical testing of neuroprotective neurotrophic factors in a model of chronic motor neuron degeneration. Neurobiol Dis. 6 (5), 335-346 (1999).
- Knippenberg, S. Significance of behavioural tests in a transgenic mouse model of amyotrophic lateral sclerosis (ALS). Behav Brain Res. 213 (1), 82-87 (2010).
- Burgess, R. W., Cox, G. A., Seburn, K. L. Neuromuscular disease models and analysis. Methods Mol. Biol. 602, 347-393 (2010).
- Hayworth, C. R., Gonzalez-Lima, F. Pre-symptomatic detection of chronic motor deficits and genotype prediction in congenic B6.SOD1(G93A) ALS mouse model. Neuroscience. 164 (3), 975-985 (2009).
- Ludolph, A. C. Guidelines for preclinical animal research in ALS/MND: A consensus meeting. Amyotroph Lateral Scler. 11 (1-2), 38-45 (2010).
- Boillee, S. Onset and progression in inherited ALS determined by motor neurons and microglia. Science. 5778 (3), 1389-1392 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved