このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Tリンパ球に向かって誘導多能性幹細胞の分化の指示
要約
人工多能性幹(iPS)細胞からTリンパ球の生成は、T細胞ベースの免疫療法のために胚性幹細胞を使用する代替アプローチを提供します。メソッドは、どちらを利用することによってことを示しています in vitroでまたは誘導システムでは、iPS細胞は従来、抗原特異的Tリンパ球の両方に分化することができます。
要約
抗原特異的CD8 +細胞傷害性Tリンパ球(CTL)の養子細胞移植(ACT)は、悪性腫瘍の1様々な有望な治療法です。 CTLは、悪性細胞を殺すためにT細胞受容体(TCR)、およびリリース毒素だけでなく、サイトカインと腫瘍抗原を作用することにより悪性腫瘍細胞を認識することができます。これは、これらのCTLは、高い増殖能を持っているより分化した細胞よりもアポトーシスが少ない傾向があると持っているのであまり差別化( 高反応性と呼ばれる)は、中央メモリのようなCTLは、ACT-ベースの免疫療法に最適な集団であることが知られている恒常性サイトカイン2-7に応答する能力が高い。しかし、患者からこのようなCTLの高い数値を得ることが困難なため、成功したACT-ベースの治療のために反応性の高い銀特異的CTLを生成するための新しいアプローチを見つけることが急務である。
自己再生幹細胞のTCR伝達免疫再構築のための細胞が病気8月10日の治療のための治療可能性を秘めています。しかし、患者から胚性幹細胞(ESCは)を取得するためのアプローチは現実的ではありません。治療目的のための造血幹細胞(HSC)の使用は広くクリニック11-13に適用されていますが、造血幹細胞は、分化と増殖能力が低下していると、造血幹細胞は 、in vitro細胞培養14-16で展開することが困難である。最近のiPS細胞技術と遺伝子送達のためのin vitro系の開発は、すべての外科的アプローチせずに患者からiPS細胞を生成することができる。さらに、ESCのように、iPS細胞は 、in vitro で無限増殖能を有しており、造血細胞に分化することが示されている。このように、iPS細胞は、ESCのまたは造血幹細胞に比べ、ACTベースの免疫療法で使用される大きな可能性を持っています。
ここでは、Tリンパ球を生成するための方法を提示in vitroで 、やiPS細胞からの抗原特異的CTL の in vivoでのプログラミングにおける癌免疫監視を促進するためのiPS細胞からcytes。 Notchリガンドのin vitroでの刺激は、iPS細胞からT細胞分化を駆動し、腫瘍の増殖を防ぐことが生体内で抗原特異的T細胞に分化するiPS細胞のTCR遺伝子導入の結果。したがって、私たちは、iPS細胞からの抗原特異的T細胞の分化を示しています。我々の研究では、ACT-ベースの治療のための抗原特異的CTLを生成するための潜在的に、より効率的なアプローチを提供し、疾患の治療戦略の開発を容易にします。
プロトコル
1。細胞培養
- 培養のための(irSNL76 / 7)SNL76 / 7照射フィーダー細胞の調製。
SNL76 / 7細胞は、一般的に10%ウシ胎児血清(FBS)を添加したダルベッコ改変イーグル培地(DMEM)培地中で維持されます。- 液体窒素からSNL76 / 7細胞を回収する前に30分間インキュベーター、培養皿またはフラスコを、37の0.1%ゼラチン溶液°Cで被覆されています。
- SNL76 / 7細胞がコンフルエントに達したときに、細胞をトリプシン処理し、オフで5分間400gで遠心分離し、新鮮な培地に再懸濁される。
- 再懸 濁しSNL76 / 7細胞は5000ラドの線量の60 Coの照射で照射されます。
別のアプローチは、SNL76 / 7細胞は、マウス胚線維芽細胞(MEF)で置き換えることができますし、マイトマイシン-不活性化は、照射を置き換えることができます。 - 照射後、細胞を5分間400gで遠心分離され、10%ジメチルスルホキシド(DMSO)FBS凍結緩衝液に再懸濁し、アリコートにcryovialsと将来の使用のために液体窒素中で保持されます。
- in vitro分化のためにOP9-DL1細胞の調製。
OP9-DL1細胞は一般に20%FBSα最小必須培地(α-MEM)培地中で維持されます。彼らはコンフルエントの細胞に到達したときに1:5希釈で分割されます。 - E.G7胸腺腫細胞の調製。
E.G7胸腺細胞は、一般的に10%FBSロズウェルパーク記念研究所培地(RPMI)-1640媒体に保持されます。彼らがコンフルエントに達したときに、細胞を1:10希釈で分割されます。 - iPS細胞とTCR-形質iPS細胞の一般的なメンテナンス。
- 培養皿は、irSNL76 / 7フィーダー細胞を先に回収するか、iPS細胞の分割の一日を播種前に30分間37°C、0.1%ゼラチン溶液でコーティングされます。
- iPS細胞の分割のために、細胞を5分間400gで遠心分離し、トリプシン処理し、オフされ、15%FBS DMEM培地に再懸濁した。
- トリプシン処理のiPS細胞を37で30分間、新鮮な培養皿上でインキュベートされます。°Cインキュベーター分化した細胞と残フィーダー細胞を除外するために、新鮮なirSNL76 / 7フィーダー細胞プレコート皿に播種前に。
- インキュベーション後、4×10 6細胞は、100ミリメートル培養皿に播種されます。
(2)in vitroでのプログラミングの
- in vitroで共培養システムである 。
- 0日目で、5×10 4 iPS細胞は20%FBSα-MEM培地でコンフルエントOP9-DL1の細胞単層を含む100ミリメートル培養皿上に播種されます。
- 3日目に、培地を新鮮なものに変更されます。
- °Cインキュベーター37の30分間新鮮な100ミリメートル培養皿上でインキュベートする前に、5日目に、細胞をトリプシン処理し、オフされ、5分間400gで遠心分離した。
- 浮遊細胞を回収し、カウントされ、5×10 5細胞は、新鮮な培養に転送されます。20%FBSα-MEM培地でコンフルエントOP9-DL1の細胞単層を含んでいる皿。サイトカインはmFlt-3L(最終濃度:5 ng / mL)の文化の中で追加されます。
- 8日目で、緩く接続された細胞はそっとピペットされます。
- 10 mLのPBS部分的に分化したiPS細胞の最大の回復を取得する1つのより多くの時間とOP9-DL1供給層を洗浄します。
- 共培養から細胞を採取した後、細胞を5分間400gで遠心分離され、mFlt-3L(5 ng / ml)およびMIL-7(1 ng / mL)を補充した20%FBSα-MEM培地に再懸濁した。
- 細胞がコンフルエントにOP9-DL1細胞で被覆された6ウェル培養プレートに転送されます。通常、1つの100 mmの培養皿から回収したiPS細胞は6ウェルプレートの1ウェルに転送されます。
- 10日目から、培地(20%FBSα-MEM培地supplemente隔日で変更されますmFlt-3L(5 ng / ml)およびMIL-7(1 ng / mL)を)とD。
- 培養プレートは、OP9-DL1細胞はフィーダー細胞の成長に応じて4-6日に変更されるフィーダーで被覆された。
- 部分的に分化したiPS細胞の in vivo成熟である 。
- 30分間、37℃で共培養22日目に、iPS細胞は、トリプシン処理し、オフされる5分間400gで遠心分離し、新鮮な培養皿で培養した。
- 浮遊細胞を回収し、マウスに肺塞栓症を引き起こす可能性があり、細胞塊を除外するために70μmのナイロンストレーナーを通過し、冷PBSで3回洗浄されます。
- 細胞は1.5×10 7細胞/ mLの濃度でPBSに再懸濁しされます。
- 細胞は、注射前に氷の上で維持されます。
- 尾静脈を介して静脈内注射する前に、マウスは、その尾静脈を拡張するために赤外光の下に置かれます。
- 静脈Dの後にilatation、200μlの細胞懸濁液または3×10 6細胞を養子に尾静脈から4週齢のB6.129S7-RAG1 tm1Mom / Jマウスに転送されます。三週間は部分的に分化したiPS細胞の in vivo成熟のために許可されています。
- 評価。
- 分化した細胞と細胞の回収率の形態変化図1。
- OP9-DL1細胞と共培養の異なる日に、生細胞画像は、従来の顕微鏡下で撮影されます。
- 細胞の回収率は、培養液から採取した細胞の数に基づいて計算されます。
- 表面マーカーの変化をフローサイトメトリー分析。 図2a。
- 共培養の異なる日に、細胞をトリプシン処理により培養液から除去され、細胞表面の染色に進む前に、冷PBSで洗浄した。
- ウィットを染色する前に、hの異なる蛍光色素標識抗体は、細胞を20分間、4℃でFCブロッカー24G2によってブロックされます。
- 4°Cで20分間染色後、細胞をフローサイトメトリー検査の前に冷PBSで3回洗浄されます。
- in vitroで分化したiPS細胞での活性化。 図2b。
- 活性化アッセイの前に一日、プレコート抗CD3で24ウェルプレート(最終濃度:4μg/ mLで、PBS)で4℃で一晩。
- 共培養22日目に、iPS細胞由来のT細胞は、培養物から収穫され、プレートコーティング抗CD3および可溶性抗CD28抗体(最終濃度:4μg/ mLの)で刺激する前に、冷PBSで洗浄した。
- インキュベーションは、40時間37℃でC、5%CO 2インキュベーターを実施し、その後さらに4時間培養に追加されますBefeldinされます。
- 共培養の終了時に、細胞が高調になります既得洗浄し、そして上記のようにFcのブロッカーによってブロックされます。ブロックされた細胞は、蛍光色素標識抗体を用いてCD8およびTCRVβ鎖のような表面マーカーに染色されます。
- 細胞表面の染色後、細胞を4%パラホルムアルデヒドを使用して固定され、Biolegendの浸透化キットを使用して透過。
- 透過した後、IL-2とIFN-γのような細胞内の分子は、蛍光色素標識抗体を用いて染色されます。
- 最後のフローサイトメトリー検査の前に、細胞が過剰な抗体を除外する冷PBSで3回洗浄されます。
- -マウスRAG-/で成熟。
- in vivoでの開発での3週間後、RAG-/ -マウスは、犠牲にされるであろう脾臓およびリンパ節は、マウスから削除されます。
- 単一の細胞は機械的な故障によって処理されます。赤血球はACK溶解緩衝液を用いて溶解され、mononucleocytesを収集し、冷PBSで2回洗浄されます。
- 洗浄後、細胞を20分間、4℃でFCブロッカー24G2でブロックされ、ブロッキングの終了時に、細胞は異なる蛍光色素標識抗CD3、抗CD4、抗CD8及び抗TCRβ抗体で染色したされます。 4℃で20分間。
- 染色の終わりに、細胞をフローサイトメトリー検査の前に冷PBSで3回洗浄されます。
- 分化した細胞と細胞の回収率の形態変化図1。
(3)in vivoでのプログラミングの
- レトロウイルス構築物の生成。
- MSCV-IRES-DsRedを(もさ)ベクトルは、DsRedの遺伝子とGFP遺伝子を置き換えることによって、MSCV-IRES-GFPベクターに基づいて構築されています。
- OT-I T細胞受容体遺伝子はOT-I/MiDRを構築するためにmidrですベクターにサブクローニングされています。
- レトロウイルス形質導入と細胞選別。
- PLAT-Eパッケージング細胞にAReは、次の伝達に使用されることを偽を生成するために使用される。
- 3×6 PLAT-E細胞はトランスフェクションの前に100 mmの培養皿一日に播種されています。
- 0日目に、PLAT-E細胞はGeneJammaトランスフェクション試薬を用いてプラスミドmidrです私は、-OTをトランスフェクトされます。
- 1日目に、1×10 6 iPS細胞は、0.1%ゼラチンプレコート24ウェルプレートの1ウェルに播種されます。
- 2日目に、PLAT-Eの培養液から偽含む上清は、潜在的な汚染物質を除外するフィルター0.4μmのを介して収集して渡されます。
- 伝達は、5μg/ mlのポリブレンの存在下で1時間1400 rpmで32℃遠心分離の条件で実行されます。
- 遠心ベースの導入後、細胞を32℃、一晩5%CO 2インキュベーター内に配置されます。
- 3日目、2日目TRAを繰り返す上記のようにnsduction手順。 6ウェルプレートは、将来の使用のためにirSNL76 / 7フィーダー細胞でプレコートされます。
- 4日目に、iPS細胞を5分間400gで遠心分離し、プレコートirSNL76 / 7フィーダー細胞上に播種し、オフトリプシン処理されます導入。
- コンフルエントで、細胞をトリプシン処理し、オフ5分間400gで遠心分離し、細胞選別のために処理されます。 GFPとDsRedの二重陽性細胞はMoFloのセルソーターでソートされます。ソートした細胞は、将来の使用のためにirSNL76 / 7フィーダー細胞上で培養されます。
- PLAT-Eパッケージング細胞にAReは、次の伝達に使用されることを偽を生成するために使用される。
- 養子免疫伝達および腫瘍の挑戦。
OT-I TCRは、上述したようにIPS(OT-I/iPS)細胞は、一般的にirSNL76 / 7フィーダー細胞上で維持される形質。- 移入の日に、OT-I/iPS細胞は、トリプシン処理をオフされている5分間400gで遠心分離し、新鮮な培地に再懸濁した。
- ℃のインキュベーターが分化した細胞を排除するために必要とされる37の新鮮な培養皿上で30分インキュベーションと残存フィーダー細胞。
- インキュベーションの終わりに、浮遊細胞を5分間400gで収集し、遠心分離されます。
- 細胞ペレットを3回冷PBSで洗浄され、細胞は細胞塊(2Xろ過)を除外するには、2つの洗浄の間に70μmのナイロンストレーナを通過されます。
- 1.5×10 7細胞/ mlの濃度で洗浄後、細胞をカウントされ、冷PBSに再懸濁した。
- 細胞は、注射前に氷の上で維持されます。
- 養子転送のために、4-6週齢の雌のC57BL/6Jマウスが使用されます。尾静脈を介して静脈内注射する前に、マウスの尾静脈を拡張するために赤外光の下に置かれます。
- 静脈拡張した後、200μlの細胞懸濁液または3×10 6細胞を養子尾静脈を介して転送されます。 OT-I TCR の in vivo成熟に iPS細胞を形質導入は6週間が許可されます。
- 静脈内注射の6週間後、4×10 6 E.G7胸腺細胞は腹腔内に接種されます。
- E.G7胸腺細胞は、培養液から採取し、PBSで3回洗浄されます。
- 洗浄の最後に、細胞を8×10 7細胞/ mlの濃度で冷PBS中に懸濁される。
- 50μlの細胞懸濁液または4×10 6細胞を腹腔内に注入されます。
- 評価。
- in vitroでの OT-I TCRの特徴は、iPS細胞を形質導入した。
- DsRedの蛍光顕微鏡検査では、GFPの二重陽性細胞は未固定の生細胞を用いた従来の蛍光顕微鏡下で実行されます。
- 遺伝子の統合と発現は、PCRおよびRT-PCR解析の両方で分析されます。
- 細胞のDNAまたはRNAは、QiagenのDNAまたはを使用したサンプルとは別に隔離されますRNA分離キット。
- PCRおよびRT-PCRは、特にTCRVβ5鎖の組換えVDJ領域を認識するプライマーを用いて実行されます。
- T細胞の発達と成熟。 図3a。
- 2週目、4と6のポストセル転送、動物を犠牲にされ、脾臓、リンパ節は、動物から削除されます。
- 単一細胞懸濁液は機械的な故障を通じて行われる。赤血球を回収し、冷PBSで2回洗浄されるACK溶解緩衝液およびmononucleocytesを使用して溶解される。
- 洗浄後、細胞を20分間、4℃でFCブロッカー24G2でブロックされ、ブロッキングの終了時に、細胞を20分間4の異なる蛍光色素標識抗体°Cで小分けし、染色されます。
- 染色の終わりに、細胞をフローサイトメーターでロードする前に、冷PBSで3回洗浄されます。
- ペプチド刺激。 図3b。
- 腫瘍チャレンジの50日に、動物を屠殺され、脾臓、リンパ節は、動物から削除されます。
- 単一細胞懸濁液は機械的な故障を通じて行われる。赤血球を回収し、冷PBSで2回洗浄されるACK溶解緩衝液およびmononucleocytesを使用して溶解される。
- CD8 + T細胞は、Miltenyi Biotec社のCD8 + T Cellアイソレーションキットを使用して隔離されます。隔離されたCD8 + T細胞を1:10の割合でナイーブC57BL/6Jマウスから単離されたおよび0.5マイクロモル/ mlのOVAで40時間257から264ペプチドをパルス照射した脾細胞と混合されます。その後、ブレフェルジンは、さらに4時間培養に追加されます。
- 共培養の終了時に、細胞は、上述のように洗浄およびFcブロッカーによってブロックされ、収穫されます。
- ブロックされた細胞は、表面のマークのために染色されます。蛍光色素標識抗体を用いてCD8およびTCRVβ5チェーンとしてERS。
- 細胞表面の染色後、細胞を4%パラホルムアルデヒドを使用して固定され、細胞透過キットを使用して透過。
- 透過した後、IL-2とIFN-γのような細胞内の分子は、蛍光色素標識抗体を用いて染色されます。
- 最後のフローサイトメトリー検査の前に、細胞が過剰な抗体を除外する冷PBSで3回洗浄されます。
- in vivoでアッセイを殺す。 図3Cは、。
- ナイーブC57BL/6Jマウス由来の脾細胞を単離し、標的細胞としてカルボキシフルオレセインスクシンイミジルエステル(CFSE)で標識されます。
- 0.5マイクロモル/ mlのCFSE(CFSE LO細胞)で標識された10μg/ mlのOVA 257から264ペプチドと細胞がパルスされることはありませんが5モル/ mlのCFSE(CFSEのハイ細胞 )で標識した細胞がパルスされます。
- 2.5×10 6 CFSEのハイテク細胞の混合物に加え、2.5×10 6 CFSE LO細胞は養子指定されたレシピエントに静脈注射することにより転送されます。
- 16時間後、これらのマウスから脾細胞を単離され、CFSE +の細胞はフローサイトメトリーによって分析されます。
- 腹腔内腫瘍細胞数図4。
腫瘍の挑戦20日目に、マウスを屠殺され、腹腔洗浄を冷PBSを用いて実行されます。腹腔洗浄は、腫瘍細胞がカウントされ回復した。 - 腫瘍はT細胞の識別を浸透させる。 図5。
- 腫瘍の挑戦の後期段階では、マウスを屠殺され、腫瘍は、異なるグループから腹膜腔から削除されます。
- 腫瘍が粉々にカットされます。ワンピースはクライオバイアルに入れ、直ちにドライアイス上に配置され、残りの半分はのためで修正される予定maldehyde 3枚目は、将来の使用のためにエアコンRPMI-1640培地中で維持されます。
- H&E染色は、ホルムアルデヒド固定およびパラフィンラップサンプルから一般的なプロトコルに従って実行されます。
- 免疫蛍光染色は、凍結保存サンプルで実行されます。
- 組織切片、使用前に-20℃で保存されます。
- 組織切片を空気が15分15分冷アセトン固定前に乾燥されます。
- 固定後、切片は5分PBSの洗浄前に、別の15分間乾燥した空気となります。
- 湿室で洗浄、場所のスライドの後、非特異的結合をブロックするために30分間、PBS中の30μlの3%BSAで組織切片をカバーしています。
- ブロッキングの終了時に、ブロッキングバッファーをオフブロットおよび3%BSAで希釈したPE-抗TCRVα2抗体およびFITC-抗OVA抗体50μlの混合物で組織切片をカバーPBSインチ
- 2時間湿室やインキュベーションの終わりにインキュベートし、スライドを冷PBSで3回洗浄し、蛍光顕微鏡検査前に水ベースの取り付けメディアでマウントされます。
- 腫瘍浸潤T細胞のフローサイトメトリー分析。
- 腫瘍は、単一の細胞懸濁液と赤の血液細胞に押しつぶされたとなるACK溶解緩衝液により溶解されます。
- 洗浄およびブロッキング後、細胞を特異的に細胞表面に発現CD8、TCRVα2とTCR Vβ5分子を認識する別の蛍光色素標識抗体で標識されます。
- マウスの生存率図6。
腫瘍チャレンジ後、マウスの生存率は注意深く監視されます。
- in vitroでの OT-I TCRの特徴は、iPS細胞を形質導入した。
4。代表的な結果
CD3およびTCRβは、Tのマーカーとして使用されている細胞。 NotchリガンドDL1とiPS細胞の刺激はT細胞の分化に寄与することができ、私たちはiPS細胞由来の細胞にCD3の発現およびTCRβ+を評価し 、さらにCD4とCD8の発現を解析し、CD3のゲーティング+およびTCRβ+かどうかを確認するには人口。 CD8 +シングルポジティブ(SP)T細胞はin vitroでの iPS細胞から生成された-として22日目、CD3 +TCRβ+ CD4に、ここに示されている。さらに、iPS細胞由来のSP細胞はIL-2を生成することができたとIFN-γのiPS細胞が由来を示唆する( 図2)プレートコーティング抗CD3および可溶性抗CD28抗体によるin vitroで刺激するとT細胞は機能しています。
レシピエントマウスに養子移入した後、TCRの大半は、iPS細胞はCD8への分化を受けた+ SEでペプチド刺激に対するin vitroで反応CTLを、遺伝子導入IL-2 cretingとIFN-γ( 図3)。最も重要なのは、TCR-導入、iPS細胞の養子移入は、腫瘍の課題( 図5-6)からの腫瘍組織や保護動物にOVA反応性CTLの浸潤を引き起こした。したがって、TCR遺伝子は形質iPS細胞は、 生体内で機能的な抗原特異的CTLに分化することができる。

図1:iPS細胞の分化の形態。様々な日で、マウスのiPS細胞は、20%FCS、5 ng / mlのmFlt3L、1 ng / mlのMIL-7の存在下で2.2グラム/ L重炭酸ナトリウムを添加したα-MEM培地でOP9-DL1細胞と共培養した。
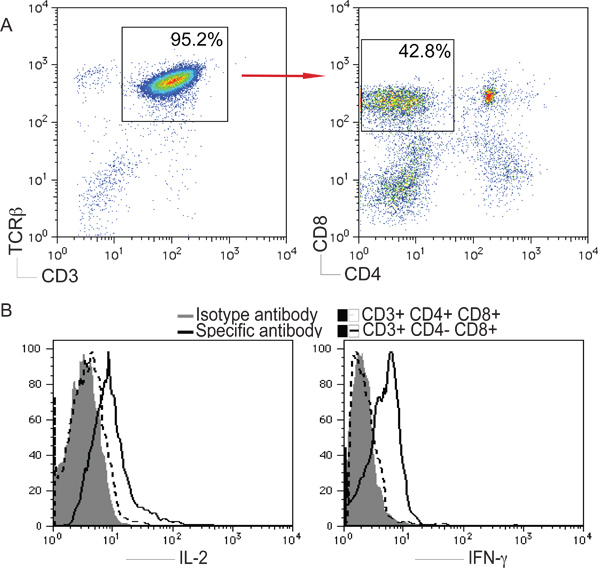
図2のiPS細胞からT細胞の分化。 図1で説明したように、マウスのiPS細胞はOP9-DL1細胞と共培養した。 dのAY 22は、iPS細胞由来の細胞を単離し、分析した。 )CD4 + CD8 -あるいはCD4 - CD8 + CD3のゲーティング後の細胞+およびTCRβ+集団。 B)細胞は、5%CO 2で37℃で5時間プレートコーティング抗CD3および可溶性抗CD28抗体で刺激した。 CD8 + T細胞- IL-2とIFN-γは、ライブCD4のゲーティングした後、細胞内染色により分析した。
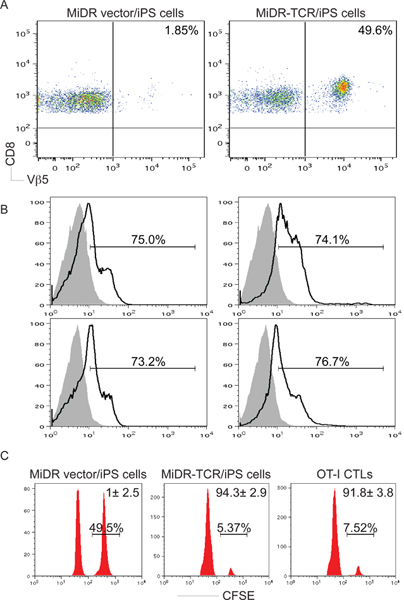
図3:in vivoでのiPS細胞からの抗原特異的CD8 + T細胞の開発。 OT-I TCR遺伝子導入iPS細胞はC57BL / 6マウスに静脈注射した。六から十週間後、OVA特異的CD8 +Vβ5+ T細胞の開発が決定した。プールされたLNSと脾臓から)CD8 +Vβ5+ T細胞は、Cのゲーティングした後、フローサイトメトリーによって分析したD8 +集団。 B)IL-2とIFN-γ産(ダークライン、網掛け部分は、アイソタイプコントロールを示す)はCD8 +Vβ5+集団のゲーティングした後、細胞内サイトカイン染色によって決定した。 C)in vivoでの増殖/細胞毒性アッセイでは 。 CFSE HI(右ピーク)とCFSEのLO(左ピーク)標的細胞は、それぞれOVA 257から264ペプチドおよび制御でパルスされ、10週間のiPS細胞の転送またはOT-I CTL転送後1日後にマウスに注入した。

図4:OT-I TCR遺伝子導入、iPS細胞の養子移入は、腫瘍の成長を抑制します。 OT-I TCR遺伝子導入iPS細胞は養子C57BL / 6マウスに移した。マウス1つのグループは、OT-I TCからOVA反応性CD8 + T細胞を注入したRトランスジェニックマウス、およびマウスのいずれかのグループには、セル転送がありませんでした。どちらの6週間後またはセル転送した後、次の日に、マウスはG7 E.腫瘍細胞と挑戦して行った。 20日目に、腹腔内に腫瘍細胞が列挙された。
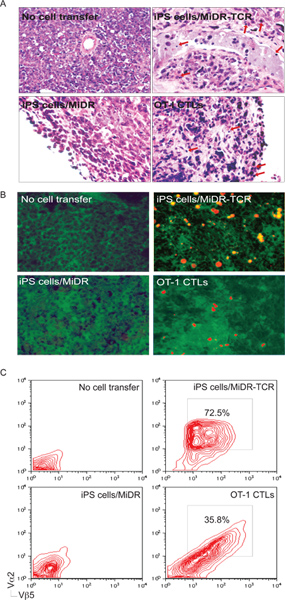
図5のiPS細胞由来の抗原特異的CTLは腫瘍組織に浸潤する。腫瘍チャレンジ後の日30から35に、腫瘍組織、腫瘍反応性T細胞の浸潤を検討した。 A)H&E染色。炎症細胞は、腫瘍組織(↓)に浸潤していた。 B)免疫組織化学的染色。 OVA発現腫瘍組織(緑)に浸潤し、OVA特異的CTLVα2+(赤)。 C)腫瘍組織からの単細胞懸濁液は、CD8 +集団のゲーティングした後、フローサイトメトリーによってVα2の表現+とVβ5+について分析した。
図6。OT-I TCR遺伝子導入、iPS細胞の養子移入は、マウスの生存率を維持します。 OVA TCR iPS細胞は養子図で説明したようにE. G7腫瘍細胞に挑戦するために供したC57BL / 6マウスに転送された遺伝子は、形質。 4。 50日のマウスの生存率はKaplan-Meier生存曲線(N = 6)で示された。
ディスカッション
ACT-ベースの治療のために、in vivoでの再注入のための反応性の高い銀特異的T細胞の多数の in vitro生成の最適なアプローチです。私たちのin vitro法では、iPS細胞、iPS細胞由来の細胞は、特に4週目、4週間で死亡し、多数のより機能的なT細胞の増加を与えるが。我々は、ノッチからの生存信号がDL1と同様にIL-7とFLt3LがiPS細胞由来の前駆T細胞の生存を維持する...
開示事項
利害の衝突が宣言されません。
謝辞
我々は、OT1-2A•pMig II構造、博士はファンをサポートするためのIPS-MEF-NG-20D-17細胞株は、博士ダリオVignali(セントジュード小児研究病院)を提供するための博士山中伸弥(京都大学)に感謝本研究の設計を支援するためのカルロスOP9-DL1のセルラインをサポートするためのスニガ-Pflucker(免疫学教室、トロント大学)、博士ケントEブラーナ(薬理学教室医学のペンシルベニア州立大学)。このプロジェクトは、国立がん研究所、Barsumian信頼とメラノーマ研究財団(J.の歌)からのグラント番号K18CA151798の助成のもと、運営されている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| C57BL/6Jマウス | ジャクソン研究所 | 000664 | |
| B6.129S7-RAG1 tm1Mom / J | ジャクソン研究所 | 002216 | |
| 抗CD3(2C11)抗体 | BD PharMingen社 | 553058 | |
| 抗CD28(37.51)抗体 | BD PharMingen社 | 553295 | |
| 抗CD3(17A2)抗体 | BioLegend | 100202 | |
| 抗CD4(GK1.5)抗体 | BioLegend | 100417 | |
| 抗CD8(53から6.7)抗体 | BioLegend | 100714 | |
| 抗CD25(3C7)抗体 | BioLegend | 101912 | |
| 不定冠詞TI-CD44(1M7)抗体 | BioLegend | 103012 | |
| 抗CD117(2B8)抗体 | BioLegend | 105812 | |
| 抗TCR-β(H57597)抗体 | BioLegend | 109220 | |
| 抗IL-2(JES6-5H4)抗体 | BioLegend | 503810 | |
| 抗IFN-γ(XMG1.2)抗体 | BioLegend | 505822 | |
| DMEM | インビトロジェン | ABCD1234 | |
| α-MEM | インビトロジェン | A10490-01 | |
| FBS | ハイクローン | SH3007.01 | |
| ブレフェルジン | シグマ | B7651 | |
| ポリブレン | シグマ | 107689 | |
| GeneJammer | 統合された科学 | 204130 | |
| RNAキット | キアゲン | 74104 | |
| DNAキット | キアゲン | 69504 | |
| CD8アイソレーションキット | ミルテニーバイオテク | 130-095-236 | |
| ACK溶解緩衝液 | ロンザ | 10-548E | |
| mFlt-3L | ぺプロ | 250-31L | |
| MIL-7 | ぺプロ | 217から17 | |
| ゼラチン | シグマ | G9391 | |
| FITC-抗OVA抗体 | ロックランドのImmunochemicals | 200-4233 | |
| 透過バッファ | Biolegend | 421002 | |
| BSA | シグマ | A7906 | |
| ホルムアルデヒド | シグマ | F8775 | |
| 0.4μmのフィルター | ミリポア | ||
| Mofloセルソーター | 岳サイトメー | ||
| ソウルキャリバーフローサイトメーター | BD | ||
| LSR IIフローサイトメーター | BD | ||
| マウス制止する | トリーサイエンティフィック |
参考文献
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K., Med, N. .. E. n. g. l. .. J. .. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved