このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Adenovirally形質分離されたげっ歯類膵島におけるレプリケーションおよびβ細胞機能を評価する
要約
このプロトコルは1つが糖尿病の治療のための潜在的な治療標的を見つけるために機能的なβ細胞量を調節する因子を同定することができます。プロトコルは、アデノウイルスによる遺伝子発現の操作後に膵島の複製と分離されたラット膵島のβ細胞機能を評価するための効率的な方法で構成されています。
要約
グルコース恒常性は、主にそれぞれ、膵臓のβとα細胞から分泌され、内分泌ホルモンのインスリンとグルカゴンによって制御されます。機能β細胞塊を解剖ベータ細胞塊など栄養素の負荷に対応するβ細胞の能力によって決定されます。機能β細胞量の減少は、糖尿病1-3の両方の主要な形態の中心となります。 1型糖尿病の自己免疫攻撃から減少し、機能β細胞塊の結果に対し、2型糖尿病では、この減少は、適切なインスリンを分泌するβ細胞の無力とメカニズムの幹部からベータ細胞の破壊の両方から開発しています。従って、機能β細胞量を復元するための努力は、より良い治療と糖尿病の潜在的な治療に最も重要なことです。
努力は複製を刺激し、β細胞の機能を強化するために悪用される可能性が分子経路を特定するために進行中です。理想的には、治療の目標は、β細胞の増殖と機能の両方を向上させるだろう。しかしおそらくもっと重要なβ細胞の増殖を刺激する戦略は、β細胞機能(例えば、いくつかの遺伝子と同様に)、およびその逆を損なうことの代償かどうかを識別することである。
単離したラット膵島 における標的遺伝子の発現を体系的に抑制または過剰発現することによって、人が増えて、機能のベータ細胞塊4-6の潜在的な治療標的を識別することができます。アデノウイルスベクターは、単離されたラット膵島4,7-15で効率的に過剰発現やノックダウンの蛋白質に用いることができる。ここでは、アデノウイルス形質導入を利用して遺伝子発現を操作し、膵島の複製と分離されたラット膵島 のβ細胞機能( 図1)を評価する手法を提案する。このメソッドは、β細胞の複製または関数5,6,8,9,16,17を調節する新たな標的を識別するために以前に使用されています。
プロトコル
1。ラット膵島のアデノウイルス形質導入と培養
- 必要な数にメディアの2ミリリットル(8 mMグルコース、10%ウシ胎児血清、50ユニット/ mlペニシリン、50μg/ mlのストレプトマイシンを含むRPMI 1640培地)を添加することにより、6ウェル非組織培養コーティングしたプレートを準備します。井戸。無ウイルスの制御のためのそれぞれ、ウイルス制御(例えば、GFPを発現するアデノウイルス)、および実験群 - 例えば、典型的な実験は、3つのウエルが必要な場合があります。
- 少なくとも30分間組織培養インキュベーターにそれを置くことによって37℃にプレートを温める。
- すぐに6ウェル非組織培養コーティングしたプレートの各ウェルに、ラットの膵島分離18,19、場所100から200島を後に。シックス膵島インスリン分泌とチミジン取り込みアッセイに必要とされる。残りの島は、遺伝子発現の研究や免疫ブロット法のためのタンパク質分離のためのRNAの分離に使用することができます。
[注:この時点から、バイオハザード物質の取扱い、使用、廃棄のための制度のプロトコルに従ってください。]
- 優しくスワールウェルの中央に島をもたらすプレート。
- 皿の中央にある小島に直接アデノウイルスをピペット。感染症の100から500多重度(MOI、ウイルスのプラーク形成単位に標的細胞の比)を使用します。
- 5分間島の残りをしましょう。
- 組織培養インキュベーター(37℃、5%CO 2)のプレートを置きます。
- 24時間後、優しくスワールプレートのウェルの中心に島を持ってきても新鮮な培地を含む新しいP200にマイクロピペットを用いて膵島を転送することができます。島がプレートに取り付けられなくなった場合、それらは静かにピペットチップで外れすることができます。
[注:適切な伝達すると効率を確認するには島はその後、膵島コアにアデノウイルスの侵入を確認するには、共焦点顕微鏡を介して撮像することができるようにCY、コントロールウイルスを発現するGFPの使用は、有益である。]
- 最適化のパイロット研究から実験の所望のタイミングに応じて追加の24〜72時間の培養では、膵島、。たとえば、増殖反応の誘導は、目的の遺伝子の24〜72時間またはノックダウンに至るまで時間が48時間または72時間が必要になる場合がありますが必要な場合があります。毎日新鮮なメディアへの膵島を転送します。
- 実験の最後の24時間、文化1μCiの[メチル- 3 H] -thymidine/mlメディア(一般的には1μlのチミジン/ mlのメディア)を含むメディアの小島。
[注:この時点から、放射性物質の取扱い、使用、廃棄のための制度のプロトコルに従ってください。]
2。インスリン分泌アッセイ
- 準備する分泌アッセイバッファー(SAB)10Xストック溶液(1.14 MのNaCl、47 mMの塩化カリウム、12mMのKH 2 PO 4、11.6 mMのMgSO 4)し、CaCl 2の 100Xストック溶液(0.25MのCaCl 2)。これらのストック溶液は、前もって準備し、室温で保存することができます。
- 新鮮で作業SAB(10X SAB、1 MのHEPES、100XのCaCl 2 0.5mlの35%BSA、0.11グラムのNaHCO 3 0.28ミリリットルの1ミリリットルと、滅菌水に50ミリリットルの5 mL)中の50ミリリットルを準備50 mlコニカルチューブと37℃の水浴中で配置することにより、37°Cに暖かい。
- ピペットで15 mlのコニカルチューブに作業SABの10mlと高グルコース(16.7 mM)のSABを準備する2.5 M D-グルコースの66.8μlを追加します。
- 低グルコース(2.8 mM)のSABを準備する作業SABの残りの40 mlの2.5 M D-グルコースの44.8μlを添加します。
- ラベル6ウェルプレートの各ウェルの3つの1.7 mlマイクロチューブおよびリン酸緩衝生理食塩水(PBS)1 mlを加える。
[注:小島は放射性であるので、放射性物質の取扱い、使用、廃棄のための制度のプロトコルに従ってください。]
- それぞれのマイクロ遠心チューブに20の島を配置します。各遠心管に比較的大型の膵島を追加するには、あらゆる試みを行います。たとえば、各チューブは、5小、10中期、5大型の膵島( 図1を参照)を含めることができます。
[注:ランゲルハンス島では、解剖立体または標準的な顕微鏡のいずれかを使用して可視化することができます。]
- 膵島は重力(〜2分)でチューブの底に定住した後、マイクロピペットでPBSを吸引除去し、廃棄します。
[注:重力により沈降する代わりに、チューブは1分間300×gで遠心分離することができます。]
- プレインキュベーションのために、低GLU 400μlのCOSE SABは、組織培養インキュベーター(37℃、5%CO 2)にチューブを(それらのキャップを開いた状態)に置き、60分間プレインキュベートします。プレインキュベーション低グルコースSABと廃棄を吸引除去する。
- 基礎インスリン分泌、低血糖SAB 400μlを加えるために、組織培養インキュベーター(37℃、5%CO 2)にチューブを(それらのキャップを開いた状態)に置き、60分間インキュベートします。低グルコースSABを収集し、インスリンラジオイムノアッセイのために保存します。
- 刺激インスリン分泌については、高グルコースSAB 400μlを加え、組織培養インキュベーター(37℃、5%CO 2)にチューブを(それらのキャップを開いた状態)に置き、60分間インキュベートします。高グルコースSABを収集し、インスリンラジオイムノアッセイのために保存します。
3。チミジン取り込みアッセイ
- 小島は重力によってチューブの底に定住した後、破棄され、マイクロピペットでPBSを吸引除去し、これを繰り返し、1 mlのPBSを追加します。一度ステップ実行します。
- 500μlの氷冷トリクロロ酢酸(TCA、10%w / v)の追加し、氷上で30分間インキュベートします。
- 4℃で3分間16 000 XG℃でチューブを遠心
- TCAを吸引し、0.3 N NaOHの80μlを加え、室温で30分間インキュベートする。この間、5〜10秒間激しくボルテックスサンプルごとに10分。
- 7ミリリットルの液体シンチレーション計数管にエコノセーフ計数カクテルの4ミリリットルを追加します。
- シンチレーション計数管に試料の50μlを添加し、チューブのキャップを簡単に振ると、液体シンチレーションカウンターでカウントします。
- 製造元のプロトコールに従ってビシンコニン酸(BCA)アッセイとサンプル10μlを用いてタンパク質濃度を測定します。
4。データ解析
- 製造業者のプロトコルに従ってインスリンラジオイムノアッセイを実行します。
- タンパク質の濃塩酸でインスリン分泌とチミジンの取り込みデータを正規化するentration。
5。代表的な結果
ラット膵島 では膵島複製およびβ細胞機能を評価する実験の例を図2に示されています。この例では、架空の "ジーン#6"そのアデノウイルスの過剰発現を示しています。確実にβ細胞機能を変更せずに膵島複製を刺激する。トップパネルには、チミジン取り込みアッセイの結果から、 "遺伝子第6位"の発現を増加させるようにチミジンの取り込みによって測定しDNA合成を増加させることを示している。ラット膵島の細胞のほとんどがβ細胞であるので、チミジンの取り込みの増加は、β細胞複製の増加を示している可能性があります。しかし、確証実験はしっかりとこれを確立するために実行する必要があります。下部のパネルに、インスリン分泌アッセイからの結果は "遺伝子#6"の過剰発現を示して私は、すなわち、主なβ細胞の機能のいずれかを変化させなかった低域と高グルコースでnsulin分泌。アデノウイルスによる治療後に膵島の膵島分離と健康の質が低く、高グルコース濃度でのインスリン分泌倍に増加によって示されます。 "ジーン#6"障害β細胞機能の発現を増加させる場合、これは可能性が高く、刺激グルコース濃度(16.7 mm)で分泌されるインスリンの減少として反映されます。グルコース濃度を変化させるための用量反応曲線も行うことができます。
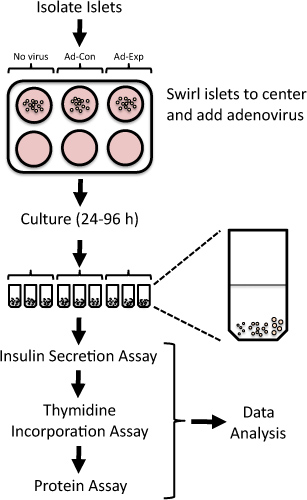
図1遺伝子発現のアデノウイルス媒介性の変化を以下の単離ラット膵島 膵島複製およびβ細胞機能を評価するためのプロトコルの概要。新たに単離したラット膵島を24時間アデノウイルスにさらされ、その後96時間まで培養されています。チミジン取り込みにおけるインスリン分泌の測定に続いて、最後の24時間で評価される低および高グルコース。
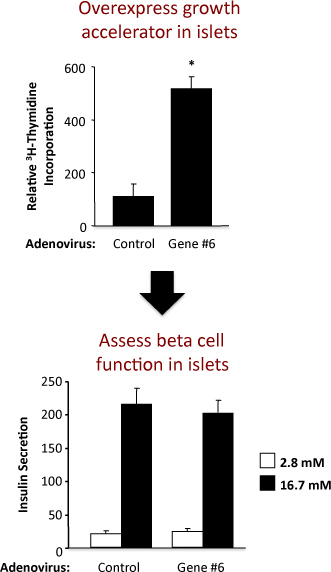
図2コントロールアデノウイルスおよびアデノウイルスを過剰発現する"遺伝子第6位"としてラベル付けされ架空の遺伝子を用いた実験からの結果。上部パネルには、インスリン分泌をチミジンの取り込みとボトムパネルを示しています。
ディスカッション
複製を刺激し、β細胞の機能を強化するために調節することができる確立する経路は、糖尿病の両方の主要な形態に関連しています。機能β細胞塊は、これらの決定を評価し、インスリン分泌細胞の存在と機能に依存しているため、同時にその利点を持っています。このプロトコルは、タンパク質の過剰発現または抑制し、in vivoでの有効性をテストすることができ、in vitroで機能...
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、NIH(PTFまで)からの助成金DK078732によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| RPMI 1640培地 | ギブコ | 11879 | |
| ペニシリン/ストレプトマイシン | ギブコ | 15140 | |
| 6ウェルプレート | BD-ファルコン | 35から1146 | 非TC扱わ |
| [メチル- 3 H] -チミジン | パーキンエルマー | NET027Z001MC | 1 mCiの/ mlの |
| マイクロ遠心チューブ | デンヴィル | C2170 | 1.7ミリリットル |
| NaClを | シグマ | 59888 | |
| 塩化カリウム | アクロス | 42409 | |
| KH 2 </ SUB> PO 4 | アクロス | 20592 | |
| MgSO 4で | アクロス | 41348 | |
| CaCl 2を | アクロス | 34961 | |
| HEPES | シグマ | H0887 | 1 M溶液を |
| 35パーセントBSA | シグマ | A7979 | |
| NaHCO 3を | アクロス | 42427 | |
| D-グルコース | シグマ | G8769 | |
| TCA | フィッシャー·サイエンティフィック | SA9410-1 | の10%w / vの |
| NaOHで | アクロス | 12426 | |
| シンチレーション計数管 | ザルスタット | 58.536 | 7ミリリットル、PP |
| シンチレーション計数管のキャップ | ザルスタット | 65.816 | |
| エコノセーフカウントカクテル | RPI | 111175 | |
| インスリンRIA | ジーメンス | TKIN2 | |
| BCAアッセイキット | サーモフィッシャーサイエンティフィック | 23250 | |
| 機器 | |||
| 遠心分離 | エッペンドルフ | 5415R | |
| シンチレーション計数管ラック | ザルスタット | 93.1431.001 | |
| 液体シンチレーションカウンター | パーキンエルマー | トライ炭水化物2910TR |
参考文献
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved