Method Article
多重抗体スクリーニング法を用いたLuminex XMAPアッセイへの捕捉ELISAの変換
要約
ELISAは、簡単にルミネックスXMAPアッセイに変換することができると、多重化の利点を介して、いくつかの抗体は、アッセイのコストを削減しながら、増加した感度とダイナミックレンジの結果、最適な抗体のペアを識別するために同時にスクリーニングすることができる。
要約
酵素免疫測定法(ELISA)は、長い生命科学の研究と臨床診断の両方の生体試料中の関心のある検体を検出するための主要なツールであった。しかし、ELISA法では限界があります。これは通常、96ウェルマイクロプレートに実行され、井戸は、目的の抗原を捕捉するサンプルの比較的大きな金額を必要とし、捕捉抗体でコーティングされています。井戸の表面積が大きく捕捉抗体の疎水結合には、非特異的結合と増加の背景につながる可能性があります。また、ほとんどのELISA法は、合理的な感度を達成するために、信号の酵素媒介増幅に依存しています。このような増幅は常に線形ではないとすることができますので、スキュー結果。
過去15年間で、新技術は、ELISAの利点を提供している現れではなく、類似したWOより高いスループット、柔軟性、縮小サンプル量、低コストを可能にしましたrkflow 1、2。ルミネックスXMAPテクノロジーは、タンパク質および核酸アプリケーション3から5の両方に適用することができるモノプレックスとマルチプレックスアッセイの両方を可能にするマイクロスフェア(ビーズ)アレイのプラットフォームです。ビーズELISA法に比べて、少ない捕獲抗体と小さなサンプル量を必要とする共有結合より小さい表面積上に固定化された捕捉抗体を持っており、非特異的結合が大幅に削減されます。そのような脳脊髄液、滑液、等6などの制限のサンプルを扱う場合より小さいサンプルボリュームが重要である。検定の多重化は、さらに、単一のサンプルから複数の結果を有効にすると、サンプルボリュームの要件を軽減します。
ルミネックスの最近の改良点は次のとおりです。新しいMAGPIXシステムは、小型で安価な、より使いやすいアナライザ、低濃度の磁気MagPlexミクロス高価なフィルタープレートの必要性を排除し、優れたアッセイ開発に適した作業濃度に来て、低スループットのアプリケーション、およびXMAP抗体カップリング(ABC)キット、プロトコル、試薬、および利息の捕捉抗体ビーズを結合するために必要な消耗品が含まれています。 (キット内容の詳細なリストについては、マテリアルのセクションを参照してください。)
この実験では、XMAPプラットフォームにTNF-αサイトカインの事前最適化されたELISAアッセイを変換し、二つの方法7-11の性能を比較します。 TNF-αは自己免疫疾患患者における炎症反応の測定に使用されるバイオマーカーである。
我々は、4つの異なるマイクロセットまたは領域に4つの候補捕捉抗体を結合することによって開始します。一緒に混合したときに、これら4つのセットには、試薬、サンプルと時間を節約し、最高の抗体のペアを決定するための4つの独立した検出抗体を持つすべての4つの候補の同時テストが可能になります。二XMAPアッセイは、2つの最適な抗体のペアとその性能がで構成されている信号の強さ、ダイナミックレンジ、感度に関しては、元のELISAアッセイのそれと比較されます。
プロトコル
I.試薬の調製
- 抗体の選択と準備
- 実験で使用する抗体を識別します。
- 四捕捉抗体:モノクローナル抗体またはポリクローナルのいずれヒトTNF-α、特定の、すべて同じ宿主種。
- つ検出抗体:どちらか変更されていないヒトTNF-αに特異的ビオチン化、またはPE標識。
- 一つ確認抗体PE結合および捕捉抗体のホスト種の特定。
- メーカーの推奨使用濃度に再構成するすべての抗体を。
- 例えば、低濃度MagPlexミクロスフェア(ビーズ)のセットや地域の4バイアル、Luminex社の部品番号MC10012-ID、MC10013-ID、MC10014-ID、およびMC10015-IDを選択します。
- 実験で使用する抗体を識別します。
- XMAP抗体(ABC)カップリングキットを使用して、MagPlexミクロスフェアに抗体を結合
投稿完全なカップリング手順については、ABCキットユーザーズマニュアル(部品番号89-00002-00-319)へのFER。 (注:可能な限り感光性マイクロスフィアは、光から保護する必要があります。)- カップリング反応のために選択されたビーズ領域の番号を持つ4つの反応チューブは室温とラベルにABCキットの試薬を持参してください。 4ラベルを反応管にMagPlexビーズの4バイアル(1 mLをそれぞれ、2.5×10 6ビーズ)の内容を転送します。
- としてABCキットのマニュアルに記載されているアクティベーションバッファー500μlで2回ビーズセットのそれぞれを洗浄します。
- ABCキットのマニュアルの手順に従って、アクティベーション·バッファ、スルホ-NHSの10μL、およびEDC試薬10μL、480μLを各ビーズセットをアクティブにし、20分間インキュベートします。 (注:EDC試薬は、このステップの直前にアクティベーションバッファー250μLで再構成する必要があります。)
- THRの現在 "活性化"ミクロス合計で前の洗浄ステップを繰り返します。ABCキットのマニュアルで説明したようにアクティベーションバッファー500μL、とeeは倍。
- 4つの別々のソリューションは、アクティベーション·バッファに捕捉抗体の7.5μgの(すなわち、3μgの/百万ミクロスフェア)を含むそれぞれの準備をします。
- 各チューブは直ちにボルテックスは、それぞれの反応管に、これら4つの捕捉抗体のソリューションを追加し、ローテーターで2時間インキュベートします。
- 今ABCキットに付属のWash Bufferを500μLの合計3回 "結合"のミクロスフェアの前の洗浄ステップを繰り返します。
- 最後の洗浄ステップの後、ミリリットルあたり500万抗体結合ビーズの最終ストック濃度を提供するために、各反応チューブに500μLのWash Bufferを追加します。ボルテックスし、微小球を分散させるために反応チューブを超音波処理してください。
注:一部のDI水で満たされた超音波洗浄器で閉鎖マイクロバイアルを沈めるには、すべての洗浄ステップの効果的な超音波処理を提供します。 (電子用材料表を参照してください。quipment詳細)。 - 2-8°Cで結合ビーズを保存し、必要になるまで光から保護されています。
- 結合マイクロスフェアの列挙
- 細胞カウンターまたは血球計算盤を用いてカップリング反応後に回収された微小球の数を数えます。そうするための適切な手順については、計数器のユーザーズ·マニュアルを参照してください。カップリング反応からの回復が90%以上(typ)です。
- カップリングの確認
- カップリング反応を確認するには、アッセイ緩衝液で100ビーズ/μLの最終濃度(1%BSAを含むPBS)で、セットごとに結合ビーズ株式の試験溶液を調製することによって成功しました。アッセイ緩衝液で4μg/ mlでフィコエリスリン(PE-)標識抗種IgGの確認抗体の希釈液を調製する。
- 16ウェルの合計丸底96ウェルプレートの4ウェルに各試験溶液のアリコートを50μL、。後、50μを追加する背景、8、残りのウェルに希釈した確認の抗体50μLを測定するための井戸の8にアッセイ緩衝液のL、。
- マルチチャンネルピペッターで数回上下にピペッティングにより穏やかに反応を混ぜる。プレートをカバーし、プレートシェーカー上で室温で30分間インキュベートします。
- ソリューションのビーズを引き出すために1〜2分間磁性板の区切りにプレートを置きます。その後、廃棄物のレセプタクルを介して、セパレータ上にいる間、強制的に反転板により液体を削除します。
- Assay Bufferを100μLを添加し、磁性板·セパレータを使用して同様の方法でプレートから上清を除去することによって倍を各ウェルを洗浄します。
- 優しくマルチチャンネルピペッターで5回上下にピペッティングしてAssay Bufferを100μLのビーズを再懸濁します。
- そのようなMAGPIXインストゥルメントとしてルミネックスXMAP機器上で分析します。この反応の蛍光シグナルの強度がdirectlです。yは、ビーズの表面上のタンパク質の量に比例したビーズに結合されたタンパク質の相対量の迅速な評価を提供しています。
- 検出のため変更されていない抗体にビオチンを結合する
- 変更されていない検出抗体を使用している場合は、サーモフィッシャーEZ-リンクスルホ-NHS-LC-ビオチン試薬(カタログ番号:PI-21335)と添付文書に記載されている手順でこれらの抗体をビオチン化。彼らはXMAPアナライザで検出することができるように一度ビオチン、検出抗体は、後のアッセイにおけるストレプトアビジンフィコエリスリン(SA-PE)(ステップIII.6。)で標識することができます。
II。アッセイのセットアップ
- XMAPアッセイで最も効果的であるかを決定するために(アッセイバッファー。 材料表を参照してください)1%BSAを含むPBS中の0.96 mLに各10μLを加えることによってすべての4つのビーズセットの初期混合物を準備します。
- DILによって検出抗体溶液を調製アッセイ緩衝液中では1μg/ mLに各uting。
- アッセイ緩衝液中でpg / mLの2000年R&DシステムズTNF-αタンパク質の標準を準備します。
- アッセイ緩衝液中で8μg/ mLのへ(@は1 mg / mLを提供)ストレプトアビジンrPhycoerythrin(SA-PE)を希釈します。
III。抗体スクリーニング
- スクリーニングアッセイのためのコースター丸底96ウェルプレートの16ウェルのそれぞれに抗体結合マイクロ混合物50μLを追加します。
- バックグラウンドを測定するために、16ウェルの8にAssay Bufferを50μLを追加します。
- 応答を測定するために、他の8ウェルにR&DシステムズTNF-α標準(@ 2000 pg / ml)を50μLを追加します。
- アッセイプレートシェーカー上で振とうしながら、光から保護し、室温で1時間インキュベートする。
- アッセイプレートSHAに振とうしながら、4つのウェル(2背景と2応答)への4つの検出抗体の各50μLを追加し、室温で30分間インキュベートし、光から保護KER。
- アッセイプレートシェーカー上で振とうしながら、光から保護するために、すべてのウエルにSA-PE試薬50μLを追加し、室温で15分間インキュベートする。
- 1分間の磁性板の区切りのプレートを配置し、強制的に反転板により液体を削除します。
- 16ウェルのそれぞれに100μLアッセイバッファーを追加し、1分間磁性板の区切りにプレートを配置し、一方、セパレータ上に強制的に反転板により液体を削除します。
- 16ウェルのそれぞれにAssay Bufferを100μLを追加したLuminex MAGPIX器でプレートを読んで、正しく動作するためにユーザーズマニュアルを参照します。
- 希望する信号の強度を満たしている抗体のペアを選択します。
IV。 XMAP機能アッセイ
- 最高の捕捉抗体を選択した後、アッセイ緩衝液で10mLにその抗体結合ビーズ株式の100μL(ステップIB8から)希釈します。
- 50μLを追加します。2コースター丸底96ウェルプレートの78ウェルに希釈したビーズ。 (78ウェルのプレート×2 = 156ウェル)各プレートは異なる検出抗体の性能を評価するために使用されます。
- R&DシステムズTNF-α標準4 pg / mLの8000 pg / mLの時に最初と最後の12ポイントの標準曲線を、準備します。 78ウェル/プレートの合計のため、背景として、アッセイ緩衝液各50μLを650μLのプレートのそれぞれに各希釈液の複製され、加えて、6つの井戸を追加します。
- アッセイプレートシェーカー上で振とうしながら、光から保護し、室温で1時間プレートをインキュベートします。
- 最初のプレートのすべての78ウェルに最初の検出抗体50μLを追加します。第二の板に2番目の検出抗体について、この手順を繰り返します。
- アッセイプレートシェーカー上で振とうしながら光から保護し、室温で30分間プレートをインキュベートします。
- 各プレートの全ウェルにSA-PE試薬50μLを追加します。
- インキュベートアッセイプレートシェーカー上で振とうしながら室温で15分間二つのプレートは、光から保護されています。
- 1分間の磁性板の区切りにプレートを置き、一方、セパレータ上に強制的に反転板により液体を削除します。
- プレート上で78の各ウェルにAssay Bufferを100μLを追加します。1分間磁性板の区切りにプレートを配置し、強制的に反転板により液体を削除します。
- プレート上で78の各ウェルにAssay Bufferを100μLを追加し、適切な動作のためにユーザーズマニュアルを参照して、MAGPIX器で分析します。
V. ELISAアッセイ
- R&Dシステムズ人間TNF-α/TNFSF1ADuoSet ELISAキット(R&Dパーツ#DY210)に同梱の説明書に従い、R&Dキットに付属の標準で生成された応答を測定します。 R&Dシステムズ捕捉および検出蟻を代入し、ELISAアッセイをさらに3回繰り返します。他のベンダーの抗体とibodies。シンプルさ、ペアベンダーによる抗体(例えば、ミリポアの検出抗体を用いたミリポア捕捉抗体、アブカムの検出抗体とアブカム捕捉抗体など)。
- ELISAフォーマットで要求されるように3つのTNF-αタンパク質の基準のそれぞれに、独立して、各ペアを評価します。
VI。代表的な結果
このプロトコルは急速にアッセイを最適化する技術の多重化機能を活用しながら、典型的なELISAをXMAPプラットフォームに変換する方法を示しています。この例で使用されるELISAはヒト腫瘍壊死因子-α(TNF-α)R&D SystemsからDuoSet ELISAキット(R&Dパーツ#DY210)であった。
キットに付属している抗体のペアに加えて、さまざまなソース( 材料表を参照)からの3つの他の抗体ペアは、XMAPプラットフォームを用いて同時に評価した。フォー抗体のウルは、捕捉抗体として指定されたとMagPlex低濃度ミクロスフェアに結合させた。他の4つの抗体を検出抗体として指定された、の3は、ビオチン結合として購入したとプロトコルで説明したように第四は、ビオチン化した。
この研究のための抗体は、可用性、およびベンダーに基づいて選ばれました。しかし、実用的な設定では、抗体は、個々のユーザーの好みやその抗体を用いた過去の実績の経験に基づいて選択する必要があります。 、この実験は、捕捉抗体に対する検出抗体として抗体の適合性をテストするものではありませんが、このプロトコルは、簡単にその目的のために変更することができます。
ルミネックスXMAPアッセイはTNF-α抗体結合MagPlexミクロスフェアの4つのセットを組み合わせることにより、混合物として4つのすべての捕捉抗体を評価するために多重化するように行った。捕捉抗体は、4つのそれぞれで評価した個別にビオチン化検出抗体は、4つの捕捉抗体のそれぞれに1つの検出抗体との相互作用を同時に決定することができるような。並行して行わ四このようなアッセイは、すべての4つの捕捉抗体と4つのすべての検出抗体の相互作用を決定した。 図1は、これらのスクリーニングアッセイの比較データを示しています。
結果は、R&DシステムズDuoSetからの抗体のペアは6183中央蛍光強度(MFI)単位での結果の応答で最適に実行することが示された。また、R&Dシステムズ捕捉抗体と組み合わせた場合ミリポア(R&D抗体ペアの応答の86%)とアブカム(67%)から検出抗体は、XMAPアッセイにおける合理的な応答を提供することが観察された。アブカムは、ミリポアとノーバスから捕捉抗体は、XMAPアッセイの少ない望ましい応答を生成。
それは注意することが重要であり、そのPUR本研究のポーズは、特定の抗体やベンダー間の違いを強調するためではなく、単に同じような条件下で使用される彼らのパフォーマンスの観察違いがあることを示すために、とXMAPプラットフォームは、これらの違いを評価するための効率的な手段を提供することができるとは限らない。
R&DシステムズDuoSetプロトコルは、ELISA形式で4つの抗体のペアを比較するために使用されていました。それは今日広く使われている典型的なELISAプロトコルの反射であり、それはXMAP技術で使用されるプロトコルに類似しているので、R&Dシステムズプロトコルは、すべての抗体のペアを使用しました。 ELISAテストでは、R&D Systemsから抗体のペアが再び最高の結果を( 図2)を得たことを示した。アブカムの抗体ペアは、ミリポアとノーバス生産控えめな応答からの応答と抗体のペアを生成しません。
標準と抗体の反応性の変動を評価するために、4つのすべての不格好なやつyのペアは、3つの異なるベンダー( 材料表を参照)から、3つの異なる組換えTNF-αタンパク質の基準でテストされました。 3つのベンダーからの組換えTNF-αタンパク質の基準に、 図2番組のデータは、同等の結果が得られた。
R&D SystemsからのTNF-αタンパク質は、ELISA( 表1)とXMAPアッセイ( 表2&3)標準曲線を生成するために使用されていました。 ELISAアッセイは、R&Dシステムズ社抗体のペアで行われたが、XMAPアッセイは、R&DシステムまたはミリポアからR&Dシステムズ捕捉抗体と検出抗体のいずれかを利用した。 R&D SystemsからのTNF-αタンパク質は、8000〜4 pg / mLの濃度までの範囲を生成するために希釈した。 表2に示すように、唯一のR&D Systemsから抗体のペアは、レスポンス>2万MFIと、XMAPアッセイで期待される成果を生産し、図3。ミリポアからの検出抗体は、R&D Systems検出抗体の代わりに( 表3)、R&D Systemsから検出抗体を用いて得られた応答の約30%であった応答(6,000 MFI)のXMAPアッセイで使用されたとき。に示すように、 図3。
表1のデータは16から1000 pg / mLの製造元が推奨するTNF-αの範囲を持っていたELISAの標準曲線を表しています。 ODは1000 pg / mLの2 OD単位よりわずかに大きかったと分光光度計は、3 OD、上記測定することができませんので、この範囲は非常に限られていました。ので、分光光度計を用いて制限から、それがさらにELISAアッセイの範囲を拡大することはできませんでした。さらに、表1のデータは、R&DシステムズDuoSet ELISAは16 pg / mLのよりもはるかに少ない濃度でTNF-αを検出することが可能ではないことを示しています。一方、XMAPアッセイはmeasurが可能ですR&Dシステムまたはミリポアのいずれかから検出抗体と組み合わせてR&D Systemsから捕捉抗体と未満7.8 pg / mLの濃度でるTNF-α。
( 図4)対数スケールでプロットしたときに、両方のメソッドのダイナミックレンジと感度が良く示されています。 XMAPアッセイのELISA応答と応答の傾きの間に明確な区別はさらに高く、低濃度の両方でELISAとTNF-αを検出するためのより多くの制限機能を示していることがわかる。
二つの機能TNF-αXMAPアッセイの検出限界(LOD)はバックグラウンドよりも大きく観測された応答レベル(MFI)に加えて、3倍の標準偏差(SD)で最も低いTNF-α濃度を識別することによって近似された。統計的有意性を達成するために、6つは複製されXMAPとELISA法の両方にSDを決定するために使用されました。 THESLODの電子の見積もりが楽観的な、通常の動作条件下でのみ2つまたは3つの使用される複製されることを理解した上で "ベストケース"のシナリオを、提供することを目的としています。 表2に、それは、R&D Systemsペアを使用する場合は、3.91 pg / mLの最も低いTNF-α濃度がこの基準を満たし、背景+ 3SDの応答よりも大きい66 MFIの応答を生成し、ことを観察することができます。ミリポア検出抗体はR&Dシステムズキャプチャー抗体( 表3)で使用されたときに、検出限界は7.81 pg / mLの未満であった。このケースでは、第二最低TNF-α濃度は17 MFIの許容応答を生成し、最低TNF-α濃度の応答に加えて3倍の標準偏差よりも大きい。 (10 MFI + 3(2.4)= 16.29 MFI)同様に、R&DシステムズDuoSet ELISAの検出限界は63 pg / mLの、31 pg / mLの( 表1)の間と推定された。
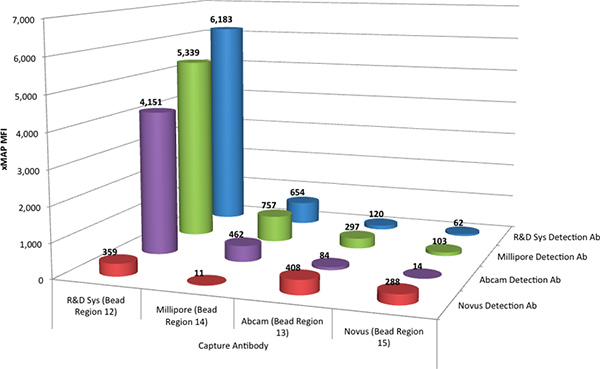
図1 4つ捕捉抗体のすべての可能な組み合わせのR&Dシステムズ標準(@ 2000 pg / mLの)(4つの異なる微小領域に結合された)と4つの検出抗体の平均的な蛍光強度(MFI)が。 拡大表示するには、ここをクリック図 。
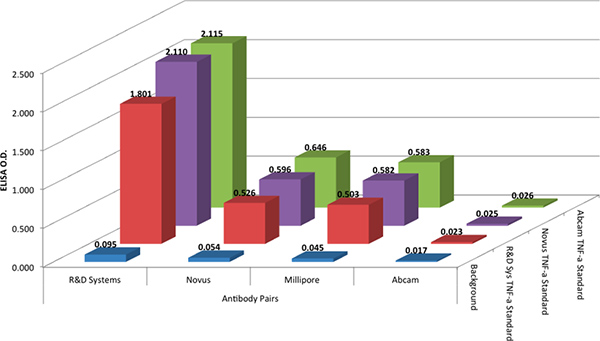
図2 4つ捕捉および検出抗体のペアの組み合わせの3つの異なる組換え規格(@ 1,000 pg / mLの)の光学密度(OD)。捕捉および検出抗体は、任意にわかりやすくするために、ベンダーによって対にした。 拡大図を表示するには、ここをクリックしてください 。
| pg / mLの | OD | STD Dev | 3 SD |
| 1000年 | 2.084 | 0.035 | 2.187 |
| 500 | 1.328 | 0.038 | 1.441 |
| 250 | 0.787 | 0.025 | 0.863 |
| 125 | 0.476 | 0.026 | 0.554 |
| 63 | 0.304 | 0.023 | 0.374 |
| 31.3 | 0.212 | 0.025 | 0.287 |
| 15.6 | 0.167 | 0.026 | 0.244 |
| 0 | 0.118 | 0.021 | 0.182 |
表1標準曲線として使用するためのR&DシステムズDuoSetパッケージの挿入、指定された2倍希釈系列の光学密度(OD); 31.3の間の標準偏差(SD)と検出の推定限界(LOD)を含む、 pg / mLの、63 pg / mLの。
| R&Dシステムズ捕捉および検出抗体 | |||
| pg / mLの | MFI | STD Dev | 3 SD |
| 8000 | 20320 | 463 | 21707 |
| 4000 | 15594 | 223 | 16263 |
| 2000 | 11098 | 79 | 11336 |
| 1000年 | 6985 | 160 | 7465 |
| 500 | 4149 | 80 | 4390 |
| 250 | 2233 | 30.0 | 2323 |
| 125 | 1199 | 43.8 | 1330 |
| 63 | 636 | 14.0 | 678 |
| 31.3 | 340 | 12.9 | 379 |
| 15.6 | 183 | 5.9 | 201 |
| 7.8 | 103 | 2.2 | 109 |
| 3.9 | 66 | 2.4 | 73 |
| 0 | 11 | 0.8 | 13.8 |
表2 R&DシステムズDuoSetに含まれている抗体のペアを使用して、XMAP技術により測定した標準希釈系列のメジアン蛍光強度(MFI)、;標準偏差(SD)と検出の推定限界(LOD)未満の3.91を含むpg / mLの。
| R&D Systemsは、ミリポアの検出抗体と抗体をキャプチャ | |||
| pg / mLの | MFI | 標準Dev | 3 SD |
| 8000 | 5800 | 143 | 6229 |
| 4000 | 3881 | 120 | 4242 |
| 2000 | 2176 | 73 | 2396 |
| 1000年 | 1138 | 32.1 | 1234 |
| 500 | 578 | 31.3 | 671 |
| 250 | 289 | 6.2 | 307 |
| 125 | 142 | 3.1 | 151 |
| 63 | 75 | 5.3 | 91 |
| 31.3 | 44 | 3.3 | 54 |
| 15.6 | 28 | 2.6 | 35.5 |
| 7.8 | 17 | 1.5 | 21.2 |
| 3.9 | 10 | 2.0 | 16.3 |
| 0 | 7 | 1.4 | 11.4 |
表3 R&Dシステムズ捕捉抗体とEMDミリポア検出抗体を用いたXMAP技術により測定した標準希釈系列のメジアン蛍光強度(MFI)、;標準偏差(SD)と検出の推定限界(LOD)を含む、以下より7.81 pg / mLの。
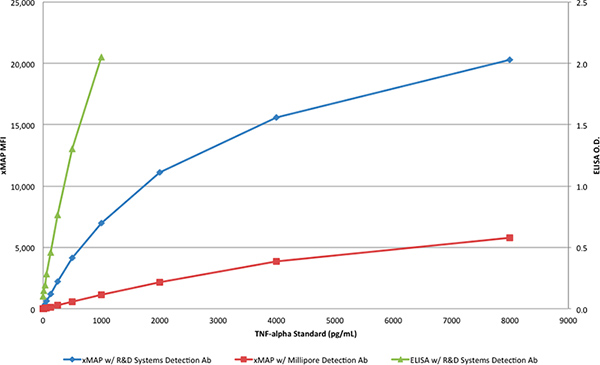
図3。2 XMAPアッセイおよびR&DシステムズDuoSet ELISAの標準曲線より大きい図を表示するには、ここをクリックしてください 。
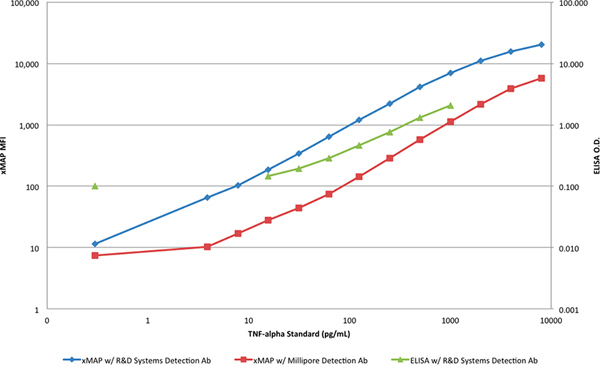
図4は、XMAP標準曲線と対数スケールでのELISAの標準曲線の比較。 拡大図を表示するには、ここをクリックしてください 。
ディスカッション
ルミネックスXMAPプラットフォームへのELISAアッセイの変換はストレプトアビジンフィコエリスリン(SA-PE)の典型的なELISAキットにストレプトアビジン西洋ワサビペルオキシダーゼ(SA-HRP)を代入すると、パフォーマンスを最適化するような単純なことができます。地面からXMAPイムノアッセイを作成したい人のために、これはまた、抗体ペアの高速、多重評価を可能にする簡単なプロトコルを使用して達成することができます。 XMAPアッセイ用試薬は、簡単にMagPlex低濃度微小球に結合するように指定された捕捉抗体のキットをカップリングXMAP抗体を用いて調製した。より高濃度のマイクロスフェアの同じアッセイの性能を提供しながら、低濃度微小球の使用は、アッセイ開発のコストを削減します。コートにELISAプレートのウェルを必要とし、24時間、治療に続いて - 結合MagPlexミクロスフェアを調製するために必要な時間は、はるかに高速22よりも約3時間であり、コーティングされた井戸の。 XMAPアッセイの性能は、検出限界の点でELISA(<4 pg / mLの対> 31 pg / mLの)とダイナミック·レンジ(8000 pg / mLの対16 <〜4 pg / mLの>に優れているpg / mLの1000〜pg / mLの)。プレートリーダーは、アッセイのダイナミックレンジの上限を制限し、3または4 ODである限られたODの範囲を持っています。
間違いなく、すべての抗体は、ELISAフォーマットで動作し、ELISA法ではうまく動作しないすべての抗体は、XMAPアッセイフォーマットに容易に譲渡することはできません。 XMAPアッセイ(すなわち、同時に実行される)多重化することができますしかし、それは、アッセイに使用するための最良のペアを識別するために、同時に複数の捕捉および検出抗体の組み合わせを評価することが可能である。このプロセスは、一度に1つのペアの評価に限定されているELISAの開発手順に比べてかなりの時間と試薬を節約できます。二つ以上の抗体ペアは等価的に実行する必要があります。アッセイのその他のパペア(たとえば、可用性、コスト等)の適合性を決定するために考慮される。
XMAPアッセイに改良されたアッセイのパフォーマンスと柔軟性に加えて、大幅なコスト削減もあります。 XMAPアッセイの1つのウェルで使用されているビーズのために必要な量は約7.5 ngのであるのに対し、抗体の推奨量は、コート、単一のウェルELISAプレートは400ngであるために必要。 XMAPアッセイで使用されている場合このように、1つのウェルELISAに必要な抗体の量は、50以上のテスト結果を提供します。貴重なサンプルを含むアプリケーションでは、XMAPも大きな利点があります。 XMAPアッセイに必要な量はその半分、または少なくすることができます一方、ELISAのために推奨されるサンプルの量は100μLです。
優れたダイナミックレンジと感度を持つアッセイを製造しながら要約すると、ルミネックスXMAPプラットフォームへのELISAアッセイの変換は、単純な効率的でコスト節約になります。
開示事項
この作品は、ルミネックス·コーポレーションで製造装置をルミネックス·コーポレーションで行われた。
R&Dシステム&EMDミリポアルミネックス·コーポレーションの戦略的パートナーであり、多重XMAPベースのアッセイを開発し、実用化するためにライセンスされています。
謝辞
この作品は、ルミネックス·コーポレーションによって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 説明 | ベンダー | カタログ番号 | コメント |
| 人間TNF-α/TNFSF1ADuoSet ELISAキット | R&Dシステムズ | DY210 | モノクローナル抗体およびビオチン結合ポリクローナル抗体、組換えTNF-αタンパク質の標準が含まれています |
| TNF-αに対するモノクローナル抗体 | アブカム | Ab18696 | 抗体、クローンCH8820をキャプチャする |
| TNF-αに対するモノクローナル抗体 | アブカム | Ab16166 | ビオチン結合の検出抗体、クローンAS1 |
| TNFアルファタンパク質 | アブカム | Ab9642 | 組換えTNF-αタンパク質の標準 |
| TNF-αに対するモノクローナル抗体 | Novus | NBP1-50115 | 抗体、クローン4H31をキャプチャする |
| TNF-αに対するモノクローナル抗体 | ノーバス | NB100-78162 | ビオチン結合の検出抗体、クローンMAb11 |
| TNFアルファタンパク質 | ノーバス | NBC1-18460 | 組換えTNF-αタンパク質の標準 |
| TNF-αに対するモノクローナル抗体 | EMDミリポア | MAB1141 | 抗体、クローン3C7.2をキャプチャする |
| TNF-αに対するポリクローナル抗体 | EMDミリポア | 654250 | ウサギポリクローナル検出抗体 |
| ストレプトアビジン - フィコエリスリン | モス | SAPE-001 | ルミネックスXMAPアッセイ用蛍光レポーター試薬 |
| MAGPIX W / Xponentのソフトウェア | ルミネックス·コーポレーション | MAGPIX-Xponentの | ルミネックス·インストゥルメント |
| XMAP抗体カップリング(ABC)キット | ルミネックス·コーポレーション | 40-50016 | EDC試薬、スルホ-NHS試薬、活性化バッファー、洗浄バッファー、1.5 mLの反応管と、使い捨てのピペットが含まれています |
| MagPlexミクロスフェア、低濃度 | ルミネックス·コーポレーション | MC10012-ID、MC10013-ID、MC10014-ID、MC10015-ID | 低濃度のビーズ(@ 2.5×10 6ビーズ/ mL)を |
| EZ-リンクスルホ-NHS-LC-ビオチン | サーモフィッシャー | PI-21335 | 変更されていない検出抗体のビオチン化キット |
| テカン無限F200リーダー | テカン | ELISAプレートリーダー | |
| リン酸緩衝生理食塩水 | Sigma-Aldrich社 | P-3688 | 1パーセントPBS-BSA、アッセイ緩衝液 |
| ワンパイントコンパクトな超音波洗浄、115 VAC | コール·パーマー | WU-08849から00 | 55 kHzの効果的な動作周波数を生成する |
| 磁気チューブセパレータ | ルミネックス·コーポレーション | CN-0288から01 | カップリングの洗浄ステップ内の単一の1.5mlチューブ磁気分離 |
| 磁性板セパレータ | ルミネックス·コーポレーション | CN-0269から01 | アッセイの洗浄ステップで96ウェルプレート磁気分離 |
参考文献
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved