このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ハイスループットマイクロカプセル化シングルセルと複数セル
要約
細胞と粒子の慣性順序を持つ単分散ドロップ生成を組み合わせることで、我々は、kHzのレートで一滴の細胞または粒子の所望の数をカプセル化する方法を説明します。我々は、二回のシングルとダブルの粒子降下を順不同カプセルのものを超えて効率を示しています。
要約
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
プロトコル
このセクションのプロトコルは、提示した実験結果を得るために特に利用する材料と機器を説明します。化学薬品や機器のための代替サプライヤーを利用することができることに注意してください。
1。デバイスの作製とソフトリソグラフィ
標準のソフトリソグラフィ技術、21以前のJoveの記事で紹介されているその数、22はガラス基板に接着ポリジメチルシロキサン(PDMS)マイクロネットワークを作成するために使用されました。脇にSU-8フォトリソグラフィーにより、マスターレプリカモールドの作製から、プロセスはクリーンルームまたはクリーンフードの外で実行される可能性がありますが、ほこりや微粒子はまだ一貫性のある結果を達成するために最小限に抑える必要があります。
- AutoCADの(オートデスク社)を図1に示すように、マイクロチャネル·パターンを設計します。高解像度(50,000 dpi)のトランスを印刷するには、サードパーティのメーカー(輝いているイメージング社製)を採用チャンネルは暗い背景に透明であるマイラーフィルムまたは石英で透明性マスク。
- レプリカ成形用シリコンおよびSU-8フォトレジストマスタを作成します。簡単に言うと、スピンクリーン7.5センチメートルまたは10cmのシリコンウェハ上に52μmの厚い層を作成するには、スピンコーター上で製造元の推奨回転数とSU-8 2050(マイクロケム)ネガ型フォトレジスト。ソフトベークした後、エッジビーズ除去、コンタクトマスクを通して紫外線露光、露光後ベーク、開発、洪水の露出は、Dektakのプロフィル(Veeco社)を使用して、SU-8層の実際の厚さを測定します。テープ4 "または5"ペトリ皿の底の上にマスターモールドは、PDMSのレプリカモールドの準備をします。
- 硬化剤10:1比(w / w)のベースのエラストマーの硬化剤(ダウコーニング社製)と混合したPDMSエラストマーベース。 2〜3ミリメートル、最終的な厚さの層を作成するために、シリコンマスターによく混合したPDMS前駆体を注ぐ。 2グラム硬化剤と20gのエラストマーベースの混合物を4 "径の表面をカバーするのに十分である。
- masteを配置脱ガス硬化PDMSの真空デシケーター内のR型とPDMS(Jencons)。圧力レギュレータ(コールパーマー)を使用して、徐々に過度の発泡を避けるために20分かけて水銀 "-27にHG" 0からのチャンバゲージ圧を減少させます。空気の泡が消えるまで30分間または-27 "Hgのでは真空チャンバー内のデバイスのままにします。
- 真空を解放し、65℃で4時間以上のCオーブン(サーモフィッシャーサイエンティフィック)にマスターモールドとPDMSを移動デバイスは、硬化を改善するために一晩オーブンに残ることがあります。
- オーブンからデバイスを削除し、冷却することができます。慎重にPDMSて精密ナイフと皮を使用して円形のウェハの周りにPDMSを切った。メスで図1に示すように、デバイスの輪郭を切り取ります。
- 生検パンチを用いて図1に示す3つの円形の地域でパンチ流体ポート(デバイスあたり最大3つ)。このデバイスでは、0.75ミリメートル、外径パンチ(ハリス)を使用します。
- いずれかを削除するには、PDMSとの剥離のパターン側にスコッチテープを付着させほこり。従来の酸素プラズマ装置のコスト削減が実行可能な代案として、21,22プラズマは、ハンドヘルド研究所コロナ処理機(エレクトロ·テクニック製品は、株式会社を使用して、PDMSとクリーン3 "×1"ガラス顕微鏡スライドのパターン側を治療する。)23このデバイスはヒュームフードやオゾン放電による換気の良い場所で使用されるべきであることに注意して、すべての時計や携帯電話は、少なくとも10フィート離れて保管してください。最小限の電スパークが発生して安定したコロナを達成するためにコロナ放電を調整します。ゆっくりと約20秒間、各表面上に "約1/4電極を振って、その後すぐにPDMSの表面が、母国の状態に戻す前に、強力な永久的な結合を形成する接触処理した表面をもたらす。
- 金属板上のデバイスを配置し、涼しいオーブンの場所は、120℃にオーブンを設定し、接合を完了するために、この高温ベーキング、Tの間に、元の疎水性の状態を24にPDMSを返すために一晩焼く彼は、チャネルのガラス表面は、ガラスの上に薄い疎水性の層の堆積に起因する疎水性のレンダリングされます。あるいは、このようなAquapel(PPGインダストリーズ)のような疎水性コーティングは、12が慎重に。1 mLの注射器と注射針を使用して流体ポートに注入されるかもしれませんが、しっかりとガラス結合にPDMSを壊すことなく、流体ポートに空気をパージし、続いてAquapelを注入する。乾燥時にチャネルを詰まらせる可能性がある堆積物を避けるために余分なAquapelを拭いながら、積極的にすべての入口および出口ポートでエアーパージを繰り返します。
2。試料調製
- 選択したセルタイプの確立されている手順に従って、細胞培養の準備をします。本研究で使用される特定のデバイスについては、8から15μmの粒子または細胞が適切にカプセル化のために発注する必要があります。小さ いまたは大きい細胞タイプは、適切な再p を達成するために集束チャネルの寸法を変更する必要があります。私にとって本論文で示されthodデモの結果、9.9μmのポリスチレン微小球(G1000、サーモフィッシャーサイエンティフィック)は、細胞のサロゲートとして利用されています。
- 穏やかに混合を介して水粒子または細胞懸濁液を準備します。細胞やポリスチレン粒子を使用する場合は、濃度制御が不可欠である( 図4を参照)理想的な順序付けられたカプセル化を実現しています。以前のデータ12をガイドとして使用して、注文した列車の間隔とマイクロチャンネルのサイズに基づいて、所望の細胞または粒子濃度を計算するように1つのセルまたは予想される長手方向の列車の間隔の時間を中心チャネル断面積あたりの粒子。ストック濃度(1%w / wの)が不十分な場合、混合、または緩やかに混合渦によって上澄み液を除去し、穏やかに株式サンプルを遠心分離することによって(ここでは〜1.5%w / w)の濃度を増加させ、再懸濁した粒子細胞を使用するとき。目的のコレクションボリューム用とFLに関連付けられた実行時間を考慮して適切なボリュームを準備します。OWのチューニング。
- 細胞やポリスチレン粒子の両方が1より大きい比重を持っています。このプロトコルで実証されていませんが、時間に多くの分のオーダーで持続的な長期的な実験のために、浮力は、細胞のために溶質のような粒子のCaCl 2またはOptiPrep(Sigma-Aldrich社)として追加することによってソリューションを一致しています。
- 15 mLの遠心管にフッ素油FC-40(3M)とPFPE-PEGブロック共重合体界面活性剤25(2.5%w / w)で(レインダンスTechnologies)を混合することにより、連続的なフッ素油相を10 mLのサンプルを準備します。また、ライトミネラルオイル(PTIのプロセスケミカル)は、ABIL-EM 90界面活性剤(2.5%w / w)の(エボゴールドシュミット社)で利用することができます。
3。実験のセットアップ
- 倒立型光学顕微鏡(アクシオオブザーバー、ツァイス)、高速カメラ(ファントムV310、ビジョン研究)の電源をオンにします。またはどちらかのデバイスを手動で移動することにより、目詰まりや破片のためのチャネルを集中して検査する電動顕微鏡ステージを使用します。液体が流れるときにいくつかの小さな破片が押し出される可能性があります。焦点チャネルの破片が大幅に品質を発注低下する可能性がありますような大きなゴミや明らかな目詰まりについては、デバイス上の別のチャンネルを選択します。目詰まりがしばしば鈍ピンセットで患部上にPDMSの表面にしっかりと押すことによって、フロー下で除去できることに注意してください。
- 3水性入口のPVCチューブの長さ(0.01 "ID/0.03" OD、タイゴン)、オイル入口、およびエマルジョンコンセントをカットします。デッドボリュームを最小限に抑えるために、シリンジポンプから顕微鏡のステージに到達するだけで十分なチューブカット。流体ポートへの挿入を容易にするために45°の角度でチューブの両端をカットします。
- チューブを圧入するためにピンセットを使用して、それぞれの水溶液と油入口管(無接着剤不要)の自由端に2つの30ゲージの鈍先端のステンレス製注射針(SmallParts)を圧入して、ステップ1でパンチと流体ポートに終わる。廃棄物にアウトレットチューブを配置し、Reservoir。このチューブは、後で収集タンクに移されます。
- 、顕微鏡のステージに、デバイスと接続されたチューブを移動し、位置を合わせて利用可能な目標を(20倍、この実験に用いた)を使用してデバイスのノズルに焦点を当てています。最適な録音のために、必要に応じてK hler照明および他の顕微鏡の設定を調整します。
- ステップ2で調製した油相溶液をよく混合し、水相と3 mLシリンジ(BD)で1 mLシリンジ(BD)を記入してください。任意のボリュームのいずれかの注射器を使用することができると慎重に、目的の実行時間と、任意の拍動性の最小化に応じて選択されるべきであることに注意してください。垂直方向に1シリンジを傾けて、注射器をコンセントに気泡を移動するフリック。徐々に十分な注射器の先端に空気をプッシュするようにプランジャーを押し下げる。シリンジを垂直に保持することは、既にステップ3.3のデバイスに接続されたそれぞれの注射針にシリンジを接続します。流体がPになるまで注射針デッドボリュームを介して空気を強制的にプランジャーを押し下げるほとんどのデバイスにチューブを通してushed。しっかりとシリンジポンプ(ネクサス3000、Chemyx)にシリンジをマウントし、プランジャーブロックを行う。第二シリンジの接続を繰り返して、第2シリンジポンプにマウントします。
- 各シリンジポンプとポンプのメーカーのプロトコルを使用してプログラムの電源をオンにします。それぞれの油相と水相のQ オイル = 50μL/ minとQ AQ = 5μL/分に初期流量を設定します。ポンプを起動します。
- 残りの死んだ空気を押し出し、デバイスを入力して、チャネルを埋めるために各流体を待ちます。これには数分かかる場合があります。インレットチューブ内の空気が大量にある場合は空気が排出されるまで、一時的にそれぞれの流量を増加させます。潜在的にPDMS - ガラス結合の障害につながるチャネルの大きな圧力が発生するので、高流量を増加させない。
- 20倍magnificatio:最初のフローレートを使用して、ここに示されているノズル(結果を滴の形成を観察するnは、フレームレート21005のfps、露光約3μs)。フレームレートを最大化し、可能であれば、メモリ要件を減らすためにのみノズルにカメラの視野を減らすことができます。サンプルビデオをキャプチャし、サンプリングレートは、エイリアシングを回避するために十分であることを確認します。
- ( 図2を参照)噴射を避けるために、低水流量で開始します。徐々に流量が増加する限り、水溶液チャンネルで粒子の順序観察するために水溶液の流量を増加させる。
- 粒子濃度が比較的少数の "失われた"粒子と列車を提供するために低すぎるとサンプルは浮力が一致されていない場合は、物理的に注射器の出口に向かって粒子が徐々に沈降を提供するために、注射器の出口に向かってシリンジポンプを傾けます。このメソッドは、ビデオプロトコルで実証されています。定期的にその軸に沿って注射器を回転させることも望ましくないセトリング時間を減らすことができます。
- 適切な順序付けが行われると、発電周波数を調整するために油の流量を調整し、滴の大きさ。平均ドロップ量は、ビデオキャプチャによって測定されたドロップの発生頻度で割った水の流量を用いて計算することができる。繰り返して、目的のカプセル化レートおよびドロップボリュームを達成するために流量の両方を調整します。
- 一度安定して順序付けられたカプセル化が確認され、収集タンクに廃棄物リザーバからアウトレットチューブを移動したり、後続のテストのために別のデバイスに供給する。
- 液滴の所望の数と計算された発生頻度に基づいて収集時間を決定します。
- または検査のために収集されたエマルジョンのサンプルをピペッティングによりドロップ世代のビデオ結果のいずれかを使用して効率を定量化するために0、1、2、...、N粒子を含む液滴の割合を記録します。
4。代表的な結果
結果は、制御された単一粒子および制御二重粒子カプセル化( 図3)の両方を達成するが提示されています。切断による半分にFC-40のオイル流量、単一粒子のカプセル化は、2つの粒子のカプセル化になります。逆に、我々はより迅速にノズルに粒子を提供する水性流量を増加しているかもしれませんが、我々はまた、水性流れの噴射の危険性を増加したことになります。 図3のヒストグラムは、ポアソン統計との比較とともに、2例のドロップ当たりの粒子の小数を提示します。ゼロの粒子と時折の滴が時々縦の二重焦点位置のいずれかに向かって移動するローカル高い粒子濃度と粒子から、所望の結果よりもカプセル化された粒子がある場合にあっている間、順序付けられた列車に "欠けている"粒子による主になります。第2節で説明したようにマッチング浮力を利用されていないことに注意してください。代わりに、シリンジポンプは、物理的に実行中の粒子の高濃度につながる、注射器の出口に向かって粒子の沈降できるように傾いていた。
適切な粒子と細胞濃度の必要性を示す実験的な実行は、 図4に示します。完全な順序付けずに、ローカライズされた粒子のためのグループとは、カプセル化されていますが、多くの滴が粒子を含まないです。ヒストグラムは、目的の2つの粒子のカプセル化のために減少したカプセル化効率を示しています。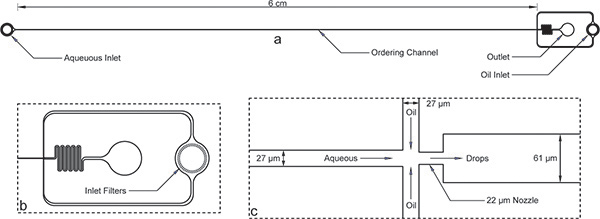
図1。カプセル化装置。インレット、アウトレット、長期発注チャネルを持つ1)全体的なデバイス。デバイスの高さは52μmであると順序のチャネル幅は27μmである。 b)のどちらの水溶液とオイル注入口はオイル注入口の拡大図の順序のチャネル幅のオーダーのギャップを持つ大規模なデブリフィルタを備えています。 c)の拡大ノズルのビューは22μmと広い61μmのチャネルへの急拡大のノズルの収縮が続く水と油のチャンネルで27μmの同じチャネル幅を示しています。ここに示されているデバイスの寸法を微細加工した後にプロフィルを使用して検証されていることに注意してくださいとマスク上の公称寸法とは若干異なります。発注チャネルとノズルの真のイメージは、オンラインで入手できます補足図1 。 AutoCADのマスク·ファイルは 、この原稿を補完するものとしてオンラインで含まれています。

図2。広いデバイス(80μm幅×22μmの高い)を使用して噴射遷移に滴り落ちるのヒステリシス。 )定数FC-40流量(Q オイル = 45μL/ min)で、安定した液滴形成は、Q AQ = 8μL/ minの水の流量を用いて、10 kHzで発生します。水の流量は徐々に10&mに増加するにつれU、L / minで、ストリームがトリガされた水性流体の噴射。 b)の流量が噴射が続く8μL/ minに返されます。安定した液滴形成が簡単に水性流ポンプ(1秒間のポーズが典型的です)一時停止して再確立できることに注意してください。
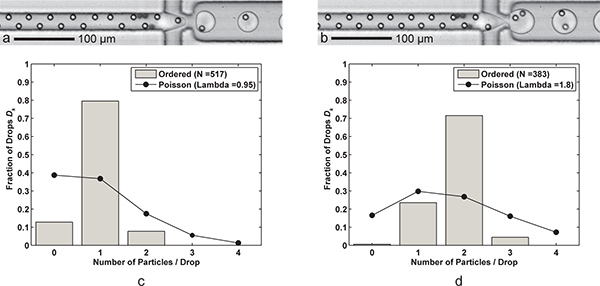
図3。シングルとダブル粒子カプセル化。)6.1 kHzのドロップダウンの生成速度の平均液滴サイズがドロップごとにセル(Q オイル = 60μL/ minで、Q AQ = 9μL/ min)をドロップ形成24.4 PL、および単一セルのキャプチャ効率が2つのセルを持つD K = 79.5パーセントと、P はk = nのサンプルサイズの83.7パーセント(λ= 0.95)、D = 517滴とN P = 491粒子b)の液滴形成ドロップあたり30μにFC-40の流量Q 油を減らすことによって、単に達成されL /分。より大きい(39.8 PL)滴が2セル捕捉効率D K = 71.5パーセントと、P、K、N、D = 383滴とnのサンプルサイズのために= 79.5パーセント(λ= 1.80)と3.8 kHzのレートで形成されP = 689粒子。CD)二つのヒストグラムは、順序付けられた、シングルおよびポアソン統計(ランダム封入)を持つ二重粒子カプセル化のドロップカプセル化粒子の効率D k を比較します。両方のケースでは、流れの方向に粒子間隔が完全に順序付けられた、交互に粒子の17から18程度であることに注意してください。シングルとダブル粒子カプセル化の両方を示す補足ビデオがオンラインで入手できます。 補足ムービー3aを表示するには、ここをクリック 。 補足ムービー3bを表示するには、ここをクリック 。

図4の濃度が大幅に濃度が減少すると)は 、完全な順序付けは発生しません。カプセル化効率に影響を与え、列車のため、 "穴"が予想される粒子よりも少ないといくつかの滴を残して、出てくる。b)のヒストグラムは、効率が低下を示します( D、K二重粒子降下がありますので、単一粒子の多くが下がるとほぼ存在λ= 1.57の低い値による2粒子のカプセル化= 55.9パーセント、P、K = 70.9パーセント)。 Q 油からこの図の結果は= 30μL/ minとQ AQ = 9μL/ minであり、 図3bと同様のフロー条件。代表的な補足ビデオがオンラインで入手可能です。 補足ムービー4を表示するには、ここをクリックしてください 。
ディスカッション
発注の比較的高い程度にもかかわらず、すべてのドロップは、粒子または細胞の適切な数が含まれています。カプセル化効率は、その総数で割った望ましい占有と滴にカプセル化されたようになる細胞または粒子の数として計算することができる。これらの生データを収集し、エマルジョンのサンプル自動化された高速ビデオ·アルゴリズムから、またはイメージングのいずれかから取得す?...
開示事項
JEは、この原稿で利用技術に基づく特許出願中の発明です。
謝辞
我々は、この研究で利用さPFPE-PEG系界面活性剤の例については、レインダンスの技術に感謝し、我々はPDMSチャネルのレプリカを作成するために使用されるシリコンウェハモールド用バイオMEMSリソースセンター(メフメットトナー、ディレクター)に感謝。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| AutoCADの | オートデスク | ||
| 透明マスク | のFineLineイメージング株式会社 | ||
| SU-8フォトレジスト | マイクロケム | 2050 | |
| Dektakプロフィル | Veeco社 | ||
| ペトリ皿 | BDファルコン | 351058 | |
| PDMSシリコーンエラストマーキット | ダウコーニング(株) | Sylgard 184、材質番号(240)4019862 | |
| 減圧デシケーター | Jencons | 250から030 | |
| 真空ポンプ | アルカテル·バキューム·テクノロジー | 2010 C2 | |
| 真空レギュレータ | コール·パーマー | EW-00910から10 | |
| オーブン | サーモフィッシャーサイエンティフィック | リンドバーグブルーM、OV800F | |
| 生検パンチ、0.75ミリメートル | ハリス | ユニコア15072 | |
| 実験室コロナ処理機 | エレクトロ·テクニック·プロダクツ株式会社 | BD-20AC、SKU 12051A | |
| スライドガラス | ゴールドシール | 3010 | |
| Aquapel | PPGインダストリーズ | 代替戦略 | |
| ポリスチレンマイクロスフェア、9.9μmの | サーモ | G1000 | |
| OptiPrep | Sigma-Aldrich社 | D1556 | 示されていません |
| ルアーロックシリンジ | BD | 1 ML:309628 3 ML:309585 | |
| FC-40フッ素オイル | 3M社 | シグマアルドリッチ、F9755 | |
| PFPE-PEGのフッ素系界面活性剤 | レインダンステクノロジーズ | ||
| 軽油 | PTIプロセスケミカル | 08042-47-5 | 代替戦略 |
| ミネラルオイルの界面活性剤 | エボニックゴールドシュミット社 | ABIL EM 90 | 代替戦略 |
| タイゴンPVCチューブ | SmallParts | TGY-010 | |
| 30ゲージルアーロックシリンジニードル、1/2 " | SmallParts | NE-301PL-C | |
| 倒立顕微鏡 | カールツァイスイメージング | アクシオObserver.Z1 | |
| ハイスピードカメラ | ビジョン研究 | ファントムV310 | |
| シリンジポンプ(2) | Chemyx株式会社 | ネクサス3000 | |
| シリコーンオイル | ダウコーニング | 200流体、10 cStの | エマルジョンストレージ用のオプション |
参考文献
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved