このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
バイオ機能ナノファイバーを製造するための手順
要約
特にタンパク質と相互作用することができる官能基が飾られたナノファイバーを製造するための効率的なアプローチを説明する。アプローチは、最初に適切な官能基で官能化ポリマーの調製を必要とします。官能性ポリマーは、エレクトロスピニング法によるナノファイバーに加工される。タンパク質とナノファイバーの結合の有効性は、共焦点顕微鏡によって研究されています。
要約
エレクトロスピニング法は、官能基で飾られたナノファイバーを製造するための効果的な処理方法である。官能基が飾らナノファイバーは、単一分子検出器のような可能性を秘めたバイオセンサーとして作用すなわち物質のバイオマーカーの相互作用を研究するために利用することができる。我々は、機能性はモデルタンパク質と特異的に結合する能力を持っている機能性ポリマーを製造するための効果的なアプローチを開発しました。我々のモデルシステムでは、官能基は、2,4 - ジニトロフェニル(DNP)とタンパク質である抗DNP IgE(免疫グロブリンE)です。機能性ポリマー、α、ω-ビ[2,4 - ジニトロフェニルカプロン] [ポリ(エチレンオキシド)-b-ポリ(2 - メトキシスチレン)-b-ポリ(エチレンオキシド)](CDNP-PEO-P2MS-PEO- CDNP)は、アニオンリビング重合によって調製される。重合に利用二官能性開始剤は、α-メチルスチレンとカリウム(ミラー)は、金属の電子移動反応によって調製した。 2 - メトキシスチレンモノマーが追加されましたイニシエータに、第一、第二のモノマー、酸化エチレンを付加し、続いて、最後にリビングポリマーをメタノールによって終了されました。 α、ω-ジヒドロキシポリマー[HO-PEO-P2MS-PEO-OH]のα、ω-biの形成をもたらすのDCCカップリングによるN-2 ,4-DNP-∈-アミノカプロン酸、と反応させた[ 2,4 - dinitrophenylcaproic] [ポリ(エチレンオキシド)-b-ポリ(2 - メトキシスチレン)-b-ポリ(エチレンオキシド)](CDNP-PEO-P2MS-PEO-CDNP)。ポリマーは、FT-IR、1 H NMRおよびゲル浸透クロマトグラフィー(GPC)によって特徴付けられた。ポリマーの分子量分布は狭かった(1.1-1.2)、50,000より大きい分子量を有するポリマーをこの研究で使用されていました。ポリマーは、黄色の粉末及びテトラヒドロフランに可溶であった。水溶性CDNP-PEO-P2MS-PEO-CDNP / DMEG(dimethoxyethyleneグリコール)複合体は、結合して数秒以内に解IgEと定常状態の結合を実現しています。より高い分子量(約50,000水不溶性IE)より1パーセントを含むP-PEO-P2MS-PEO-CDNPポリマーは、単層カーボンナノチューブ(SWCNT)は、シリコン基板上に電気的に活性なナノファイバー(100 nmの直径が500ナノメートル)に加工した。蛍光分光法は、抗DNP IgEが飾るDNPの官能基の繊維と結合することにより、ナノファイバーと相互作用を示しています。これらの観察結果は、適切に官能化されたナノファイバーは、バイオマーカー検出装置を開発するための約束を保持することを示唆している。
プロトコル
1。 αの合成、ω-ジヒドロキシポリマー[HO-PEO-P2MS-PEO-OH]
- 図1に示すように、重合反応器を組み立てます。この実験のための反応器は、標準的なテーパージョイント外側(Chemglass)、三方活栓を持つ2つのフロー制御アダプタ(Chemglass)、および1テフロン攪拌棒を有する2口フラスコ100mlの丸底で構成されています。アダプタA( 図1)は不活性システムに侵入する空気や水分を防ぐために、システムを介して超高純度(UHP)窒素の流れを維持するために使用された。アダプタB( 図1)を反応フラスコに、溶媒、モノマーおよび開始剤を注入するために使用されていました。
- 乾燥窒素ガス下で6時間の最小値に対して、指標としてベンゾフェノンを用いて、Na金属の上にテトラヒドロフラン(THF)200mlを乾燥させてください。
- 24時間水素化カルシウム上で2 - メトキシ10mlを乾燥させてください。
- ℃でイソプロパノールのスラリーを用いて-78℃で維持低温風呂の準備をするND液体窒素。
- 窒素ガス下( 図1を参照)重合反応フラスコに、THFの25 mlを加え、重合を介してすべての窒素ガス下で反応を保つ。
- スラリー中に場所を100mlの丸底フラスコ。
- 反応フラスコに、開始剤溶液2 mlを(0.27ミリモル/ ml)を追加します。
- 反応フラスコに第一のモノマー、2 - メトキシ(4 ml)を注入します。
- 40分間進行する反応を可能にします。
- 第二のモノマー、エチレンオキサイドの1ミリリットルを追加します。
- 重合は2日間室温で継続することができます。
- HClとポリマー(6M)/メタノール(1/20、体積/体積)を終了。
- ヘキサンおよび真空オーブンで乾燥したポリマー中に沈殿させてポリマーを精製する。
- NMRを用いてポリマーを特徴付ける。
2。 α、機能Polymを入手するためにN-2 ,4-DNP-Ε-アミノカプロン酸、ω-ジヒドロキシ持つ高分子の機能化えー、CDNP-PEO-P2MS-PEO-CDNP
- 3口フラスコに、α、ω-ジヒドロキシポリマー(0.05ミリモル)、N-2 ,4-DNP-E-アミノカプロン酸(0.25ミリモル)、DCC(0.15ミリモル)およびDMAP(0.005 mmol)とを配置4時間真空ラインで乾燥させてください。
- フラスコに乾燥ジクロロメタン(10 ml)を蒸留する。
- 窒素下で真空を解放し、室温で12時間反応をかき混ぜる。
- フィルター反応混合物およびヘキサン、メタノールに二回沈殿させることによってポリマーを回収。
- 乾燥は、40℃の真空オーブン中でポリマーを沈殿させた
- FT-IRおよび1 H NMRによる高分子の構造と機能を決定します。
3。エレクトロスピニング用CDNP-PEO-P2MS-PEO-CDNP/SWCNT溶液の調製
- クロロベンゼンCDNP-PEO-P2MS-PEO-CDNPの20重量%を溶解します。
- 2の溶液を調製するクロロベンゼンで20ワット%とポリスチレンの40重量%(分子量800,000)を溶解。高い分子ポリスチレンはincreasに使用されている電子ポリマー鎖鎖の絡み合いとエレクトロスピニングするために必要な最適な粘度を得る。
- ポリマーの1:1と1:2の比率を形成し、混合物を1重量%の単層カーボンナノチューブ(SWCNT)を追加し、CNTの均一な分布のために一晩撹拌するために一緒に3.1と3.2で調製したポリマー溶液を混合。
4。ポリマーCNTコンポジットのエレクトロスピニング
- 図2に示すように設定するエレクトロスピニングを組み立てます。図の右側にグラスマン高圧電源です。その隣に、シリコンウエハが接続されているレトルトスタンドです。左にシリンジをマウントして、その背後にそれが進行するとの手順を可視化するためのランプであるされている別のレトルトスタンドです。
- 皮下注射器を使用して、CDNP-PEO-P2MS-PEO-CDNP/polystyrene/SWCNT混合物(約1ml)の少量を撤回し、レトルトスタンドに皮下注射器をマウントします。
- シリコンウェハは、マウントされ10cmの距離でしっかりとシリンジ、高電圧源のグランド·クリップ向かいedはそれに接続されています。
- 注射器の針に印加する高電圧を冠しクリップを取り付け、プランジャーを少し(針先端のドロップを中断するために)押し下げ、この時点では、エレクトロスピニングは準備ができています。
- 高電圧源の電源をオンにし、10 kVの電圧計を調整します。複合材料中のポリマーの性質に応じて、より高い電圧は、直径が数百ナノメートルの下のナノファイバーが望まれている場合は、特に必要がある場合があります。
- 完全に乾燥するために一晩デシケータでアンマウントシリコンウェハと場所。
5。ナノファイバーの特性評価
- ナノファイバーの初期イメージングは、繊維の全体的な視点を観察する光学顕微鏡を使って行われます。
- 形態、直径、平均細孔径、等のような細かい詳細を観察する走査型電子顕微鏡の活用
- キャリー繊維などの3次元地形を観察する原子間力顕微鏡でさらにイメージング出
6。抗DNP IgEタンパク質とナノファイバーの結合特異性
- PBS-BSA(リン酸緩衝生理食塩水 - ウシ血清アルブミン)溶液に4 UG / lの蛍光標識、FITC標識抗IgE(フルオレセインIsothio - シアネート - 免疫グロブリンE)の溶液を調製します。
- マテックよくカバースリップ上のナノファイバーが発生していたシリコンウェハの小片を置きます。 1時間この溶液中でナノファイバーをインキュベートする。インキュベーションは、優しく、シリコンウェハ上に、10μlのIgEのソリューションをピペッティングすることによって行われます。
- インキュベーション後、PBS-BSA緩衝液でサンプルを三回洗浄することによって結合していないIgEを削除します。 PBS溶液をナノファイバー上に直接バッファを潮吹き避けるために、マテック皿の壁にそっと分配される。ナノファイバー上に緩衝液を配布するための手で優しく渦巻皿を。ピペットで注意深くバッファを削除して再泥炭この2回以上。
- 制御のために、同じ条件で蛍光標識IgG(DNPの非特定の)でナノファイバーをインキュベートする。
- IgEと結合観察する共焦点レーザ顕微鏡を用いたバインドされた繊維を可視化する。私たちの研究のために、使用される顕微鏡は、63Xレンズ付きライカTCS SP2共焦点だった。
7。ナノファイバーの電流 - 電圧特性
- ケースレー6430敏感なソースメータのような非常に低い電流源に2マイクロポジショナーを接続します。現在の電圧の挙動を決定するためのセットアップ図3に示します。この図は、ナノ繊維の初期のIV特性を決定するために使用されるプローブ·ステーションを示しています。それはボシュロムMicroZoom顕微鏡、真空チャックステージ、およびプロービングに使用される4つのMicropositionersで構成されています。右上のAgilent 34405Aデジタル·マルチメータは、電圧を測定する際に使用し、その下にはされているソースに繊維に入力された低電流を使用ケースレー6430サブフェムトアンペアリモートソースメータ。
- 繊維に触れる先端と反対側に繊維マットの上にマイクロポジショナーのプローブ·アームをマウントします。
- デジタルマルチメータに別の2つのマイクロポジショナーを接続し、他の2つの間インプローブ·アームをマウントし、繊維マットのヒントを着陸。 4つのヒントは、できるだけ同一直線上にあることを確認します。
- ケースレー(典型的にはナノアンペアの範囲)からの電流の量を変化させる入力。
- 供給される電流の大きさのためにすべての外側先端の両端の電圧降下を測定します。
- これらの値をプロットすると、繊維マットのように動作するデバイスの種類を示します。
8。代表的な結果
機能性高分子
α、ω-ビ[2,4 - ジニトロフェニルカプロン]の合成のための ">メソッド[ポリ(エチレンオキシド)-b-ポリ(2 - メトキシスチレン)-b-ポリ(エチレンオキシド)](CDNP-PEO- P2MS-PEO-CDNP)は、図4に示されている。機能性高分子の1構造は、FT-IR( 図5)と500 MHzの1 H NMRスペクトル( 図6)により確認された。FT-IRは完全に消失を示しています-OH -1 CDNPグループとの定量的な官能基を示す3500センチメートル周辺の広い吸収が、これはまた、 図6に示すように、NMRスペクトルによって確認された。NMRスペクトルにおけるピークの積分を使用して、それを決定したことCDNP-PEO -P2MS-PEO-CDNPポリマーが定量的に官能化される。ナノファイバー
図7では、クロロベンゼンからCDNP-PEO-P2MS-PEO-CDNP /ポリスチレン/ SWCNTをエレクトロスピニングによって得られた導電性ナノファイバーのマットはshです自身。得られた共焦点画像は、タンパク質IgEが繊維表面にDNPと結合することを示した。3これはIgE抗体に向かって電界紡糸DNP-ポリマーの結合の特異性の指標である。タンパク質が蛍光標識される光の強度は、ナノファイバー上のIgEの存在の指標となる。
図8aは、このプロセスと図8bによって得られたナノファイバーは、この特定のナノファイバーの寸法は直径150 nm付近であることを示している1のAFM(原子間力顕微鏡)像である。このプロセスによって100から700 nmの間の繊維が得られる。この現在の時点ではそれは特定の次元を有する繊維を準備するために挑戦している。これは、他のグループで観察されるものと一致している。9に示すCDNP-PEO-P2MS-PEO-CDNP /ポリスチレン/ SWCNTのSEM像4 図は、ナノファイバーおよびナノファイバーの直径が200nm〜300nmの間であった。3 SEMがありますnanofibeのイメージrsは異なる倍率で示す。 3つの画像の研究では、繊維の形態は線形とビーズアールを示しています。全体的な目標は、主に線形である繊維を調製することである。 図10 CDNP-PEO-P2MS-PEO-CDNP /ポリスチレン/ SWCNTから調製されたナノファイバーのマットのIVプロットを示しています。プロットは、抵抗(オーム)の挙動を示している。抗原がナノファイバーにバインドされているとき、我々は抵抗のこの変化は、機能性繊維は、単一分子検出のためのセンサーの有効成分として潜在的なアプリケーションを持っていることを示唆している特徴であるように繊維マットのIVの挙動の変化を見ることを期待。
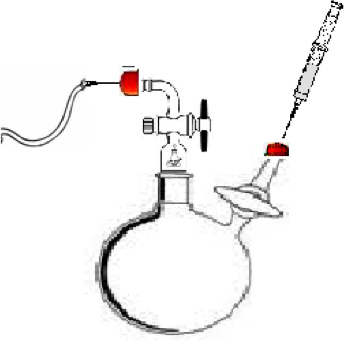
図1は、α、ω-ジヒドロキシポリマーを合成するための重合反応器。フローUHPガス窒素のA)注入地点。 B.)、溶媒、モノマー、およびイニシエータの注入ポイント。 C)を反応容器を。

図2:グラスマン高圧電源を用いて電界紡糸に使用されるセットアップ。

図3:サブフェムトアンペアリモートソースメータ(Keithley社)を用いてIVのプロットを測定するために使用されるセットアップ。
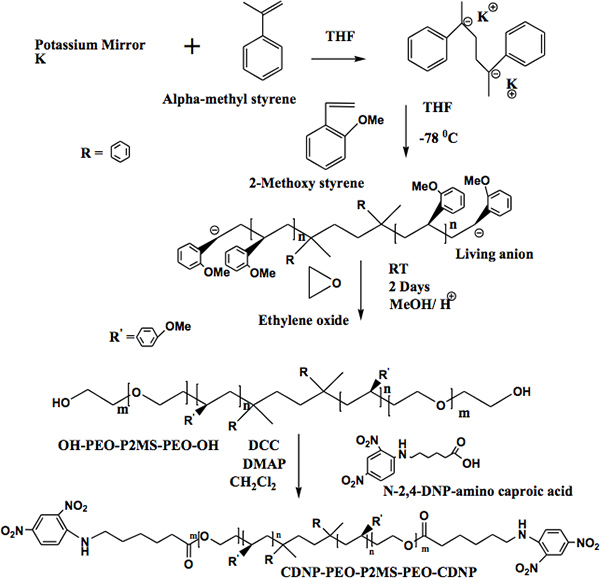
OH-PEO-P2MS-PEO-OHのポリマーを製造するための4)。合成アプローチ図 。 α、ω-ジヒドロキシのB)の官能[ポリ(エチレンオキシド)-b-ポリ(2 - メトキシスチレン)-b-ポリ(エチレンオキシド)]。
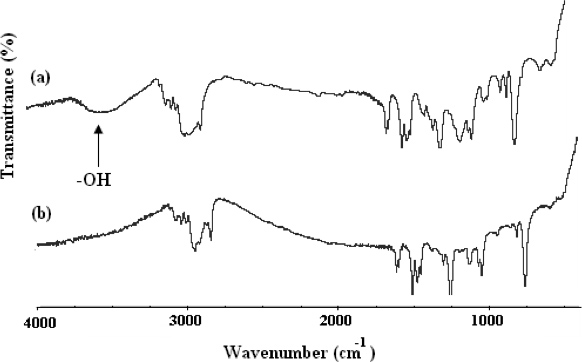
の図5 FT-IRスペクトル(A)は、OH-PEO-P2MS-PEO-OH CDNP-PEO-P2MS-PEO-CDNPと(B)CDNP-PEO-P2MS-PEO-CDNPへの前駆体。

図6 CDNP-PEO-P2MS-PEO-CDNPの500MHzプロトンNMR。
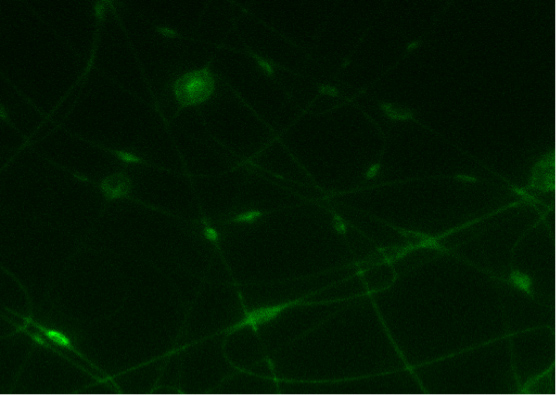
図7。)クロロベンゼンからCDNP-PEO-P2MS-PEO-CDNP繊維エレクトロとのFITC-IgEの結合画像。コントロールのB)の共焦点顕微鏡像(IgGとナノファイバー)。

図8。)クロロベンゼン及び図5aに示すように1つの繊維B)のAFMプロファイルすなわちディメンションからCDNP-PEO-P2MS-PEO-CDNPファイバーエレクトロスピニングのAFM像。

図9。CDNP-PEO-P2MS-PEO-CDNP /ポリスチレン/ SWCNTのナノファイバーのSEM像。
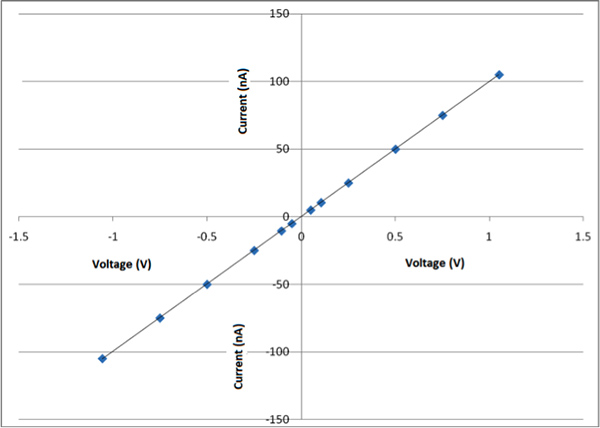
図10 CDNP-PEO-P2MS-PEO-CDNP /ポリスチレン/ SWCNTから調製したナノファイバーのマットのIVプロット。
ディスカッション
本稿では、生体機能性ナノファイバーを製造するための強力なアプローチを提示している。ナノファイバーは、モデルタンパク質に特異的である官能基に装飾が施されています。この通信で報告された手順とアプローチは、一般的なものであり、所望の任意の官能基が飾られたナノファイバーを調製するために用いることができる。アニオンリビング重合が共有結合し、関心のある特定のバ?...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、NSFのHRD-0630456によってサポートされていました、NSF CRESTプログラムとNSFは、DMR-0934142です。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| ナトリウム金属 | シグマアルドリッチ | 282065 | |
| ベンゾフェノン | シグマアルドリッチ | 239852 | |
| 2 - メトキシ | シグマアルドリッチ | 563064 | |
| テトラヒドロフラン | シグマアルドリッチ | 178810 | |
| クロロベンゼン | シグマアルドリッチ | 319996 | |
| 単層カーボンナノチューブ | シグマアルドリッチ | 704113 | |
| ポリスチレン | シグマアルドリッチ | 81416 | |
| シリコンウェーハ | シリコンクエストインターナショナル | 720200 | |
| ツァイスFESEM | カールツァイス社 | ウルトラ60 | |
| ボシュロムMicroZoom IIの高性能顕微鏡によるProbestation | バウシュとLoメガバイト | ||
| ライカ走査型共焦点システム | ライカマイクロシステムズ | TCS SP2 | |
| サブフェムトアンペアリモートソースメータ | ケースレーインスツルメンツ | 6430 | |
| デジタル·マルチメータのオートレンジ | ケースレーインスツルメンツ | 175A | |
| 注射器ポンプ | Chemyx株式会社 | フュージョン200 | |
| ツァイス光学顕微鏡 | カールツァイス社 | ツァイス/ Axiotech |
参考文献
- Sannigrahi, B., Sil, D. Synthesis and Characterization of α,ω-bi[2,4-dinitrophenyl (DNP)] poly(2-methoxystyrene) Functional Polymers. Preliminary Evaluation of the Interaction of the Functional Polymers with RBL Mast Cells. Journal of Macromolecular Science, Part A. 45, 664-671 (2008).
- Gordon, K., Sannigrahi, B. Synthesis of Optically Active Helical Poly(2-methoxystyrene). Enhancement of HeLa and Osteoblast Cell Growth on Optically Active Helical Poly(2-methoxystyrene) Surfaces. Journal of Biomaterials Science. 2, 2055-2072 (2009).
- Baird, E. J., Holowka, D. Highly Effective Poly(Ethylene Glycol) Architectures for Specific Inhibition of Immune Receptor Activation. Biochemistry. 2, 12739-12748 (2003).
- Ramakrisna, S., Fugihara, K., Lim, W. -. E., Ma, Z. . Introductions to Electrospinning and Nanofibers. , (2005).
- Kameoka, J., Craighead, H. G. Fabrication of Oriented Polymeric Nanofibers on Planar Surfaces by Electrospinning. Applied Physics Letters. 83, 371-3773 (2003).
- Ramakrishna, S., Lala, N. L. Polymer Nanofibers for Biosensor Applications. Topics in Applied Physics. 109, 377-392 (2007).
- Reuven, D., Sil, D. Archetypical Conductive Polymer Structure for Specific Interaction with Proteins. Journal of Macromolecular Science Part A: Pure and Applied Chemistry. , (2012).
- Ogunro, O., Karunwi, K. Chiral Asymmetry of Helical Polymer Nanowire. The Journal of Physical Chemistry Letters. 1, 704-707 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved