Method Article
遺伝子発現用機械の機能的アッセイのための小規模の核抽出物
要約
堅牢な、小規模のHeLa細胞核抽出物を調製するためのプロトコルが記述されています。このプロトコルはそのような薬剤又はRNAi処理した細胞などの細胞の小集団の使用を必要とするアッセイのために貴重なものです。方法は、患者の細胞を含む遺伝子発現アッセイおよび他の細胞さまざまな種類のに適用する必要があります。
要約
を理解する遺伝子発現の大きな進歩は 、in vitro 系で使用して行われました。ほとんどの研究では、機能アッセイは、懸濁液で培養した細胞の10〜50以上リットルから大量に調製される抽出物を用いて行われている。しかし、これらの大規模な準備が急速に生体細胞の治療法や条件での様々な結果からそのin vitroでの効果をテストするに従順ではありません。このジャーナルのビデオ記事では、例としてHeLa細胞を用いて、機能的な小規模の核抽出物を調製するための方法を示しています。このメソッドは、接着単層として培養した細胞のようにいくつかの150 3 mmのプレートを用いて行われる。小規模の抽出の効率を示すために、我々は、彼らが結合されたRNAポリメラーゼII転写/スプライシング反応のバルク核抽出物のようにアクティブであることを示している。抽出プロトコルの有用性を実証するために、我々はスプライシングがHeLa細胞から調製した抽出物中に廃止されていることを示すsはスプライシング阻害薬E7107で処理した。小規模なプロトコルは、細胞抽出物を用いてin vitro で調べることができ、任意のプロセスまたは細胞型に一般的に適用する必要があります。これらは、小細胞集団の使用を必要とする薬剤、DNA損傷剤は、RNAi、またはトランスフェクション、など多くの薬剤にさらされる限られた量または細胞内でのみ利用可能です患者の細胞が含まれています。さらに、新たに培養した細胞の少量の便利な、そして/または、一部のアプリケーションで必要となります。
プロトコル
1。核抽出のための成長HeLa細胞
- 10%FBSおよび1%ペニシリン/ストレプトマイシンを補充したDMEM培地を持つ3つの150ミリメートルプレート上にプレートしたHeLa細胞。細胞が90%コンフルエントになるまで、5%CO 2で37℃のインキュベーター内で成長する。
3日に分割した後コンフルエントプレートと収穫〜1:10先端セルの分割。
先端の余分な板を3枚のプレート(例えば、細胞が90%未満のコンフルエントである場合)との十分な細胞が存在しない場合には成長させることができる。
2。核抽出液を調製し、チル
- 表2に示すように、新鮮な溶液を調製する。
- 15mlファルコンチューブに低張緩衝液のアリコートを10ミリリットル。高塩緩衝と1.5mlのエッペンドルフチューブに低塩緩衝液1mlのアリコート1ミリリットル。氷の上でバッファを冷やす。使用直前にそれぞれのバッファにPMSFとDTTの適切なボリュームを追加します(参照してください。 表1)。
3。核抽出のためにHeLa細胞を収穫
- 細胞から培地を吸引除去し、プレートごと室温の1X PBSを13ミリリットルで一回細胞を洗浄する。
- PBS洗浄を吸引除去する。
その後、数秒待って、残りを吸引し、その側の板に立って、最初の吸引によってできるだけ多くのPBS、可能な限りの先端吸引します。
- セルリフターを使用して、プレートの下端に細胞をこすり、次にエッペンドルフチューブに細胞を移す。泡を作ることは避けてください。スクレイプ細胞の3プレートが1 1.5mlのエッペンドルフチューブに収まる必要があります。
ヒント - それはエッペンドルフチューブが使用されている場合はセルの体積を推定する方が簡単です。スケールアップについては、ファルコンチューブを使用しています。
- ペレット細胞にxgの100℃で5分間遠心は4℃で遠心します。
4。低張緩衝液でHeLa細胞を膨潤させる
- 慎重に細胞ペレットからPBSを吸引し、チューブにグラデーションを見て、血球容積(PCV)を見積もります。 HeLa細胞の三コンフルエントプレートはPCVの約500μlを得ることができます。
- 細胞ペレットに低張緩衝液のPCVを2倍に追加します。細胞を再懸濁するために静かに振る。穏やかに、必要に応じて上下にピペッティングして細胞を再懸濁するためにP1000ピペットマンを使用しています。
- ペレット細胞にxgの100℃で5分間遠心は4℃で遠心します。 *細胞はこの時点で膨潤し始めているし、細胞容積は現在、750μlの-1000μL程度でなければなりません。
- 慎重に低張緩衝液を吸引し、1.5mlの最終容量に新しい低張緩衝液を追加します。細胞を再懸濁します。
- 氷上で10分間再懸濁した腫れた細胞をインキュベートします。
5。ダウンスホモジナイザーを用いて細胞を溶解
- ダウンスをすすぎ、その後氷上で寒さを低張緩衝液を使用しています。繊細な作業仕掛品の乾燥乳棒を拭くER(例:キムワイプ)。 1000μlの拡張されたマイクロピペットチップを使用して、ダウンスから、残りのバッファを削除します。
- ダウンスに腫れた細胞を転送します。徐々に気泡がないように注意しながら、細胞を溶解するために上下に5回ダウンスのタイト乳棒を移動します。
- ダウンスから細胞を5μlのアリコートを用いて細胞溶解のアッセイ。エッペンドルフチューブに分注しを配置し、トリパンブルーの等量を追加します。スライド上に混合物を置き、光学顕微鏡を用いて細胞を調べます。溶解した細胞の核は青で表示されます。約90%の溶解が理想的です。
先端細胞がdouncedなければならない回数がダウンスの気密性に応じて異なります。初めて、このプロトコルを実施する場合、ダウンス、各ストロークの後、ステップ5.3を実施することによりダウンスする回数を決定します。オーバーダウンスない、過度のdouncingは、核を破壊します。
- プリchilleに溶解した細胞を転送1500×gで5分間、4℃遠心のdエッペンドルフチューブとスピン。ペレットは核を含んでいます。慎重に核を中断することなく、上清を新しいチューブに移す。上清を細胞質を含んでいます。
先端細胞質はバルク抽出物(バルク抽出からアクティブS100を準備するため1を参照)に使用されているのと同じ高速スピンを使用することであるとして使用したり、さらにS100に処理することができます。
6。塩抽出核
- チューブのグラデーションを見て、ランチ原子力ボリューム(PNV)を推定する。 500μlのPCVは一般的に400μlのPNVが得られます。
- チューブの底にマイクロピペットの先端を挿入し、穏やかに混合しながら徐々に核内にバッファを潮吹きで核に低塩緩衝液の½X PNVを追加します。ピペット上下しないでください。静かに続行する前にペレットが完全に低塩濃度のバッファーに再懸濁していることを確認するためにチューブをフリックします。
- 追加½X高塩緩衝かつ迅速に反転管で1時間を混在させるのPNV。振らないでください。 30分間、4℃で回転させます。
それらを溶解避けるために、高塩緩衝である核をもつ優しい先端ください。
- 18000×gで15分間遠心は4℃で遠心する。上清は、高い塩核抽出(HS-NE)です。細胞の3枚のプレートは、通常、HS-NEの500から600μlを得ることができます。
7。核抽出物を濃縮し、透析
- 冷やしたミニcentricons(アミコン社製)および14000×gで遠心の4時50分°CのスピンにHS-NE 500μlを転送します。ミニセントリコン(アミコン社製)を反転すると新しいエッペンドルフチューブに入れてください。 4で2分間スピン°C、HS-NEを回復するために1000年XG。 HS-NEは約115μlに濃縮することになります。
- P200ピペットマンを使用して、ミニ透析スライド-LyzersにHS-NEの45μlを転送し、50に配置しチルド透析バッファの0ミリリットル。スライドA·アナライザの底がフローターの下部に揃えて配置されていることを確認します。 4℃で1〜2時間撹拌NEは、透析後の曇りが表示されます。
先端でください。この遠心抽出物の活性を低下として、透析後に観測された濁った沈殿物を除去するために遠心分離しません。
- NEは、直ちに使用または等分することができます。アリコートは、フラッシュ液体窒素中で凍結し、-80℃で保存しなければなりませんNEが格納されていると活性を失うことなく、少なくとも2回の凍結融解サイクルを受けることができます。
8。代表的な結果
最近では、スプライシングにRNAP IIの転写を結合するためのin vitro系で効率的に2-5を開発されました。これらのシステムは、バルクで成長したHeLa細胞を用いたため、急速に複数のサンプルに特異的な細胞治療の効果をテストするに従順ではありません。このようなニーズに基づいてndは小規模な抽出プロトコルの一般的なユーティリティでは、(説明を参照)、我々は、堅牢な小規模の核抽出法を確立した。バルク核抽出物の小規模な核抽出物でRNAP II転写/スプライシング反応を比較する代表的なデータを図2に示します。 CMVプロモーターを含む、標準的なスプライシングの基質(FTZ 3、 図2A)をコードする CMV-DNAコンストラクトは、分析のために使用されていました。この構造は、バルク(レーン1-3)または小規模(レーン4-6)エキスでインキュベートされたときに、初期のpre-mRNAの同様のレベルは5分の時点で合成した( 図2、レーン1と4 。)さらに、転写をブロックするα-アマニチンを添加した後、スプライシング中間体およびスプライスの製品は、抽出物の両方のタイプ( 図2、レーン2、3、5、6)で同様の動態を時間の経過とともに蓄積された。これらの代表的な結果は、クーデターの効率化 LED RNAP II転写/スプライシングシステムは、バルクと小規模核抽出物に似ています。
小規模な抽出方法の有用性を実証するために、抽出物は、スプライシング阻害剤で処理したHeLa細胞、E7107、または陰性対照化合物プラジエノライドF 6,7から調製し、次いで結合RNAP II転写/スプライシングアッセイを行った。 図3に示すように、RNAP IIによる転写は、プラジエノライドFとE7107処理した細胞(10分の時点)の両方から調製した抽出液で効率的に発生しました。対照的に、選択的スプライシングは、プラジエノライドF処理した細胞から調製した抽出液では正常に発生したが、E7107で処理した細胞( 図3、20から60分時点)に廃止された。これらのデータは、小規模のセルの特別な治療のために小規模の核抽出物を使用するための概念の証拠を提供しています。
JPG "/>
図1。小規模エキスプロトコルの概略は、ステップ P1を。細胞を低張緩衝液の添加によりセルリフターや腫れを使用して、プレートから採取した単層として栽培されています。 P2を入れます。細胞は、ダウンスホモジナイザーを用いて溶解し、ペレットに核を遠心分離しています。 P3を入れます。核が細胞質から分離し、塩の抽出を受けています。 P4を入れます。核抽出物を濃縮し、透析されています。 P5を入れます。結果は、核抽出物が機能していることを示して(より詳細については、 図2を参照)が得られる。
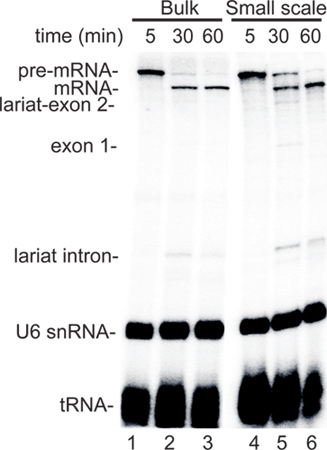
図2。小規模の核抽出物は、結合RNAP II転写/スプライシングアッセイで堅牢です。A.結合RNAP II転写/スプライシングのために使用CMV-FTZのDNAテンプレートの模式図。 CMVプロモーターとエクソンとイントロンのサイズが示されている。結合RNAPのB.の比較バルク核抽出物または小規模の核抽出物のいずれかを使用して、II転写/スプライシングアッセイ。転写とスプライシングの5分、30分および60分で発生させた後、α-アマニチンが追加されました。 RNAを抽出し、分画し、5パーセント変性ポリアクリルアミドゲル上およびphosphoimagerによって検出された。スプライシング中間体および製品が示されています。内因性のU6 snRNAのとtRNAは抽出物中に存在する、それが32インキュベーションの間にP-ラベルされ示されています。結合RNAP II転写/スプライシングシステムの詳細なプロトコルのための3を参照してください。
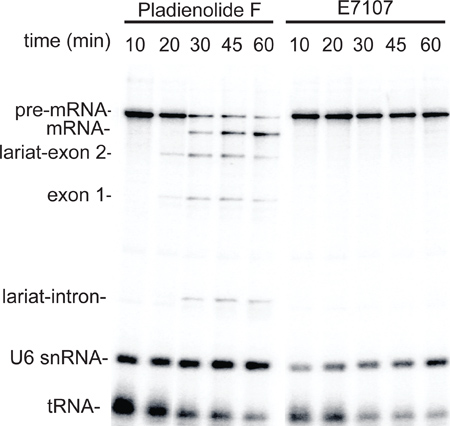
図3。スプライシング阻害薬E7107で処理したHeLa細胞から調製した小規模な核抽出物は、スプライシングに欠陥があります。細胞は、3μMで処理したプラジエノライドFまたはE7107として6に記載して、小規模の核抽出物を調製するために使用されます。時間経過は図2と同様に転写/スプライシングアッセイを用いて行った。スプライシング中間体、製品、およびU6 snRNAのとtRNAが示されている。
ディスカッション
我々は、単層として成長したHeLa細胞の少量からの核抽出物を調製するための迅速かつ再現性のある方法を確立しています。我々は、これらの抽出物はRNAP II転写/スプライシングアッセイの動態と効率が小規模とバルク核抽出物と同様であることを示すことによって、堅牢であることを実証した。我々はスプライシング阻害薬で処理した細胞から調製した抽出物は、転写の活性が選択的スプライシングの欠陥であることを示すことによって、抽出の有用性を示した。
小規模の核抽出物を調製するために我々の手法は、以前大規模な1,8の懸濁液中で増殖させたHeLa細胞から抽出し、抽出し9の小規模な製造方法を作るために確立された方法を組み合わせて最適化することによって設立されました。前の小規模な抽出物はいくつかのアッセイのための機能ではなかったので、私たちはそのような結合転写/ SPのように、我々のプロトコルを確立しアッセイをlicing。前の小規模なプロトコル9と我々の重要な違いは、以前のプロトコルは小さなゲージの針9を介してそれらを押すことによって細胞を溶解したのに対し、我々はミニダウンスを用いて細胞を溶解するための条件を最適化することである。抽出物は、いくつかのアッセイのために再現することが非アクティブおよび/または困難であった理由を説明することが気泡の針溶解の結果、。我々はまたプロトコルへの濃縮工程を追加しました。このステップでは、濃度に非常に敏感で抽出、の活性を増加し、また、小規模の準備に固有である抽出の間にばらつきが制限されます。最後に、私たちの準備が日常的に大量の抽出物と比較して、活動に重要な影響を与えることなく、単層細胞の3つのみ150ミリメートルのプレートを用いて実施される。したがって、プロシージャは高価な試薬や限られた細胞の可用性を必要とする小規模の準備のために容易に適している。たとえば、我々は、SMAを用意しましたLL-スケールのRNAiノックダウン細胞から慢性リンパ性白血病(CLL)患者の細胞から抽出し、機能的および/または生化学的アッセイ(EGF、JLH、TYとRR、未発表)のためにこれらの抽出物を使用していました。我々は、抽出物は、そのようなimmunopreciptations、西部、および銀染色などの特定の生化学的アッセイ、続いてRNAiに貴重であることを見出した。特定のタンパク質をノックダウンの有効性を確立した後、より詳細な研究は、低コストで追加の抽出物を調製するために使用することができ、安定したノックダウン細胞株を作ることによって行うことができる。これらのノックダウン細胞株から得られた免疫沈降物中に存在するタンパク質の質量分析は、メソッドの有用なアプリケーションになります。ここで我々のプロトコルを記述するための例として使用した結合転写/スプライシングアッセイに加えて、小規模の抽出物は、さまざまな世紀に使用されるものとして、多くの機能や生化学的アッセイに一般的に適用する必要があります遺伝子発現のEPS(キャッピング、スプライシング、転写、ポリアデニル化、microRNAの処理など)。プロトコルはまた、いずれかの懸濁液中で得られた(例えば、CLL細胞など)、または(例えば、患者の線維芽細胞など)を培養で増殖することができ、患者の細胞型に適応することができます。最後に、プロシージャの間に得られた細胞質画分は細胞質を必要とする機能や生化学的アッセイの両方に有用であることが分かるはずです。
開示事項
この記事への生産とフリーアクセスは、アブカムは、PLCが主催しています。
謝辞
我々は、有用な議論M. Winkelbauer·ハート、E.イブラヒム、P.バレンシア、K. Dufu、H.チェンに感謝しています。 HeLa細胞は、ナショナル細胞培養センター(ミネアポリス、MN)から得られた。また、光学顕微鏡のヘルプはハーバードメディカルスクールでE7107とニコンイメージングセンターを提供するためにエーザイ株式会社に感謝します。この作品は、JLHにRRとEGFとNRSAフェローシップにNIHの助成金GM043375によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 試薬のフルネーム | 会社 | カタログ番号 |
| HEPES | 4 - (2 - ヒドロキシエチル)ピペラジン-1 - エタンスルホン酸 | シグマ | H3375-500G |
| のMgCl 2·6H 2 O | 塩化マグネシウム六水和物 | シグマ | M2670-500G |
| 塩化カリウム | 塩化カリウム | フィッシャー | P335-212 |
| PMSF | フェニルメタンスルホニルフッ化物 | シグマ | P7626-100G |
| DTT | ジチオスレイトール | バイオ分析アメリカン | AB00490-5G |
| EDTA | エチレンジアミン四酢酸二ナトリウム二水和物 | バイオ分析アメリカン | AB00500-01000 |
| グリセロール | MPのバイオメディカル | 800689 | |
| DMEM | ダルベッコの最小必須培地 | インビトロジェン | 11995-073 |
| FBS | ウシ胎児血清 | ギブコ | 16140 |
| ペニシリン/ストレプトマイシン | ギブコ | 15070 | |
| PBS | リン酸緩衝生理食塩水 | Cellgro | 21から040-CV |
| トリパンブルーは0.4%の染色 | ギブコ | 15250 | |
| セルリフター | コーニング | 29442-200 | |
| 150ミリメートルプレート | VWR | 353025 | |
| 拡張されたマイクロピペットチップ | デンヴィル | P1126 | |
| タイト乳棒でダウンスホモジナイザー、1ミリリットル、 | ホイートン | 357538 | |
| Slidealyzers、MWCO 10kDa | ThermoScientific | 69572 | |
| ミニCentricons、MWCO 3kDa | ミリポア(アミコン社製) | UFC500396 |
表1特異的試薬および装置。
| ソリューション | 最後の | 株式 | ディスペンス |
| 低張の | 10mMのHEPES、pHが7.9 | 1M HEPES、pHが7.9 | 5ミリリットル |
| 1.5 mMのMgCl 2 | 1MのMgCl 2 | 750μlの | |
| 10mMのKClを | 3MのKCl | 1.67ミリリットル | |
| 0.2mMのPMSF | 200mMのPMSF | 500μlの | |
| 0.5mMのDTT | 2M DTT | 125μlの | |
| 水で500mlに持ち出す | |||
| 低塩 | 20mMのHEPES、pHが7.9 | 1M HEPES、pHが7.9 | 2ミリリットル |
| 1.5mMのMgCl 2 | 1MのMgCl 2 | 150μlの | |
| 20mMのKClを | 3MのKCl | 667μlの | |
| &nbのSPの; | 0.2mMのEDTA | 0.5M EDTA | 40μlの |
| 25%のグリセロール | グリセロール | 25ミリリットル | |
| 0.2mMのPMSF | 200mMのPMSF | 100μlの | |
| 0.5mMのDTT | 2M DTT | 25μlの | |
| 水で100mlに持ち出す | |||
| 高塩 | 20mMのHEPES、pHが7.9 | 1M HEPES、pHが7.9 | 2ミリリットル |
| 1.5mMのMgCl 2 | 1MのMgCl 2 | 150μlの | |
| 1.4MのKCl | 3MのKCl | 48ミリリットル | |
| 0.2mMのEDTA | 0.5M EDTA | 40μlの | |
| 25%のグリセロール | グリセロール | 25ミリリットル | |
| 0.2mMのPMSF | 200mMのPMSF | 100μlの | |
| 0.5mMのDTT | 2M DTT | 25μlの | |
| 水で100mlに持ち出す | |||
| 透析 | 20mMのHEPES、pHが7.9 | 1M HEPES、pHが7.9 | 10ミリリットル |
| 100mMのKCl | 3MのKCl | 16.625ミリリットル | |
| 0.2mMのEDTA | 0.5M EDTA | 200μlの | |
| 20%のグリセロール | グリセロール | 100ミリリットル | |
| 0.2mMのPMSF | 200mMのPMSF | 500μlの | |
| 0.5mMのDTT | 2M DTT | 125μlの | |
| 水で500mlに持ち出す |
表2。核抽出物の調製のためのソリューション。
参考文献
- Krainer, A. R., Maniatis, T., Ruskin, B., Green, M. R. Normal and mutant human beta-globin pre-mRNAs are faithfully and efficiently spliced in vitro. Cell. 36, 993-1005 (1984).
- Ghosh, S., Garcia-Blanco, M. A. Coupled in vitro synthesis and splicing of RNA polymerase II transcripts. Rna. 6, 1325-1334 (2000).
- Das, R. Functional coupling of RNAP II transcription to spliceosome assembly. Genes Dev. 20, 1100-1109 (2006).
- Hicks, M. J., Yang, C. R., Kotlajich, M. V., Hertel, K. J. Linking splicing to Pol II transcription stabilizes pre-mRNAs and influences splicing patterns. PLoS Biol. 4, e147 (2006).
- Yu, Y., Das, R., Folco, E. G., Reed, R. A model in vitro system for co-transcriptional splicing. Nucleic Acids Res. 38, 7570-7578 (2010).
- Kotake, Y. Splicing factor SF3b as a target of the antitumor natural product pladienolide. Nat. Chem Biol. 3, 570-575 (2007).
- Folco, E. G., Coil, K. E., Reed, R. The anti-tumor drug E7107 reveals an essential role for SF3b in remodeling U2 snRNP to expose the branch point-binding region. Genes. 25, 440-444 (2011).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res. 11, 1475-1489 (1983).
- Lee, K. A., Bindereif, A., Green, M. R. A small-scale procedure for preparation of nuclear extracts that support efficient transcription and pre-mRNA splicing. Gene Anal. Tech. 5, 22-31 (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved