このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
三次元蛍光画像から細胞形態の変化を定量分析ツール
要約
我々は、単一細胞の三次元共焦点蛍光から取ら未定義形状の形態の変化を測定するためにImaris神経科学、ImarisXTとMATLABを利用したソフトウェアプラットフォームを開発しました。この新しいアプローチは、受容体活性化に続く細胞形状の変化を定量化するため、創薬のための可能な追加ツールを表すために使用することができます。
要約
蛍光画像を測定するための最も一般的なソフトウェア分析ツールは、2次元(2D)のデータポイントの包含と除外のためのマニュアル設定に依存するデータ、分析の解釈と所見をサポートするためにコンピュータ支援パターン認識のためのものです。それは、細胞ダイナミクスの複雑さをキャプチャし、生物系内の細胞の可塑性の基礎を理解することができるようにするために、3次元(3D)データセットから構成され、蛍光像を測定することができるようにすることがますます重要になってきている。洗練された顕微鏡の楽器は、マルチスペクトル蛍光画像の取得と、収集した2D画像の3D表現を提供する共焦点スタックから画像を再構成する強力な解析ソフトウェアを介して3次元蛍光画像の可視化を許可されています。先進的なデザインをベース立体学法は、原送信の近似や仮定から進展している複雑な組織切片でも2リットルモデルベースの立体学1。顕微鏡でこれらの科学的進歩にもかかわらず、必要性が完全に細胞形態、タンパク質の局在化と受容体の輸送の複雑な変化の分析と定量化を可能にするために本質的な3Dデータを活用して自動化された分析方法のために残してあります。
蛍光画像を定量化することが可能な現在の技術は、メタモーフ(Molecular Devices社、米国カリフォルニア州サニーベール)とマニュアル分析を提供する画像J(NIH)を含む。 Imaris(アンドール·テクノロジー、ベルファスト、北アイルランド)ソフトウェアは、ボリューム·イメージに入れたり、3Dオブジェクトを作成するには、2Dスライスのシリーズで描くことができる測定ポイントの手動作成を可能にする機能MeasurementProを提供します。このメソッドは、2つのオブジェクト間のラインの距離を測定したり、関心のある領域を囲むポリゴンを作成するためにシングルクリックポイント測定に便利ですが、それはCOMPLに適用することは困難である旧セルラーネットワーク構造。フィラメントトレーサー(アンドール)ただし、このモジュールはそのような樹状突起、軸索と棘(構造木のような)で構成されている神経細胞のように定義された構造を測定するために開発されたフィラメント状の3D神経を自動的に検出します。このモジュールは、巧妙に非神経細胞3への形態学的測定を行うために利用されているが、出力データではなくアモルファス状の細胞モデルというより定義されたセルの形状に依存するソフトウェアを使用して拡張セルラーネットワークの情報を提供します。アモルファス状の細胞を分析し、生物学的なアプリケーションへのソフトウェアは、より適切な意思の問題を克服するために、ImarisはImaris Cellを開発しました。これは、細胞内小器官との間の関係を計算するために開発されたEidgenössische工科音楽大学との科学的なプロジェクトだった。ソフトウェアは、セルごとに1つの原子核を強制することにより、生物学的な制約の検出を可能にしますが、およびセグメント細胞に細胞膜を使用して、それが理想的には空隙なしで細胞表面を作成するため、連続していない蛍光データを分析するために利用することはできません。我々の知る限り、現時点では3Dの蛍光画像から地形情報を提供するには、ユーザーによる変更が可能な自動化されたアプローチは、未定義の形状( 図1)の細胞空間情報を達成することが開発されていない。
我々は、MATLAB(マットワークス株式会社)にインターフェースImarisコアソフトウェアモジュールとImaris XTを使用して分析プラットフォームを開発しました。これらのツールは、事前定義された形状とすることなく、一貫性のない蛍光ネットワークコンポーネントを持つ細胞の三次元計測を可能にします。さらに、この方法は、コンピュータのアプリケーションに精通している生物学的システムの専門知識を拡張しますが、していない研究者は、細胞動態の形態学的変化の定量を行うことができます。
プロトコル
1。シングルセル表現型変化の三次元形態計測分析
- ヒト胚腎臓(HEK293)細胞をトランスフェクションした赤血球凝集素(HA)コルチコトロピンとしてGタンパク質共役受容体(GPCR)は、以前4 5因子受容体2(CRF-R2)の説明解放タグ付き。
- 細胞は、AS(CRF-R2の内因性リガンド、副腎皮質刺激ホルモン放出因子、CRF(1μM、30分)、または選択CRF-R2の拮抗薬、抗ソーバジン30で前処理で刺激し、(無治療、NT)、未処理のままにした-30、1μM、アゴニスト処理前30分)。
- 次いで、細胞を固定し、透過処理し、抗HAで処理した。 CRF-R2はアレクサ594 nmの抱合抗マウス抗体(IgG 1)抗体を用いて可視化した。 DAPIを核分裂段階を可視化するために使用されていました。
- 実験者の主観性を制限するために、実験条件は、画像が取得され、分析された後まで知られていなかった。
- 我々は、画像を取得しましたプラン·アポクロマート63x/1.4油DIC目的とヴェルディ-V5レーザーとミラ900-Fのレーザーシステムで構成コヒーレント統合された二光子レーザーシステムに接続されたZeiss LSM 510 META共焦点顕微鏡を用いて固定したHEK293細胞からだ。
- データ収集プロセスの間に、細胞は両外側の細胞外受容体に核膜からのデータを含めるようにマルチスペクトルセクショニング、488 nm、および790 nmの(〜350 nmの2PH例)およびzパーティショニング(0.5μm刻み)によって区画された四肢。
- 蛍光データは初の3D顕微鏡データセットの可視化とセグメンテーションを可能Imarisを使用して処理され、立方ボクセルから成る3Dモデルは形態学的分析のために作成されました。
その後、Imaris XTモジュールは、GPCRの拡張の座標点を決定するために、MATLABのコンピュータプログラム言語とのインタフェースImarisに利用されました。
アカウントセルラーばらつきを考慮するために、我々は蛍光画像鐸を取得し、分析22細胞からEN:アゴニスト治療(n = 7)の前に無治療(NT)(n = 7)で、アゴニスト(CRF)の治療(n = 8)および拮抗薬による前治療(AS-30)( 図2) 。- 関心領域(ROI)は、アクティブ分裂の段階ではなく、他の細胞に接近していない一つのセルを含める必要があります。このように、分析は1つの核とレセプターの拡張子を持つ細胞が他の細胞の近接によって乱されていないが含まれます。
- 細胞の3D構造は、第1 Imaris(v.7.1.1)を使ってマルチスペクトル蛍光データから再構築されました。
- Imarisによって設計されたアルゴリズムに続いて、第一面のレンダリングは核膜を表すために利用された。 ROI内の複数の核がある場合Imarisあるかどうかを判別します。
- 次にスポット作成のアルゴリズムは、CRF-R2の拡張子を検索するために利用された。それがバックグラウンドノイズとの不規則な強度を補償するため、スポットの検出を利用したアモルファス状の細胞の複雑なネットワーク。
- CRF-R2の蛍光検出の各ユニットの含有を最大化するために、スポット '直径はガウシアンフィルタを用いて測定された強度の形で明確な情報を推定する画像内の最小単位である0.2μm以下に設定した。スポットフィルタリングがスポット自動作成プロセスに組み込まれました。ソフトウェアは、しかし、ユーザにパラメータを定義するには、フィルタを使用するための柔軟性を与える。
- データの切り捨てを回避するために、データ·セットは、32ビットの小数に、8ビット(符号なし)固定点から変換された。
- ボクセル強度データは、MATLABとのインタフェースImaris XTのモジュールを使用して座標データを発見するために交換し、各スポットの正確な空間的位置は、基準点( 図3)のように核膜を用いた距離変換を実行することによって決定された。
- 得られたデータは、sのためのグラフィカル形式で定量化し、提示することができるtatistical分析。群間の比較は、二元配置ANOVAとBonferroniの事後テストを用いて行った。データは平均±SDとして提示されます。違いは、* p <0.05で有意であると見なされている。計算は、GraphPad Prism 5.02( 図4)を用いて行った。
2。代表的な結果
我々のアプローチの力を発揮するために、我々は細胞の変化を定量化しているGタンパク質共役受容体(GPCR)と副腎皮質刺激ホルモン放出因子、トランスフェクトしたHEK293細胞での内因性リガンドとレセプターのCRF-2(CRF-R2)の相互作用から生じる。
我々は、CRF-R2受容体は細胞( 図2Aおよびムービー1)の膜の有限地域から原形質膜とプロジェクトに配置されていることを示している。従来の2次元解析を用いて、それは我々が受容体の接着poを分析する場合にのみ、外CRF-R2受容体のこの部分集合を検出することが可能であるガラス上のintはカバーしています。その結果、私たちは、Z-スタック型マルチスペクトルデータ( 図5)から派生した他の情報が失われます。
形質膜からスポットまでの距離の減少によって示されるように、細胞はCRFで処理されると、細胞外受容体は大幅に削減されます。彼らはまた、主に有限の場所から離散した位置( 図2Bと映画2)の数に再配布されます。
レセプター膜分布にCRFの効果は、CRF-R2の特異的アンタゴニスト、antisavagine 30(AS-30)を用いた前処理により防止と私たちは、CRF-R2の拡張子は( 図2Cおよびムービー3)変更しないことを見つけることです。
スポットの遠位分布は、5μmのスペクトル色分けされた間隔でプロット核膜からボクセルの距離を視覚化するために利用される。無治療と拮抗pretreatmんENT(AS-30、1μM、30分)アゴニスト治療の前には(CRF、1μM、30分)、GPCRの収縮に有意(ns)の違いを示していない。アゴニストで細胞を処理(CRF、1μM、30分)が徐々に無治療と比較したCRF-R2の含有ボクセル、0から5ミクロン(ns)で、6月15日程度(の数を減らし**はp < 0.01)、> 15μm以下(*** P <0.005)、またはAS-30治療、0から10ミクロン(ナノ秒)、11から15ミクロン(** p <0.01)とに比べて> 15ミクロン(*** P <0.005)( 図4)。
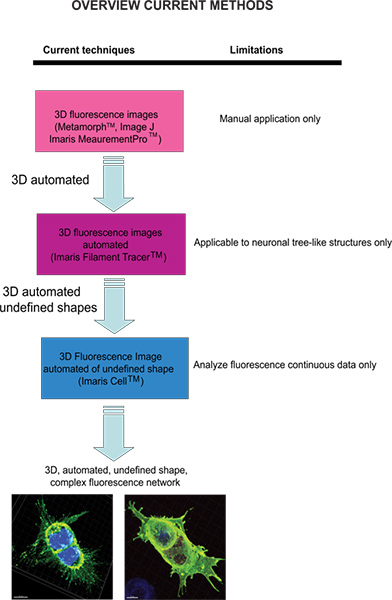
図1。現在利用可能な技術と蛍光画像を分析する彼らの限界の図は拡大図を表示するには、ここをクリックしてください 。
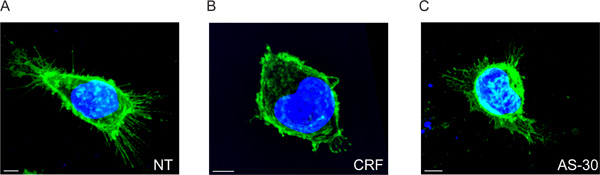
図2アゴニストおよびアンタゴニスト処理前と処理後のHA-CRF-R2を使用して、HEK293トランスフェクトされた細胞の3次元マルチスペクトル蛍光画像。マージされたイメージを示す抗HAを使用して、HA-CRF-R2は、プローブおよびAlexa 488標識抗マウス抗体(IgG 1)二次抗体を用いて可視化し、DAPIで核を可視化するために使用されていました。画像は、共焦点レーザー走査(CLS)に顕微鏡を用いて取得した。スケールバーは5μm。
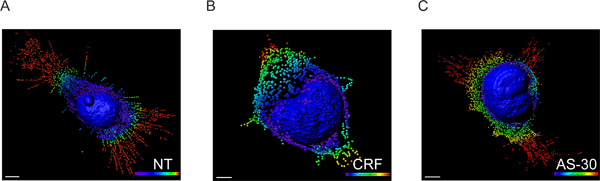
図3:HA-CRF-R2を使用して、HEK293、トランスフェクトされた細胞の3次元モデルがImarisソフトウェアを使用して、CLSの画像から再構築。小胞に変換GPCRの拡張を記述する核とスポット作成の表面レンダリング。蛍光データは初の3D顕微鏡データセットの可視化とセグメンテーションを可能Imarisを用いて処理した。その後、Imaris XTは、MATLABとのインタフェースImarisに利用されました。ボクセル強度に交換しましたスポット座標。スポットスペクトル色分け(青0から5ミクロン、緑、6-10ミクロン、11から15μmの黄色と赤> 15μm)の距離形核膜を表しています。スケールは5μm。
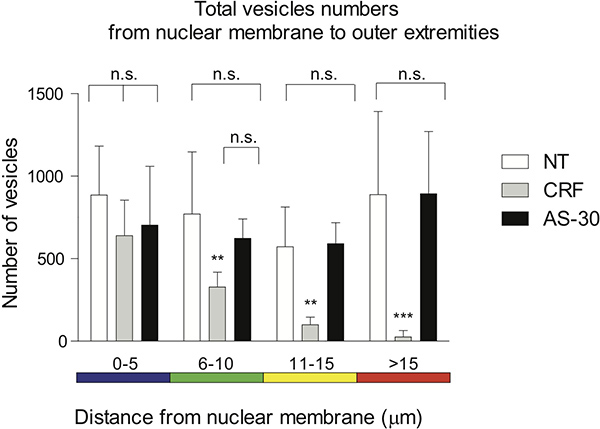
図4スポットの遠位分布のグラフィック表現が5μm間隔でコード化されたスペクトル色にプロットは核膜からボクセルの距離を視覚化するために利用される。アゴニスト処理前の拮抗(AS-30、1μM、30分)(CRF、1μM、30分)と無治療と前処理は、GPCRの収縮に有意(ns)の違いを示していない。治療なし0から5ミクロン(ns)で、6月15日程度(**はpと比較した場合、アゴニストで細胞を処理(CRF、1μM、30分)は、徐々に数CRF-R2を含むボクセルの距離が短縮され<0.01)、> 15μm以下(*** P <0.005)、またはAS-30 0から10μmの治療(ns)で、11月15日ミクロン(** p <0.01)および> 15ミクロン(*** P <0.005)。
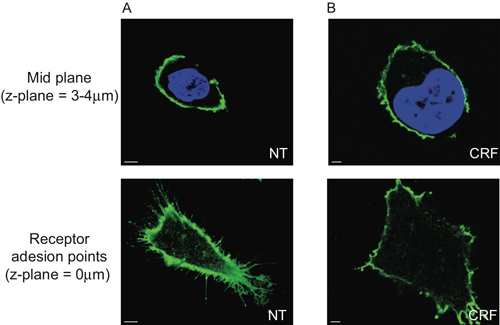
図5:HA-CRF-R2とHEK 293トランスフェクトされた細胞の二次元形態計測分析の限界。核の中心を示す細胞の中央平面部(ガラスカバースリップ上の3-4μmで)はDAPIおよびHA-CRF-R2を用いて可視化抗-HAを使用してプローブとAlexa 488nmの結合抗マウス抗体(IgG 1)二次を用いて可視化受容体の付着点が劇的に異なっていながら、抗体とCLSで取得したが、(A)は無治療(NT)と(B)のアゴニスト(CRF、1μM、30分)の間に違いを見せていない。
映画は1。自由受容体タンパク質のうち、細胞の表現型の違いを評価するために、HA-CRF-R2とHEK 293トランスフェクトされた細胞の"サーパス"モードでは、無治療で3Dモデルを回転させる。 5〜20μmであるからスケールバー。/ files/ftp_upload/4233/4233movie1.avi "ターゲット=" _blank ">ムービーを見るにはここをクリックしてください。
映画は2。自由受容体タンパク質のうち、細胞の表現型の違いを評価するために、HA-CRF-R2とHEK 293トランスフェクトされた細胞、アゴニスト処理、CRF(CRF、1μM、30分)の"サーパス"モードで3Dモデルを回転させる。 5〜20μmであるからスケールバー。 ムービーを見るにはここをクリックしてください。
ムービーのHA-CRF-R2とHEK 293トランスフェクトされた細胞の"サーパス"モードで3。自由に回転する3D、アゴニスト処理前の拮抗薬を用いた前処理(AS-30、1μM、30分)(CRF、1μM、30分)受容体タンパク質のうち、細胞の表現型の違いを評価する。 5〜20μmであるからスケールバー。 ムービーを見るにはここをクリックしてください。
ディスカッション
我々は、CRFの治療は、その形態やCRF-R2の位置に大きな変化を誘導することを示した。 CRF-R2の変化は選択的アンタゴニスト処理により抑制された。我々は、受容体の変更が検出されなかった、標準的な2Dマルチスペクトル技術を用いて測定することができないことを示した。複雑な3D映像を勉強する能力が形態学的分析のための生物学的パラメーターの複雑さを取り入れることが重要です。我?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々はImaris、Imaris XTとMatlabの使用のためにカリフォルニアの生体イメージング技術開発センター(BIDC)大学サンフランシスコ校に感謝します。我々は、原稿の編集への貢献のためにLK Floren、L. Daitch、技術支援のために、ヘンリーVでKharaziaに感謝します。 1R21DA029966-01と薬局のSEBは、UCSFの学校にMLSMRコレクションをスクリーニングするためのNIHのファストトラック賞(:この作品は、SEB、国立衛生研究所(NIH)にUCSFを通じてアルコール&薬物乱用のカリフォルニア医学研究の国家からの資金によって支えられディーンのOfficeと臨床薬学)とCLHKに医学部(臨床薬理·実験治療)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| ヒト胚腎臓(HEK293) | アメリカン·タイプ·カルチャー·コレクション | CRL-1573 | |
| ダルベッコ改変イーグル培地(DMEM) | インビトロジェン | 11965118 | |
| ウシ胎児血清(FBS) | インビトロジェン | SH30070.03 | |
| AlexaFluor-488(IgG2bで) | インビトロジェン | -11001 | |
| モノクローナル抗HA.11抗体(IgG 1) | Covance | 16B12 | |
| DAPI | ベクターラボラトリーズ | H-1200 | ; |
| CRF | シグマ | C2917 | |
| Antisauvagine-30(AS-30) | シグマ | A4727 |
参考文献
- West, M. J. Design-based stereological methods for counting neurons. Prog, Brain Res. 135, 43-51 (2002).
- Burke, M., Zangenehpour, S., Mouton, P. R., Ptito, M. Knowing what counts: unbiased stereology in the non-human primate brain. J. Vis. Exp. (27), e1262 (2009).
- Sugawara, Y., Ando, R., Kamioka, H., Ishihara, Y., Honjo, T., Kawanabe, N., Kurosaka, H., Takano-Yamamoto, T., Yamashiro, T. The three-dimensional morphometry and cell-cell communication of the osteocyte network in chick and mouse embryonic calvaria. Calcif. Tissue Int. 88, 416-424 (2011).
- Vickery, R. G., von Zastrow, M. Distinct dynamin-dependent and -independent mechanisms target structurally homologous dopamine receptors to different endocytic membranes. J. Cell Biol. 144, 31-43 (1999).
- Bartlett, S. E., Enquist, J., Hopf, F. W., Lee, J. H., Gladher, F., Kharazia, V., Waldhoer, M., Mailliard, W. S., Armstrong, R., Bonci, A. Dopamine responsiveness is regulated by targeted sorting of D2 receptors. Pro.c Natl. Acad. Sci. U.S.A. 102, 11521-11526 (2005).
- Gordon, A., Colman-Lerner, A., Chin, T. E., Benjamin, K. R., Yu, R. C., Brent, R. Single-cell quantification of molecules and rates using open-source microscope-based cytometry. Nat. Methods. 4, 175-181 (2007).
- Schock, F., Perrimon, N. Molecular mechanisms of epithelial morphogenesis. Annu. Rev. Cell Dev. Biol. 18, 463-493 (2002).
- Pincus, Z., Theriot, J. A. Comparison of quantitative methods for cell-shape analysis. J. Microsc. 227, 140-156 (2007).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. Measurement of single-cell dynamics. Nature. 465, 736-745 (2010).
- Loo, L. H., Wu, L. F., Altschuler, S. J. Image-based multivariate profiling of drug responses from single cells. Nat Methods. 4, 445-453 (2007).
- Yarrow, J. C., Totsukawa, G., Charras, G. T., Mitchison, T. J. Screening for cell migration inhibitors via automated microscopy reveals a Rho-kinase inhibitor. Chem. Biol. 12, 385-395 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved