このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ゼブラフィッシュ胚性神経上皮の透水性に関するアッセイ
要約
我々は、ゼブラフィッシュ胚の脳の透磁率のためのライブ全体の動物定量的な測定について説明します。技術は神経管管腔内に異なる分子量の脳脊髄液や分子を保持する能力を分析し、心室の彼らの動きを定量化します。この方法では、開発や病気時の上皮透過性と成熟の違いを判別するのに役立ちます。
要約
脳室系は、脊椎動物間で保存されていると脳の発達の初期段階で形成し、その動物の生涯にわたって維持されている脳室と呼ばれる相互接続された空洞のシリーズで構成されています。脳室系は、脊椎動物で発見され、心室は中央の管腔は脳脊髄液(CSF)の1,2を満たすと、神経管形成後に開発されています。 CSFは、正常な脳の発達と機能3-6必須であるタンパク質に富む流体である。
神経管が閉じられた後、ゼブラフィッシュでは、脳室のインフレ率は、約18時間後に受精(HPF)で始まる。複数のプロセスを透磁率とCSF産生を調節する神経上皮、タイトジャンクション形成の形成を含む脳室形成、関連付けられています。我々は、Na、K-ATPaseのこれらのすべてのプロセスに影響を与える、脳室のインフレのために必要であることを示したクロー5aはタイトジャンクションの形成9のために必要である間ES 7,8、。さらに、当社は、ミオシンの阻害を介して、胚性神経上皮のその "緩和"を示した脳室のインフレ率に関連付けられています。
ゼブラフィッシュの脳室の膨張時に透過性の調節を調べるために、我々は、心室色素保持アッセイを開発した。この方法では、蛍光脳脊髄液を標識するために、生きているゼブラフィッシュ胚、以前に我々の研究室で開発された10の技術で脳室注入を使用しています。胚は、その後、脳室と神経上皮を通して蛍光染料が移動すると時間をかけて結像される。染料前面が離れて時間をかけて神経上皮の基底(非管腔)側から移動する距離を定量化して、神経上皮透過性( 図1)の尺度である。我々は染料70 kDaと小さいが、神経上皮を通って移動することを観察し、detecteすることができます24 HPF( 図2)で、ゼブラフィッシュ胚の脳の外側D。
この色素保持アッセイを開発中に、異なる時間に、異なる遺伝的背景の様々な神経上皮透過性を分析するために使用され、環境変動の後にすることができます。また、CSFの病的集積を検討する上で役に立つかもしれません。全体的に、この手法は、研究者が開発と疾患の間に透磁率の役割と規制を分析することができます。
プロトコル
1。マイクロインジェクションのための準備
- サッター楽器ニードルプラーを使用してキャピラリーチューブを引いて、マイクロインジェクション針を準備します。
- 蛍光色素(FITC-デキストラン)とマイクロインジェクションニードルをロードします。
- マイクロマニピュレータおよびマイクロインジェクション装置に針を取り付けます。
- 慎重に幅約2μmに鉗子を用いてマイクロインジェクションニードルを破るが、これはあなたの微量注入器のセットアップに応じて異なります。私たちのマイクロインジェクション針の場合、これは曲がらない先端から針の第1の領域に対応しています。
- 各注射は1 nlを提供できるように、噴射時間と圧力を調整、油の中にドロップサイズを測定します。ハーバード装置マイクロインジェクターの設定例は次のとおりです。Pバランス= 1.4 psiでは、P = 1.4 psiのうち、Pは0.4から0.7秒の噴射時間と= 22.9 PSIは、Pクリア= 67.8 psiを注入します。これらの設定を使用して私たちの針の直径はおよそ2μmである。ただし、設定はマイクロインジェクター具体的に、と変化します針径にccording。
2。胚の準備
- 各条件について、水に1%アガロースでコート2皿を、1から200μlのピペットチップでアガロースに穴を突く、アガロースプラグを取り外します。胚メディアで料理を記入してください。
- 鉗子、18 HPFまたは実体顕微鏡下で古いdechorionate胚を用いた。胚は、キンメルらによるステージングされます11。
- 第一アガロースコーティングされた皿にdechorionated胚を転送します。
- 胚は(ウェスター12に従って製)移動を停止するまでの胚を麻酔し、皿にtricaine(0.1 mg / ml)を加える。
3。脳室を注入
- オリエント胚従ってあなたは穴に胚の尾部を置くことによって、彼らの背側を見ている。あなたのマニピュレーターが右側にある場合は、前脳が右に左と後脳になるように、胚を移動します。
- 無線で位置針後脳の脳室のdestポイント。
- 卵黄( 図1A)に脳の深さを通過しないようにしてある後脳室の慎重ピアス屋根板。
- 色素が脳室の全長をいっぱいに確実に心室に蛍光色素1-2のNLを注入します。
- 胚メディアに充填された第2のアガロースコーティングされた皿に胚を移し、再度麻酔として2.4で説明。
- セクション4で説明されるように直ちにゼロ時間の画像を得るために、イメージングを起動します。
4。イメージング
- 3.1で説明したように穴の中の彼らの尾を持つオリエント胚。
- 明視野像背を取るために、送信されたと蛍光の両方に光を解剖顕微鏡を使用しています。異なる胚のイメージングの間で倍率を一定に保つ。これは、イメージJを(5.2から6)を用いて実施し分析を直接比較することができます。
- 胚、顕微鏡やシャーレを移動することなく、かかる対応する蛍光画像。
- 希望する時点で各胚について、この手順を繰り返します。
5。染料運動の定量化
- 以前GutzmanとSive 10で説明したように、Photoshopで明視野と蛍光画像をマージします。
- 距離をチェックの利用可能なイメージJソフトウェアの染料前面に移動測定http://rsbweb.nih.gov/ij/を 。
- 画像Jのマージされたファイルを開くと神経上皮( 図1A)10から20°の角度で前方を染めるために前脳ヒンジ点から線を描画するためにラインツールを使用します。それは、野生型の神経上皮から漏れ出す色素の最初の、そして最も顕著な部位であるため、この地域が選択されました。
- ラインの長さを計算するために測定ツールを選択します。
- 各時点について、この手順を繰り返します。
- 染料前面が他の時点からt = 0での距離を減算することによって時間をかけて移動した正味の距離を計算します。
- 上のプロットグラフ。
6。代表的な結果
野生型の胚を用いた神経上皮透過性アッセイで得られた結果の一例を図1B-Dに示されている。正確に透過性を区別するためには、野生型またはコントロール胚( 図2)でわずかに漏れているサイズを識別異なる分子weightstoと染料をテストするのに便利です。これは、遺伝的変異または環境条件の識別を可能にし、そのいずれかの増加または減少は、透磁率( 図1D、緑と赤の線)であった。 24 HPFゼブラフィッシュの神経上皮のために、2時間かけてゆっくりと70 kDaのFITCデキストランリークを、2000 kDaではないし、ほとんどすぐに10kDaの漏れる一方。したがって70 kDaの増加と両方神経上皮透過性を減少させるという条件を識別するための理想的な分子量である。
針は、心室腔、蛍光ワットを逃した場合病気にt = 0で(たとえばGutzmanとSive、2009 10を参照)で、脳の外側に表示される。注入された色素は最初に脳内に含まれていなかったとneuropeitheliumの染料と透磁率の移動に関する明確な結論が出せないので、これらの胚は破棄されるべきである。
胚は小さな心室または非膨張脳室を持っている場合、最終的には生理食塩水で、心室の注入前は、蛍光色素の注入前に行うことができます。これは、蛍光色素で注入した場合、心室の後続の可視化が容易に心室を膨らませます。適切なコントロールは、生理食塩水の注入が正常な神経管の発達を混乱させるかどうかを判断するために実行する必要があります。
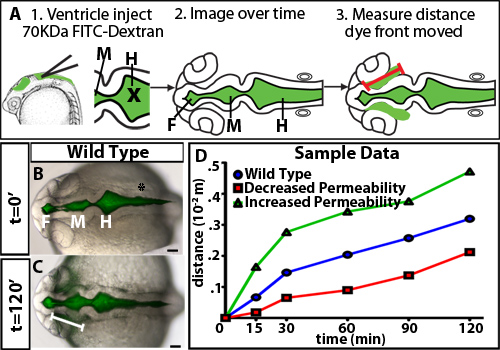
図1。分子量の異なる染料の時間経過。()実験図。最初の、蛍光色素が心室に注入される。 X注射用の針の位置=。次に背のイメージは時間をかけて取得されます。最後に、前脳ヒンジ点から染料フロントで移動距離が(赤線で表される)が測定されます。 (BC)22 HPF(t = 0分、B)と24 HPF(トン= 120分、C)で明視野と蛍光背画像を合併。白い線が前脳脳室から染料フロントの距離を示している。 (D)は架空のサンプル透過データ。青=野生型またはコントロール、コントロールと比較して増加透磁率の減少制御する相対浸透率、緑=サンプルで赤=サンプル。
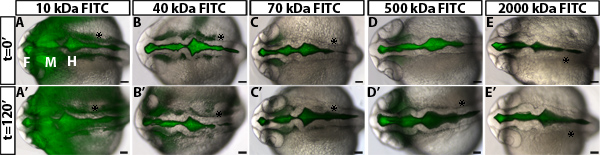
図2。異なる分子量の染料に神経上皮透過性の測定。= 0分、FITC-dを使って注射後(AE)は背マージ明とトンで22 HPF野生型胚の蛍光画像10 kDaの()、40 kDaの(B)は、70 kDaの(C)は、500kDaの(D)および2000 kDaの(E)は、次の分子量のエキストラン。トン= 24 HPFで120分でのように、(A'-E ')は同じ胚(AE)。左前方に。 F =前脳、中脳、M =、H =後脳。アスタリスク=耳。
ディスカッション
私たちは、与えられた分子量が注入された色素に決定されるように生きている胚ゼブラフィッシュの脳の透過性を定量化する能力を示す。ゼブラフィッシュ胚性神経上皮は分子量の異なる染料の差動透過性であるという我々の観察は、色素が傍細胞透過性を介して移動していることを示唆している。しかし、我々は、観測された透過性に経貢献の可能性を排除することはできません。この手?...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、国立精神衛生研究所、国立科学財団によってサポートされていました。専門家の魚の飼育のために多くの有益な議論や建設的な批判のためのSive研究室のメンバーに、オリヴィエPaugois氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| デキストラン、フルオレセイン、アニオン、リジン修正可能 | インビトロジェン | D7136、D7137、D1822、D1820、D1845 | |
| Tricaine粉 | シグマ | A5040 | |
| 毛細管 | FHC社 | 30-30-1 |
参考文献
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved