このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおける再発性ヘルペス性間質性角膜炎、人間のHSKを研究するためのモデル
要約
ヘルペス性角膜疾患のほとんどの研究は、一次感染モデルを使用しています。しかし、HSV-1の初感染は、典型的には、ヒトの疾患につながるものではない。ここでは、より密接に人間の病気を模倣ヘルペス性角膜疾患の再発モデルについて述べる。
要約
ヘルペス性眼疾患と呼ばれるヘルペス性間質性角膜炎(HSK)は、角膜の潜在的に失明に至る感染症であり、その治療のために30万人以上の通院各年の結果。臨床疾患を持つ患者の1〜2%が感染し、角膜の視力喪失を経験するでしょう。これらのケースの大半はヘルペスで潜伏感染の再活性化の結果は、私はウイルスではなく、急性疾患に起因する単純に入力されています。興味深いことに、急性感染症は、ほとんどの場合、この病気を研究するために使用されるモデルです。しかし、HSK試験の再発モデルは臨床疾患の間に発生するものをより反映であろうと感じました。 HSK試験のために再発の動物モデルは、ウサギとマウスの両方を採用してきた。ウサギの利点は、彼らは、任意の既知の刺激が存在しない場合の待ち時間から再活性化を経験するということです。それはウサギモデルがIMMUNを持っていないので、それは多くの免疫学的要因が再発HSK試験に果たす役割を探求することは困難である、と述べたマウスが持っているologicalと遺伝資源。再活性化は、UV-B光への曝露によって誘発されるので、我々はそれがそこには多くのリソースが利用可能であるという利点を持っており、また再活性化が発生するときに我々は知っているので、再発HSKのマウスモデルを使用することにしました。これまでのところ、このモデルでは、この病気に重要ないくつかの免疫学的要因を定義するためにそれを使用して、それらの研究室ができました。また、私たちは、治療およびワクチンの有効性の両方をテストすることができました。
プロトコル
動物のケアに注意してください:彼らは、抗炎症であり、したがってモデルをinvalidateするような鎮痛剤は、このモデルでは使用されません。
1。ウイルスの作製
- 細胞のすべてを持っている丸みを帯びたアップまで3-4日間感染の多重度0.01(T-150フラスコ、約5×10 5プラーク形成単位)の開始希釈を用いてVero細胞(80%コンフルエント)に、HSV-1を育てると簡単にフラスコを押すことで外れている。
- ℃、15分間3500 rpmで4時ソーバル伝説RTに滅菌遠心管と遠心分離機にメディアを取り出します。メディア合計5mlで各50mlチューブから上清(1.3を参照)、再懸大型ペレットを除去した後。 2 30秒のバーストで1分間超音波洗浄します。
- 上清を除去し、9,000 rpmで50ミリリットル滅菌オークリッジ管や遠心分離機に入れ、4℃で1時間°ベックマンJ2-21遠心分離機でC用。これは、小さなウイルスのペレットを製造することである。上清を捨てる。
- 1.2ウィットから超音波処理組み合わせるhを1.3からペレットと45秒のために再度超音波洗浄します。 4℃で5分間1,500 rpmでソーバル伝説RTで遠心℃、上清を保存します。これは-70℃で小分けして保存されているウイルスストック℃を構成する
- Vero細胞で力価ウイルス。 10 -8希釈(それぞれ10倍希釈である)2つの独立した希釈セットから2倍へ私は通常板10 0。ウイルスの力価測定は12ウェル滅菌プレート上で行われる。
2。マウスへの感染
- 麻酔cocktail/20グラムのマウスの体重(ケタミン、HBSSで希釈し60 mg / kgの+キシラジン5 mg / kg)を0.1mlの各マウスを注入します。それは適切な用量が使用され、この薬剤の効果は非常に短命であるアール麻酔の安全な手段の一つであるため、このカクテルに使用されます。
- マウスは、角膜に穴がないことを確認するために、解剖顕微鏡を用いて、30ゲージの針で右眼の角膜麻酔スクラッチあるとき。
- 各マウスRECE初感染時の損傷から角膜を保護するために、プールしたヒト血清(1:800の50%ウイルス中和のために有効な用量と抗HSV反応性シグマ、テメキュラ、カリフォルニア州)の1ミリリットルの腹腔内注射をived。
- 耳のクリップのいずれかで、または耳パンチで数匹のマウスを。
- すべてのマウス番された後、20μlのピペッターを使用して、我々は10 6 PFU(5μl)を使用して各眼に感染します。我々は、片目だけ、通常は右眼に感染します。我々はまた、彼らは麻酔している間に潤いを保つために、他の目にHBSSの5μlを置く。 5 ulは手続きが未満10分間で行われ、動物がそれに応じて麻酔薬を投与されているので目の水和を維持するのに十分である。感染症は、ベロメディア1mlに水和させた滅菌綿棒でマウスを3日後に感染を拭き取りにより確認されている。その後、100μlを48ウェルプレート中で増殖させたVero細胞に添加される。これらのプレートは、細胞変性効果のために毎日監視している (CPE)。
3。レイテンシからのマウスの再活性化
- マウスは一次感染後少なくとも5週間麻酔する。それは、我々は1年以下の初感染にマウスを再活性化しているし、それに応答して有意な差は認められていないことに留意すべきである。
- 一度麻酔それらはただ一つ目は、UV-B光にさらされるように302 nmのピーク波長でのUV-Bを発するTM20クロマト-VUトランスイルミネーターを配置されます。各マウスは250 mJのUV-B光cm 2にさらされている。
- 再活性化は、まず1から7までのポストのUV-B照射の日に次に0日にベロメディアの1ミリリットルに配置(自発sheddersために制御するために、UV-B曝露前)とされている滅菌綿棒で目を拭き取りによって決定されます。 2.5で説明したようにスワブ材料)が評価されます。感染性ウイルスを持っているそれらのスワブのウイルスの量は、12ウェルプレートを用いた標準的なプラークアッセイによりtitteredされています。
- マウスは、双眼実体顕微鏡を用いてマスクされた観察者によって臨床眼疾患のために評価されます。
- 角膜混濁が0クリアストロマを示す0〜4のスケールで評価され、1が軽度の間質混濁、2を示す識別可能な虹彩の機能と適度な不透明度を示し、3は瞳孔の余白を除いて定義された虹彩の細部が失われた状態で密な不透明度を意味し、4を示しノー後部を望む総不透明。
- 血管新生は、4つの等しい象限に角膜を分割し、これらの各象限における血管新生の程度を決定することによって、1から8までのスケールで評価されています。
- 眼瞼炎は、次のように測定されていない:0、全く病変; 1、最小限のまぶたが腫れ、2、中等度の腫れや無愛想な眼漏、3、重度の腫れ、適度な眼周囲の脱毛、皮膚病変、および4、目をまぶしたシャットダウンを伴う重度の腫れ、厳しい眼周囲の脱毛、皮膚病変。
- 脳炎もの含めるの証拠DEDは、バックフリルの髪、そして明らかな神経学的異常を覆いかぶさる。彼らは脳炎の重要な兆候を表示するときに、マウスを安楽死させています。
5。代表的な結果
上述した再発モデルは最初Shimeld らによって発表された1-3。彼らはテストの結果、私たちの研究室では、年4月15日の上に多くの原稿を公開するために、このモデルの修正版を使用してきました。モデルは、再発性HSV-1の10疾患におけるサイトカインインターフェロン-γの果たす役割を定義するために使用された。 図3に示すように、よりIFNγの表示悪化角膜疾患を欠損したマウスは、野生型マウスに14をしました。それはまた、いくつかの異なるワクチン構築6,10,11の治療的価値を定義するために首尾よく使用されていました。 1ケースでテストワクチンが予防的にうまくいきましたが、6治療的に有効であることが判明しなかったことに注意してください。しかし、複製能力のないウイルスワクチンを試験したとき、それは予防的に唯一の効果はありませんでしたが、治療的にも10,11非常に有効であった、参考文献10の図5を参照してください。さらに最近では、我々は性差が再発HSKを受けたマウスで検出可能であったかどうかを判断するために、このモデルを使用している。 図1が示すように 、雄のC57BL / 6マウス雌のC57BL / 6マウスの場合よりも有意に低い角膜混濁を表示します。同様に、角膜血管新生を評価したところ、雄マウスでは有意に少ない雌マウス( 図2)したより角膜の新しい血管の成長を示した。我々は現在、この表現型は、マウスの他の株で同様の分析を行うことにより、特定の菌株であるかどうかをテストしています。我々はまた、違いはテストステロンやエストロゲンの存在の欠如によるものであるかどうかを判断します。
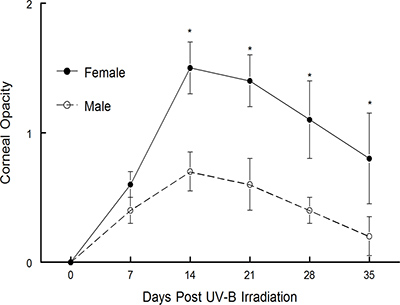
図1のUV-B誘発再活性化後に雄と雌のC57BL / 6マウス系統における角膜疾患。潜伏感染マウスは35日間角膜混濁についてモニターしたUV-Bを照射し、マウスで復活させるように誘導した。これらの研究のために使用したマウスの数は以下の通りであった:男性は、n = 15、女性は、n = 15。結果は平均値±SEMを示す。 *かなり大きいウイルス誘発性の疾患は、14から35日間のために雌のC57BL / 6マウス(P = 0.001から0.01)であった。
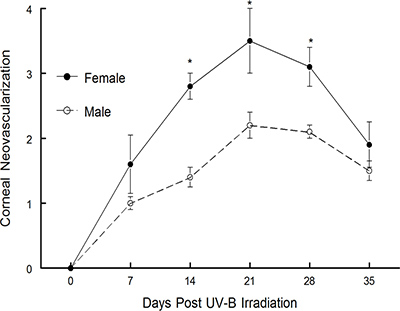
図2 UV-Bの再活性化によって誘導される、以下の雄と雌のC57BL / 6マウス系統における角膜疾患。潜伏感染マウスは35日間角膜血管新生のために監視されたUV-Bを照射し、マウスで復活させるように誘導した。これらの研究のために使用したマウスの数は以下の通りであった:男性は、n= 15;女性は、n = 15。結果は平均値±SEMを示す。 *かなり大きいウイルス誘発性の疾患は、14から28日間のために雌のC57BL / 6マウス(P = 0.001から0.01)であった。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ヘルペス性間質性角膜炎の再発モデル(HSK)は、ここで説明すると、研究者は、人間の病気の間に観察されているものとより一貫性のあるモデルで人間のHSK試験を勉強することができます。したがって、このモデルの強みは、病気は原発性疾患時の刺激によってすでに免疫システムのコンテキストで発生することがあります。これらのマウスはすでに、HSV-1に対する免疫応答を持っているの?...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
著者は、私たちにモデルを教えて助けるために博士ジェイPeposeに感謝したいと思います。この作品は、国民健康補助EY11885(PMS)の研究所、EY21247(PMS)と眼科に失明を防ぐための研究からの無制限の助成金によって支えられている。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D5796 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Human Serum | Sigma | S7023 | |
| L-Glutamine | Cellgro | 25-005-C1 | |
| Pen/ Strep | Sigma | P4333 | |
| Fungizone | Invitrogen | 15290018 | |
| Centrifuge | Sorvall | Legend RT | |
| Centrifuge | Beckman | 52-21 | |
| Transilluminatior | UVP | 95-0452-02 | |
| Sonicatior | Branson | Sonifier 450 | |
| Oak Ridge Tubes | Nalgene | Z 720410 | |
| Flasks- 7150 | Corning | 430823 | |
| Plates- 12 well | Corning | CLS 3513 | |
| Plates- 48 well | Corning | CLS 3548 | |
| Sterile Conical Tubes- 30 ml | Corning | CLS 430828 | |
| Sterile Cotton-tipped Applicators | Fisher | 23-400-125 | |
| 30G Needles | Becton-Dickinson | 305106 | |
| 25G Needles | BD | 305122 | |
| 10 ml Syringe | BD | 309602 | |
| 10 ml Syringe | BD | 309604 |
参考文献
- Shimeld, C., Hill, T. J., Blyth, B., Easty, D. An improved model of recurrent herpetic eye disease in mice. Curr. Eye Res. 8, 1193-1205 (1989).
- Shimeld, C., Hill, T. J., Blyth, W. A., Easty, D. L. Reactivation of latent infection and induction of recurrent herpetic eye disease in mice. J. Gen. Virol. 71, 397-404 (1990).
- Shimeld, C., Hill, T. J., Blyth, W. A., Easty, D. L. Passive immunization protects the mouse eye from damage after herpes simplex virus infection by limiting spread of virus in the nervous system. J. Gen. Virol. 71, 681-687 (1990).
- Laycock, K. A., Lee, S. F., Brady, R. H., Pepose, J. S. Characterization of a murine model of recurrent herpes simplex viral keratitis induced by ultraviolet B radiation. Invest. Ophthalmol. Vis. Sci. 32, 2741-2746 (1991).
- Keadle, T. L., Stuart, P. M. IL-10 ameliorates corneal disease in a mouse model of recurrent herpetic keratitis. Microbial Path. 38, 13-21 (2005).
- Keadle, T. L., Laycock, K. A., Miller, J. K., Hook, K. K., Fenoglio, E. D., Francotte, M., Slaoui, M., Stuart, P. M., Pepose, J. S. Efficacy of a recombinant glycoprotein D subunit vaccine on the development of primary and recurrent ocular infection with herpes simplex virus type 1 in mice. J. Inf. Dis. 176, 331-338 (1997).
- Keadle, T. L., Laycock, K. A., Pepose, J. S., Stuart, P. M. Proinflammatory cytokines IL-1 and TNF-a are required for recurrent herpetic keratitis in NIH mice. Invest. Ophth. Vis. Sci. 41, 96-102 (2000).
- Keadle, T. L., Usui, N., Laycock, K. A., Kumano, Y., Pepose, J. S., Stuart, P. M. Corneal cytokine expression in a murine model recurrent herpetic stromal keratitis. Ocular Immunol. Inflam. 9, 193-205 (2001).
- Keadle, T. L., Morris, J. L., Pepose, J. S., Stuart, P. M. CD4+ and CD8+ cells are key participants in the development of recurrent herpetic stromal keratitis in mice. Microbial Path. 32, 255-262 (2002).
- Keadle, T. L., Morrison, L. A., Morris, J. L., Pepose, J. S., Stuart, P. M. Therapeutic immunization with a virion host shutoff-defective, replication-incompetent herpes simplex virus type 1 strain limits recurrent herpetic ocular infection. J. Virol. 76, 3615-3625 (2002).
- Keadle, T. L., Laycock, K. A., Morris, J. L., Leib, D. A., Morrison, L. A., Pepose, J. S., Stuart, P. M. Therapeutic vaccination with vhs(-) herpes simplex virus reduces the severity of recurrent herpetic stromal keratitis in mice. J. Gen. Virol. 83, 2361-2365 (2002).
- Keadle, T. L., Morris, J. L., Stuart, P. M. The effects of aminoguanidine on primary and recurrent ocular herpes simplex virus infection. Nitric Oxide. 13, 247-253 (2005).
- Stuart, P. M., Morris, J. E., Sidhu, M., Keadle, T. L. CCL3 protects mice from corneal pathology during recurrent HSV-1 infection. Front. Biosci. 13, 4407-4415 (2008).
- Keadle, T. L., Alexander, D. E., Leib, D. A., Stuart, P. M. Interferon gamma is not required for recurrent herpetic stromal keratitis. Virology. 380, 46-51 (2008).
- Carr, D. J., Austin, B. A., Halford, W. P., Stuart, P. M. Delivery of Interferon-gamma by an adenovirus vector blocks herpes simplex virus Type 1 reactivation in vitro and in vivo independent of RNase L and double-stranded RNA-dependent protein kinase pathways. J. Neuroimmunol. 206, 39-43 (2009).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved