Method Article
細胞トラッキング染料を使用して細胞分裂監視のための最適化された染色と増殖モデリング方法
要約
免疫細胞機能や増殖を監視するための細胞追跡用染料の使用の成功は、いくつかの重要な手順が含まれます。我々は、するための方法を説明します:1)膜染料と明るく、均一で、再現可能なラベルり得るステップと、2)蛍光色素とデータ収集条件を選択すると、3)色素希釈に基づいて、細胞増殖を定量化するためのモデルを選択する。
要約
蛍光細胞追跡色素は、流れやイメージサイトメトリーとの組み合わせで、in vitroおよび in vivo で異なる種類の細胞の相互作用と運命を研究するためにどのと、強力なツールです。1月5日このような染料を使用してパブリケーションの数千のいくつかは、文字通りありますが最も一般的に遭遇する細胞追跡アプリケーションはの監視が含まれます:
- 幹細胞および前駆細胞休止、増殖および/ または分化6月8日
- 抗原ドリブン膜伝9および/ または前駆細胞の増殖と3,4,10-18
- 免疫調節およびエフェクター細胞機能1,18-21。
市販の細胞追跡色素は、それらの化学的性質と蛍光特性が大きく異なりますが、大多数の落下細胞標識のそれらのメカニズムに基づいて2クラスのいずれかに。 PKH26に代表される "膜色素"は、高親油性染料トンアール細胞膜1,2,11に安定しますが、非共有結合帽子パーティション。 CFSEに代表される"タンパク質色素"は、細胞のタンパク質4,16,18で安定な共有結合を形成するアミノ反応性染料である。各クラスには独自の利点と制限があります。彼らの成功を使用するための鍵は、特に複数の色素が異なる種類の細胞を追跡するために使用される多色の研究では、各クラス2-4,16,18,24の最適な利用を可能にする重要な問題を理解することである。
プロトコルは、細胞追跡色素を使用しているとき貧しいまたは変数の結果の3つの一般的な原因を強調ここに含まれています。これらは次のとおりである:
- 明るく、均一で再現性の標識を達成するために失敗しました 。これは、任意の細胞追跡研究のために必要な出発点であるが、タンパク質染料または抗体のような平衡結合試薬を用いた場合よりも膜の染料を使用して別の変数に注意を払う必要があります。
- 次善の蛍光色素の組み合わせND /または重要な報酬のコントロールが含まれて使用した場合。色素の蛍光を追跡することは、典型的には10 2 -抗体蛍光より10 3倍明るい。したがって、追跡用色素の存在が使用されている他のプローブを検出する能力が損なわれていないことを確認することが不可欠である。
- ピークモデリングソフトウェアとの良好なフィット感を得ることに失敗しました 。このようなソフトウェアは、前駆体の頻度や他のメトリックに基づいて、異なる集団または刺激を越え増殖応答の定量的な比較が可能になります。良いフィット感を得ること、しかし、色素希釈プロファイルを歪めると観測された色素希釈プロファイルの特性を持つモデルの基礎となる仮定のマッチングができる死んだ/死細胞の排除を必要とします。
ここに挙げた例は、細胞増殖をモニターするために、膜および/またはタンパク質の染料を使用している場合、これらの変数は結果に影響を与えることができる方法を示しています。
プロトコル
1。 PKH26細胞トラッキング色素で、一般的なメンブレンラベリング( 文献25;図1)
- 1.9 - 手順1.1の滅菌技術を使用してください。血小板汚染を最小限に抑えるための最終的な300×gでスピンを加えた実験室の標準法を用いて〜10 7ヒト末梢血単核細胞またはリンパ球(hPBMC、hPBL)を準備します。ステップ2で使用するための500μlのアリコートを(5×10 6細胞)を確保し、10氷上のHBSS +1%BSAおよび場所で7 / mlになるように細胞を再懸濁する。
- 12 x 75 mmの円錐形のポリプロピレン製チューブに入れ、5×10 6個の細胞(500μL)。 3.5mlのHBSSで1回洗浄します。慎重に残留流体のこれ以上より15から25μlを残しているが、細胞を除去しないように注意しながら、上清を吸引除去する。ステップ1.4で2倍の細胞懸濁液を調製するために、このチューブをご使用ください。
- ステップ1.2における細胞洗浄の間に、12 x 75 mmの円錐ポリプロピレンチューブに希釈Cラベリング車両0.5mlを(PKH26GLキットから)を追加します。予備校にこのチューブを使用ステップ1.5倍PKH26ソリューションです。
- ステップ1.2から洗浄細胞ペレットに希釈Cラベリング車両の0.5 mlを加え、単一の細胞懸濁液(2倍の細胞)を得るために3〜4回の吸引と分注する。細胞の生存と回復を減らすかもしれない、バブルの形成と過度の混合は避けてください。
- 直ちにステップ1.4で2倍の細胞懸濁液を調製した後、ステップ1.3で調製した希釈液、C管にエタノール中1.0mMのPKH26色素株式(PKH26GLキットから)2.0μlを添加して2倍(4μM)色素溶液を調製し、ボルテックスへ均一に分散させる。
- 直ちにステップ1.5で2倍の色素溶液を調製した後、急速に2倍の染料溶液にステップ1.4から2倍の細胞懸濁液をピペットと同時に完全に色素で細胞を分散させるために3-4回を吸引および分注しないでください 。に直接1.0mMの染料を追加細胞;倍色素に2倍の細胞を注ぐ、あるいはボルテックスしながら染料を2倍に2倍のセルを追加します。染色はほぼ瞬時に行われますので、そのような方法はあまり得推奨される方法より均一な強度( 図2)。
- 1分後、熱不活性化血清または細胞膜に色素の取り込みを停止するHBSS +5%BSAを1.0ミリリットルを追加します。十分なタンパク質を使用しなかった場合は、洗浄工程の中の細胞を持つことができペレット色素凝集体の形成をリスクと実験中に存在する他の細胞の意図しないラベリングを引き起こす。 10%熱不活化血清(CM)またはHBSSで培地+1%BSAが停止試薬として使用する場合は、すべての吸着を確実にするために15 mlコニカルポリプロピレンチューブに染色行うと停止試薬の少なくとも5.0ミリリットルを追加非法人の染料。
- 5分間標識した細胞を遠心@〜400 x gで。注意深く細胞を除去することなく、上清を吸引除去する。よく再遠心分離前にペレットを分散させると、CMまたはHBSS +1%BSAの4ミリリットルでペレットを2回洗浄。チューブ壁に吸着した色素のキャリーオーバーを最小限に抑え、洗浄効率を最大限に高めるためには、fiの後に新鮮なポリプロピレンチューブに細胞を移すRST再懸濁。注:十分に染色された細胞は、ペレット内の異なるピンクの色合いを示すであろう。
- 1.0ミリリットルHBSS +1%BSAで洗浄した細胞ペレットを再懸濁します。 、細胞をカウントする細胞の回復を決定し、10 7 / mlの最終濃度になるようにボリュームを調整します。慎重に吸引すると、細胞の回復が≥85%であるべきである。細胞の回復は<70%であれば、先へ進む前に、原因を特定します。ステップ2で使用するために氷の上で150μlのアリコート(1.5×10 6個の細胞)と場所を撤回します。
2。インストゥルメントおよびアッセイセットアップコントロールの調製( 表1)
- 5 1.8ミリリットルエッペンドルフチューブの各々にステップ1.1で保存した細胞懸濁液からの未染色細胞のアリコートを50μl(5×5):1、3、4、5、7。 3各チューブへのステップ1.9からPKH26 posの細胞のアリコートを50μl(5×5):2、6および8。
- チューブ1月8日に、10μlのIgGのブロック(試薬の表を参照のIgGの100μg/チューブ)を追加と周囲温度(20-25℃)で10分間インキュベートする。
- チューブ4、5、7、および8に、表1に示されており、周囲温度で30分間のすべてのサンプルを(チューブ1-8)インキュベートし、光から保護する抗体の飽和量(IES)を追加します。
- すべてのサンプルにHBSS +1%BSAを1.5ミリリットル、ペレットを遠心分離により細胞を(5分@ 400×g)で追加し、セル損失を避けるために慎重に吸引して、HBSS +1%BSAを1.5 mlで1回洗浄します。
- HBSS +1%BSAを500μlの各サンプルを再懸濁します。あなたのメーター上で分析されるサンプルで必要な場合は、12 x 75 mmの丸底チューブに移す。 表1に示すように管3、6、7、8から100μg/ mlの7-AADの日常作業用ストックを10μl(試薬の表を参照)を追加します。フローサイトメーターのセットアップおよび染色検証(ステップ3)での使用に先立って、氷上で30分間インキュベートします。
3。フローサイトメーターの設定および染色検証
- ていることを確認し、フローcytomeTERは毎日の品質管理のための研究室の確立された手順を使用して、正常に動作しています。容易に使用するために、各スペクトルウィンドウに検出され、検出器の応答は、増殖のモニタリング14に使用されるウィンドウで強度を通知するために直線的に比例することができるように信号を検証する。
- 線形表示スケールを使用してチューブ1にFSC対SSCデータを取得します。リンパ球集団がドットプロットの左下の象限内に収まるように各検出器の増幅はそのような調整、どちらのパラメータでオフスケールのものではなく、しきい値が原因で中断されません。 3.7 - 3.3ステップですべてのサンプルに対してゲートなしFSC対SSCデータを収集します。
- 全4蛍光検出器のための色補正と対数表示のスケールを使用していない、チューブ1のデータを取得する。最初のチャンネルに蓄積少数/無細胞と規模で染色されていないリンパ球の自家蛍光を配置するために、各検出器の高電圧(HV)を調整します。各ヒストグラムの解析境界を設定する非染色細胞の明るい2パーセントに相当する。
- ステップ3.2と3.3年に設立されない色の補償とHV設定を使用していない、FSC、SSC、すべて4蛍光検出器の信号を収集し、チューブ2のデータを取得する。 PKH26蛍光をモニターするために使用される検出器の場合は、すべてのPKH26 posの細胞は最後のチャンネルに/少数の細胞で、第3回-4 回目の十年のシングル対称ピークとしてスケールで表示されていることを確認します。複数のピークまたはピーク形状があるが偏っている場合には、最小化と混合技法( 図2)塩には細心の注意でステップ1を繰り返します。必要に応じて、色素濃度を調整します。
- ステップ3.3に設立された設定を使用して、FSC、SSC、すべて4蛍光検出器で信号を収集、チューブ3のデータを取得する。 7-AAD蛍光をモニターするために使用される検出器については、7-AADのposの細胞(非生存細胞が十分に解決され、 すなわち 、ステップ3.3に設立され、2%の境界線上に入ることを確認してください実行可能な7-AAD neg細胞から)。
- ステップ3.3に設立された設定を使用して、FSC、SSC、すべて4蛍光検出器で信号を収集、チューブ4のデータを取得する。 CD8 posの細胞が十分に染色されていない細胞( すなわち 、FITC標識検出器のためのステップ3.3に設立され、2%の境界上秋)から解決されていることを確認します。チューブ5を繰り返して、POSおよびCD8細胞はよく染色されていない細胞( すなわち 、APCの検出器のためのステップ3.3に設立され、2%の境界上秋)から解決されていることを確認します。
- ステップ3.3に設立された設定を使用して、すべての4蛍光検出器にFSC、SSC、および信号を収集、管6、7、8のデータを取得する。
- チューブ1-5と他の3つの蛍光色素を監視するために使用されている検出器の各蛍光色素のために行列を重複色を確立するためにあなたの色補正ソフトのために収集リストモードファイルを使用します。サンプル6用のリストモードファイルにこの行列を適用していることを確認しPKH26ラボの存在elingは7-AAD posの細胞を検出する能力を変更するものではありません。
- 3)うまく解決亜集団(CD3 NEG CD4 NEG、CD3 POS CD4 NEGおよびCD3 posの CD4 posが )、FITC対に識別することができます:ステップ3.8からサ ンプル7のためのリストモードファイルに行列をオーバーラップしていることを確認して色を適用APCのドットプロットと、b)抗CD3-FITCおよび抗CD4-APCの存在は7-AADのposの細胞を検出する能力を変更するものではありません。抗CD3-FITCの存在がPKH26検出器で収集されたデータの上位2%の境界を変更した場合、必要に応じて境界を再調整します。
- ステップ3.8からサンプル8のリストモードファイルに行列を重複色を適用します。 PKH26標識の存在は、ステップ3.3における自家蛍光コントロールを使用して、それらの集合から、FITC、7-AADまたはAPC検出器のための2%の境界を変更した場合、 表1のチューブ7を使用して、必要に応じて境界(IE)を再調整していることを確認し、それまだdistingすることが可能ですuish、CD3、CD4、POS posには、CD3、CD4 POS NEG、およびCD3 NEGの CD4 neg細胞は、調整された境界(IE)を使用します。
4。色素希釈により細胞分裂監視のための増殖モデルの選択
- あなたのメーターでチャンネルや対数十年の数に依存している世代間の間隔を決定する。デジタル機器の場合、この値は一般的に4〜5十年は、デジタル信号プロセッサのビンの数によって決定されます。アナログ楽器で、数十年はめったに整数ではない場合は、正確なモデリングは、実験的に決定される数十年の正確な数を必要とします。これを行うには、メーカーが割り当てた相対強度較正した蛍光ビーズの混合物からのデータは、実験で使用したのと同じ検出器電圧を高く設定で取得されています。ビーズのピークの位置は、intの面で、対数スケールのキャリブレーションが可能にログディケード当たりensity範囲。具体的には、これは、メーカーが割り当てた値の対数に対して各ビーズ型のチャネル番号をプロットすることにより行われます。ビーズデータ値の最適な直線の傾きは、チャネルあたりの相対強度単位の数を与えます。チャネル数を乗じ、この値はその後の強度の2倍の減少( すなわち 、娘世代間隔)に対応するチャンネルの数が14を計算することができ、そこからフルスケールのログ数十年、となります。
- 世代間の固定間隔を使用するか、または間隔をフローティングにして使用するかを決定します。 標準 (固定)設定では、各世代の場所を割り当てるには、手順4.5で決定し、世代間隔値を使用し、ヒストグラムが明瞭なピークを欠いているときに一般的に使用されます。 フロート設定は、各世代のピーク位置がヒストグラム形状によって決定することができ、いつdistinguishabl一般的に使用されている電子世代のピークは明らかである。
- すべての世代またはフローティング幅に固定されたピーク幅を使用するかを決定します。固定幅は、すべての世代をモデル化するためにSDが刺激されていない対照サンプルに対して計算使用し、サンプルを区別世代のピークを欠いているときに一般的に選択されます。フローティング幅はプログラムが独立してそれぞれの世代のためにSDを変化させることができ、最高の区別世代ピークで使用されます。
- 増殖解析モジュール(ここではModFit LTバージョン3.3)を含むプログラムを実行します。分析するデータセット( 例えば 、 表1にチューブ8の場合と対比PKH26 POS細胞の刺激96時間培養)から刺激PKH26 posのファイルをロードします。
- この場合、現実的にゲートPKH26(585/42)(7-AAD NEG)CD3 posのリンパ球と小さな破片と大きな凝集体( 図3)を除外するために、FSC対SSC中で、分析するためのパラメータを選択します。定義でこれらの領域は、爆発は、通常見られる高い前方散乱領域を含めるとCD3発現が刺激された培養物でダウン変調されてもよいことに注意するように注意してください。
- 増殖ウィザードを使用して、新しい増殖モデルを作成します。 [データファイルを開く ([スタート]タブ)を使用して、非刺激PKH26 posの制御ファイルをロードし、分割されていないセルに対応する親の分布のピークチャンネルの位置を定義します。
- 親ピークの位置と幅(標準偏差)の値に注意して、刺激されていないPKH26 POS制御用ファイルを分析します。一定のピーク幅(SD)が望まれる場合には、 ロックのSDをチェックします 。
- PKH26 ネガティブコントロール( 例えば 、PKH26 neg細胞の96時間培養表1のチューブ7の場合と対比)をロードします。 PKH26 ネガティブコントロール上最も暗い世代のピークチャンネルを設定することにより、世代の数を調整します。これは、NUを決定モデルが正確に合うことができるの娘世代のmberとは、通常、6月9日の世代である。
- 刺激を受けたサンプルのデータファイル( 例えば 、 表1のチューブ8の場合と対比PKH26 posの細胞の刺激96時間培養)を開き、手順4.7で定義されている親のピーク位置とSDの領域が変わらないことを確認します。一定の世代間隔が望まれる場合には、 標準モデルオプションを選択し、それ以外のフローティングオプションを選択します。
- ステップ4.9で定義された同じモデルを使用して、データセット内の各実験ファイルを分析します。視覚的にも減少カイ二乗(RCS)の値で定義されるような親のピーク位置の微調整は非常に最高のフィット感のために必要であるかもしれません。
- データセット内の各実験ファイルに対するベストフィットに起因する目的の増殖メトリックを記録。可能なメトリックの包括的な説明については参考文献を参照してください。 22。
結果
PKH26のような膜色素は細胞膜にはなく、化学反応(CFSE)または平衡結合(抗体)によってほぼ瞬時パーティショニングによって染色。 図1に概説重要な問題への関心の欠如は、 図2に示されたタイプの薄暗いまたは異種染色をもたらすかもしれません。対照的に、最適化された標識条件の使用( 図1、表2)色素希釈( 図3)に基づいて、細胞分裂の監視を含む、細胞追跡、様々なアプリケーションに適した明るい均質分布における結果。死んだ/死にかけている細胞が拡大および/ またはスキュー娘世代強度と色素希釈3,4,16,18に基づく拡散モデルを複雑にする可能性がある染料を追跡するための様々な量を失う。死んだ細胞のかなりの数が事前にすることができる条件下で色素希釈データを収集する場合に生存率色素の使用が推奨されるそのような刺激された培養物( 図3)またはそれ以前の試料( 図4)のように、送信されます。
トラッキング色素標識は、典型的には蛍光強度の免疫表現より数桁大きいを与えるので、それは適切な補償制御します( 表1)を含むようにし、トラッキング色素の存在が抗体陽性と陰性細胞( 図解決する能力を損なうことがないことを検証することが重要です4)過剰な色補正の必要性を回避するためには、明るい蛍光色素を配置することが望ましい、またはトラッキング色素に隣接するスペクトルチャネル(複数可)には、このような生きた細胞で除外染料として、目的の細胞には見られない1 ( 図4A&B 対 。4C&D)増殖の程度を定量化するためにピークモデリングソフトウェアを使用する場合は、良好なフィット感を得ることは色素希釈のprofの特性にモデル内でマッチング仮定を必要と( 図5、表3)分析される諸島。トラッキング染料および生存率の試薬の適切なオプションを選択すると、それは、同時に複数のリンパ球亜集団で増殖応答を特徴づけることも可能です。 図6に示すように、たとえば、第二のトラッキング色素の添加は、制御性T細胞(CellVueクラレットで標識)と非常に増殖し、エフェクターT細胞(CFSEで標識)との間に差別を簡素化し、得られるよりも、それらの相互作用についてのはるかに詳細を提供しています3 H-チミジン標識18,27を使用しています 。
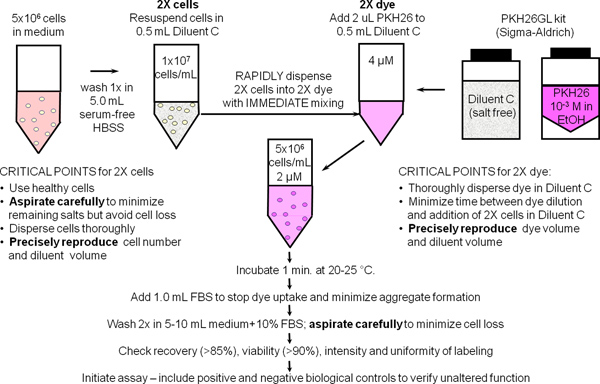
図1。 PKH26、PKH67とCellVue染料のための一般的なメンブレン標識プロトコールは 、細胞体肢にこれらの非常に親油性染料の分配NEは、染色は染料溶解性および染色効率を最大化するために設けられて無塩の希釈液Cの車両で実施される細胞と混合すると瞬時に本質的に発生します。 PKH26で一般膜標識のためにこの回路図にまとめられているように、明るく、均一で再現性のある染色は、したがって、最も簡単にすることによって得られる:1)を保証する混合技術を使用して)染色工程および2に存在するタンパク質および/またはその塩の量を最小限に抑える色素の細胞の急速な均質分散( すなわち 、同時に染料の同じ濃度になるようにすべてのセルを公開しています)。
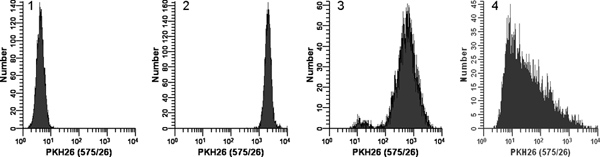
図2。 PKH26蛍光分布 (文献から転載。18) の条件を染色の効果が。対数的に成長し、培養したUのサンプルを複製染料を2倍に2倍の細胞の添加時に即時混合の有無にかかわらず、周囲温度で3分間- :937細胞はPKH26(15μMPKH26 1×10 7細胞/ ml、12最終濃度)で染色した。洗浄した後、染色された細胞は、一定の測定器の設定を使用して、ベックマン·コールター社シアンフローサイトメーターで解析したヒストグラム1:最初のチャネルに蓄積なし/少数の細胞を用いて最初の十年のスケール上のすべてのセルを配置するように調整PKH26検出器電圧で染色されていないコントロール。 ヒストグラム2:即時混合しながら染料を2倍の2倍の細胞の添加を使用して、15μMの染料で染色が少ない/最後のチャネルに蓄積ない細胞(gMFI =で、明るく、均一に染色された、第四十年間に置かれた細胞の対称的な人口をもたらし2548年、GCV = 26.2%) ヒストグラム3:染料を2倍の2倍細胞の添加を使用して、15μMの染料で染色が、即時の混合なし低減強度とより広範なCV(gMFI = 505の結果 、GCV = 116%)と同様に、管の壁ではなく、2倍の染料溶液に分注し、細胞の低下が原因の可能性薄暗くステンド亜集団、 ヒストグラム4:濃縮されたエタノール染料を3μlにつながっ染色エラー在庫はさらにこの1210μMの最終色素濃度をもたらしたが、非常に暗く、異種染色(gMFI = 32.9、GCVたを混合ではなく、希釈液Cで2倍の色素溶液を調製するのに使用されることなく、希釈液Cでセルを2倍速に直接追加さ= 1020%)。観察右スキュー最も可能性が高いの複合効果反映します:i)貧困層が広く、異種細胞と色素のボリュームに起因する混合する工程;染料調剤ポイントに最も近いセルが遠いものよりも染料のより高い濃度にさらされるであろうという事実を、及びii)離れて。 拡大図を表示するにはここをクリック 。
RE 3は "src =" / "FO:コンテンツの幅=" files/ftp_upload/4287/4287fig3.jpg 4.5in "のfo:SRC =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
図3。生存率プローブを使用することにより、T細胞増殖プロファイルのゲーティングを簡素 hPBMCがPKH26(最終細胞濃度:3×10 7 / mlに、最終色素濃度:10μM)で標識した。抗CD3およびIL-2の存在下で96時間(刺激)または非存在下(刺激されていない)の培養後、細胞を抗CD3-FITC、抗CD19-APCと7-AADで対比染色した、と分析した上でFACSCaliburフローサイトメーター(詳細については、リファレンス13を参照)。色補正はハードワイヤード補償回路を使用して、データ取得時に行った。 ModFit LT3.3で増殖ウィザードを使用して、ステップ4で説明したように増殖の程度をモデル化した。 PKH26 ネガティブコントロール( 表1、チューブ7)からのデータを参照(3列目のグレー埋めヒストグラム)のためにオーバーレイされます。刺激されていないための生存とSTImulated文化は76%、62%(パネル用ゲートなしデータとB、それぞれ)であった。培地中で96時間培養パネルA. PKH26染色された細胞は、生存(7-AAD NEG)CD3 POS細胞(R1)を含めるようにしてゲートをかけた。抗体包含と7-AADの死細胞の排除ゲート、前方散乱(FSC)の対側方散乱光(SSC)に加えて、ゲート(R2)は、破片や集計を除外するために使用されていました。このパネルの最後のプロットで死んだ細胞が存在しないことに注意してください。 PKH26増殖プロファイル(列3)のベストフィットモデルは、RCS = 2.1(ドナー6、 表3)を示す良好な対称性を持つ単一のピークを与え、親の位置を定義するために使用すると刺激の分析のためにピーク幅を開始しましたこのデータセット(パネルB)からのサンプル。 パネルB. PKH26染色された細胞の複製アリコートはフローティングピーク位置をもつモデルパネルAと同様にして96時間とgatedの抗CD3およびIL-2と培養したと浮動ピーク幅が与え RCS = 1.3(ドナー6、 表3)。パネルC. 7-AADのデータを使用せずに分析したパネルと同じデータファイルを使用してこのデータに最適。プライマリーFSC対SSCが部分的に死んだ細胞と骨材(R2)とCD3陽性イベント(R3)を選択するための二次的なゲートを除外するために使用されたとき、死んだ細胞の小さな残留人口は(ゲートイベントの0.2%)であった。ベストフィットモデル(ゲートイベントの1.29%)、刺激し、試料中の死細胞の大きな残留人口をメモパネルCと同じようにパネルのようにBがゲートだったRCS = 2.2。 パネルD.同じデータファイルを使用して単一のピークを与えたこのゲーティング戦略の。ベストフィットモデルはフローティングピーク位置と浮動ピーク幅(RCS = 1.3)を持つものだった。 拡大図を表示するには、ここをクリックしてください 。
ig4.jpg "のfo:コンテンツの幅=" 5インチ "のfo:SRC =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
図4。 PKH26で標識免疫表現型リンパ球への能力に蛍光色素の選択と色素濃度の影響。hPBMCは24時間古い血液から分離され、ステップ1で説明したように染色は12×75mmの丸底で行われたことを除いて、PKH26で標識したポリスチレンチューブではなく、12 x 75 mmの円錐形のポリプロピレンチューブ。直ちにPKH26で標識した後、細胞を、示さ免疫表現型と生存率の試薬 を用いて対比し、 図3Aのゲーティング戦略と次の光学構成を使用してLSRFortessaフローサイトメーター上で分析した:488nmのレーザー:FSC-Aを(488 nm)を、SSC - (10分の488 BP)は、FITC-A(30分の530 BP); PKH26-(26分の575 BP)、7-AAD-またはも、PerCP-A(40分の695 BP)。 640 nmのレーザー:APC-AまたはTOPRO -3 - (14分の670 BP)。色補正は、BD歌姫ソフトウェアを使用してデータ収集の時点で行った。 "オート"関連するスペクトル窓における無抗体コントロール(パネルAおよびB、パネルCおよびDのPerCPについては、APC)の自家蛍光を示しています。 PKH26 ネガティブコントロール( 表1、チューブ7)からのデータは、参照(グレー埋めヒストグラム、カラム5)のためにオーバーレイされます。後染色生存率は、すべてのサンプル(88から92パーセント)に類似していた。2μMの最終濃度でPKH26で標識されたパネルA.細胞は抗CD3-FITC、抗CD4-APCと,7-AAD(を使用して染色したチューブ表3の8)。実行可能な(7-AAD NEG)CD3 posのリンパ球(列1)及びFSCおよびSSCに基づいて、破片や骨材の排除に関するゲーティング( 図3Aを参照)した後、PKH26強度はAPC CD4(2列目と3列目)と組み合わせて評価した。補償されていない(コラム2)または(3列目)を補償するかどうか、この色素の組み合わせ)は、CD4 POS T細胞およびCD4 NEG T細胞との間の良好な解像度が得られ、両方として無によって検証ntibody、自家蛍光コントロール( 表1のチューブ6; 4列)とCD3 対の2色プロット。 CD4(コラム6)。 パネルB。パネルで同じ蛍光色素の組み合わせをとして使用しますが、4μMの最終PKH26濃度を増加させるに悪影響CD4 NEG T細胞からCD4 POS T細胞を解決する能力に影響を与えなかった。 パネルC.独立して最終濃度2μMでPKH26で標識された細胞の複製アリコートを抗CD3-FITC、抗CD4-PerCP、およびTOPRO-3を用いて対比染色した。実行可能な(TOPRO-3 NEG)CD3 posのリンパ球(列1)及びFSCおよびSSCに基づいて破片や骨材の排除に関するゲーティング( 図3Aを参照)した後、PKH26強度は抗CD4-PerCP(柱2との組み合わせで評価したと3)。 PerCPチャネルへPKH26の実質的なスペクトルの重なりは、補償されていないデータ(列2)、およびPKH26 posの CD4間の分解能で明らかである posとPKH26 posの CD4補償は(カラム4に示すように、無抗体、自家コントロールと3列目を比較して)適用された後NEGイベントが限界です。 パネルD. PKH26濃度は4μMまで増加させると、それが実行できなくなりますPerCPチャンネルはCD4(2列目)とCD4からの信号の強度を超えるにPOS PKH26 posが PKH26からパネルC.スペクトルの重なりの蛍光色素の組み合わせを使用するイベントは、CD4 NEG PKH26 POS T細胞(3列目から解決することはできなくなりました対 4列)。 拡大図を表示するにはここをクリック 。
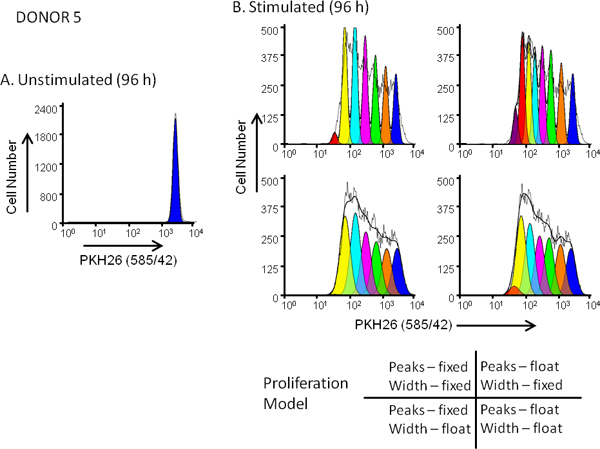
図5。上の増殖モデル選択の効果。色素希釈プロファイルの適合度hPBMCはPKH26(:;最終色素濃度3×10 7 / mlの:10μMの最終細胞濃度)で標識した。抗CD3およびIL-2の存在下(刺激)または非存在下(刺激されていない)で96時間培養後、細胞を抗CD3-FITC、抗CD19-APCと7-AADで対比したFACSCaliburで分析収穫したフローサイトメーター(詳細な方法のためのリファレンス13を参照)。色補正はハードワイヤード補償回路を使用して、データ取得時に行われた。 パネルが 。ドナー5、適度な応答のための刺激を受けていない96時間培養からPKH26強度プロファイルは、図3Aに示すように、ゲート付きだったとModFit増殖を提供するために使用。 パネルB分割されていない親細胞を表すピークの位置と幅の最初の見積もりとウィザード。パラレルからPKH26強度プロファイルは、96時間培養を刺激してから出発して推定値を用いて分析した図のように連続した娘の世代のためのパネルと4つの固定または浮動ピーク強度に対応した "増殖ウィザード"設定の組み合わせ、および固定または浮動ピーク幅を。 表3にまとめたように、観測データ(カイ二乗最小減少; RCS)にベストフィットを与えたモデルでは、ピークの位置だけではなくなる"浮動/フローティング"の組み合わせでしたが、また娘世代のピークの標準偏差は許されていた(RCS = 1.5)を変化させることができる。同じモデルは、ドナー6、高応答( 図3Bおよび表3)のための最高のフィット感を与えました。
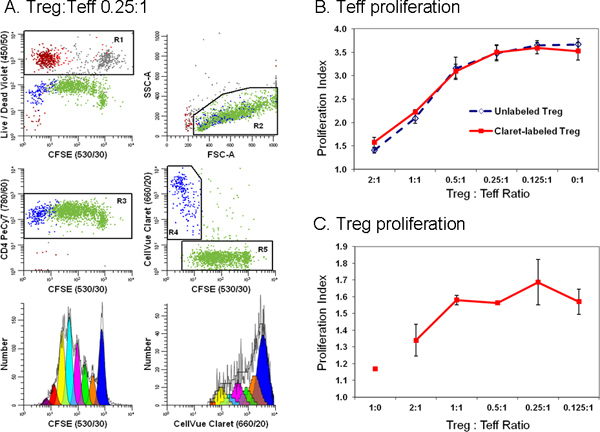
図6。第二のセルトラッキング色素の添加は、フローサイトメトリー抑制アッセイでエフェクターと制御性T細胞との間の差別を簡素化。TRIMA白血球搬出フィルターから調製した単球枯渇したリンパ球を抗CD127-PE、抗CD4-PE-Cy7で染色した(図18文献から適応)、および抗CD25-APCと流れはエフェクター(テフの集団に分類; CD4 POS CD127 明るい CD25 dim)は、規制(Tregは、CD4 + CD25 POS CD127 薄暗いPOS)、および付属品(CD4 NEG)細胞。 CFSE(最終細胞濃度5×10 7 / mlに、最後の染料濃度5μM)で標識し、ソートテフ:;:CellVueクラレット(1μM最終色素濃度1×10 6 / mlの最終細胞濃度)で標識されたソートTreg細胞であった抗CD3、抗CD28および照射アクセサリー細胞の存在下で様々な比率で共培養した。データacquisitio時に行われた96時間後、培養物を、収穫した抗CD4-PE-Cy7及びLIVE / DEAD修正可能なバイオレットで対比し、LSRIIフローサイトメーターと色補正で分析nは、BD DIVAソフトウェア(補償制御などの詳細は文献18を参照)を使用。ステップ4で説明したようにテフとTreg細胞用増殖指数はModFit LT3.3の増殖·ウィザードを使用して、モデル化した。パネルB及びCのデータポイントは、三連の試料の平均±1標準偏差を表すパネルA.描写データはTreg細胞における3三連の試料の1のために示されている。0.25:1のテフ比。他のすべてのデータのプロットから、LIVE / DEAD修正可能バイオレット試薬は死んだ細胞(=赤茶色、生き残れないテフ=グレーと生育不能なTreg =赤のアクセサリー細胞、R1、左上のプロット)を除外するために使用された。 CellVueクラレット染色は、実行可能なTreg細胞(R4、中央右のプロット;青)を区別するために使用されていたからではなく、非常に現実的なテフ(R5、中央右のプロット;緑色)を増殖した。テフ(左下のプロット)のパラメータが1つのCFSE増殖プロファイルはCFSE POS(R5)は、CD4 + POS(R3)は、実行可能な(ないR1)があった細胞にゲートによって生成され、リンパ球SCを持っていたatterプロパティ(R2)。 Tregのための単一のパラメータCellVueクラレット増殖プロファイルはCellVueクラレットPOS(R4)は、実行可能なCD4 + POS(R3)は、(ないR1)があった細胞のゲーティングによって生成され、リンパ球の散乱特性(R2)を有していた。リンパ芽球を含むように定義寛大なリンパ球領域(R2)を注意してください。収集される細胞の総数が対象となる最低周波数の人口に依存することにも注意してください。興味のある人口は7または8世代多数のセルまで表す強度の広い範囲にわたって分散させることができる細胞増殖実験で正確にモデリングし、各世代のセルの数を計算するために収集する必要があります。希少な細胞を研究するとき、それは単にイベントの最大数を可能な限り収集するために、ほぼ乾燥試料管を実行するために必要であるかもしれません。ここに示されているサンプルについては、これを行うと、11923はテフ(拡散私そのうち〜25,000イベントの合計をもたらしINDEX索引3.85)と1380は、Treg細胞(増殖指数1.83)であった。 パネルB.期待されるように、テフ細胞増殖の大きい抑制につながった共培養におけるTregsの存在の割合を増やす。同様の結果がCellVueクラレットトラッキング色素とその染色は効力をTreg細胞には影響しなかったことを示す、クラレット染色しCellVue( 実線 )または未染色( 破線 )Tregの両方で得られた。 パネルC. Treg細胞は、予想通り、でした比較的アネルギーあり、 Teff細胞の非存在下(:1:0のテフ比Treg細胞)における抗CD3、抗CD28、およびアクセサリー細胞とともにインキュベートしたときに増殖しない。しかし、共培養におけるテフ存在する割合( すなわち 、Treg細胞のように:テフ比は減少)増加し、Treg細胞増殖の程度も増加した。少なくとも部分的には、これらのデータのために一般的に大きなエラーバーは、不確実なテフに対して相対的と大きい収集されたイベントの小さい数字につながる、増殖の限られた範囲を反映各世代で細胞数のモデリングにtyは。 拡大図を表示するには、ここをクリックしてください 。
| チューブ号(目的) | PKH26 | 抗体(IES) | 7-AAD |
| 1(セットアップ、補償) | - | - | - |
| 2(セットアップ、補償) | + | - | - |
| 3(セットアップ、補償) | - | - | + |
| 4(補償) | - | CD8-FITC B | - |
| 5(補償) | - | CD8-APC B | - |
| 6(無Abの制御) | + | - | + |
| 7(無トラッキング色素詐欺TROL) | - | CD3-FITC CD4-APC または CD19-APC C | + |
| 8(T0制御) | + | CD3-FITC CD4-APC または CD19-APC C | + |
表1機器設定を制御します記載されているコントロールを使用して4色のCD4 T細胞の増殖をモニタリングアッセイに適しています。PKH26(増殖色素)、CD3-FITC(汎T細胞マーカー)、CD4-APC(T-ヘルパー細胞マーカー)、7 aminoactinomycin D(7-AAD、死細胞の排除)B CD3-FITCおよびCD4-APC(補償エラーを検出するためのより良い能力)の明るいサロゲートC 図3:CD3-FITCおよびCD19-APC。 D 図 4:CD3-FITCおよびCD4-APC。
| 細胞型 | 最終細胞濃度 | ファイナル色素濃度</強い> | リファレンス |
| hPBMC B | 1×10 7 / mlの | 2μMのPKH67 | 10,17 |
| 5×10 6個 / ml | 2μMのPKH26 | 12 | |
| 3×10 7 / mlの | 10μMのPKH26 | 13 | |
| 5×10 7 / mlの | 30μMのPKH26 | 18 | |
| 1×10 6個 / ml | 1μMのCellVueクラレットC | 18 | |
| 3×10 7 / mlの | 4μMのCellVueクラレット | 13 | |
| 5×10 7 / mlの | 5μMのCellVueクラレット | 18 | |
| 培養中の細胞 | 5×10 5 / mlの | 0.1μMのPKH26(1°乳腺細胞) | 8 |
| 1×10 7 / mlの | 15μMのPKH26(U937) | 18 | |
| 1×10 7 / mlの | 12.5 -15μMPKH26(U937) | 15 | |
| 1×10 7 / mlの | 1μMのPKH67(K562) | 18 | |
| 1×10 7 / mlの | 1μMのPKH67(T細胞株) | 9 | |
| 1×10 7 / mlの | 10μMのCellVueクラレット(YAC-1) | 23 |
表2非摂動膜-色素染色条件。適応とRefから更新。 18 B低速ウォッシュ(300 XG)は血小板汚染を最小限にするために使用されていました。C Treg細胞は、(フローソートされたCD4 POS CD25 CD127 POS NEGリンパ球)。
| モデル設定 | モデル結果 | ||||||||
| ドナー | 治療 | ピーク位置 | SD | 親の位置 | 親のSD | #ピークスの装着 | RCS | PI | PF |
| 5 | 刺激されない | フロート | フロート | 209 | 4.5 | 1 | 5.1 | 1.0 | 0 |
| 5 | 刺激を受けた | 固定した | 固定した | 209 | 4.5 | 7 | 35 | 3.9 | 31 |
| 5 | 刺激を受けた | フロート | 固定した | 209 | 4.5 | 8 | 19 | 4.3 | 30 |
| 5 | 刺激を受けた | 固定した | フロート | 209 | 9.2 | 6 | 1.9 | 3.8 | 30 |
| 5 | 刺激を受けた | フロート | フロート | 209 | 9.0 | 7 | 1.5 | 3.7 | 29 |
| 6 | 刺激されない | フロート | フロート | 205 | 4.0 | 1 | 2.1 | 1.0 | 0 |
| 6 | 刺激を受けた | 固定した | 固定した | 205 | 4.0 | 6 | 42 | 6.6 | 60 |
| 6 | 刺激を受けた | フロート | 固定した | 205 | 4.0 | 7 | 12 | 7.4 | 60 |
| 6 | 刺激を受けた | 固定した | フロート | 205 | 8.6 | 6 | 6.9 | 6.8 | 62 |
| 6 | 刺激を受けた | フロート | フロート | 205 | 6.5 | 6 | 1.3 | 6.5 | 59 |
表3。適合度(RCS)と増殖メトリック図3AおよびBで説明される。サンプル染色、データ収集およびゲーティングで拡散モデルの影響。
ディスカッション
ここで説明する方法は、それらの最も確実膜色素13,16,18と膜タンパク質または染料2,11,13,16のいずれかを使用して、リンパ球サブセットの表現型と増殖の追跡のために、使用してhPBMCラベリングのための最適な結果を与えるために、私たちの組み合わせの研究室で発見された18。 図1および図2に示すように、明るく均一な標識は最も容易に生理的塩の存在を制限し、混合技術を使用することによって達成される色素の同じ濃度にすべての細胞の急速な、均質な被ばくをもたらすこと。膜染料による染色は脂質二重層に分割することにより発生するため、無料の色素濃度を変更する他の変数は、標識効率に影響を与えることができます。たとえば、特に、管壁への吸着を染めるため減少し遊離染料濃度は前希釈液Cで再懸濁すると、塩の少ない効率的なウォッシュアウトで丸底ポリスチレンチューブ結果にラベリング低い染料濃度で。どちらの要素も円錐底ポリプロピレンチューブ( 図3、図4、使用するラベルが実行されるときよりも広い染色分布を与える傾向がある 未発表データ)。最適化された染色手順が使用されている場合でも、サンプルの年齢やタイプもピーク幅に影響を与えることができる。たとえば、24時間古い血液サンプルまたはTRIMAフェレーシスフィルタ範囲から単離したリンパ球のCVに対し14から20パーセントから新たに採取した血液の範囲( 図3、文献13および未発表の結果)から単離されたPKH26 posのリンパ球のCV 25から30から%( 図4およびRef 18)。
染色の均一性と非生存細胞を解析から除外し、両方の区別娘のピークが順番に観測されたデータ( 図5と図6に合わせて増殖モデルの選択に影響を与える色素希釈プロファイルで明白であるかどうかに影響を与えることができる程度)。 ModFit(Verityのソフトウェアハウス、料理Topsham、MEは)そのような増殖指数と前駆周波数( 図3、図5と図6、表3)のようなメトリックを生成するために使用されるソフトウェアの一例として、ここで使用されていますが、他のソフトウェアパッケージを使用すると、モジュールが分析する含まれてい増殖データ。これらを含めるFCSExpress(de novoのソフトウェア、ロサンゼルス、CA)およびFlowJo(ツリースター社は、オレゴン州アッシュランド)。これらのプログラムのすべては、反復的にシーケンシャル娘の世代を表すガウスピークの位置、高さ、およびSD(または幅)を変更することにより、生データへの最適解を非線形最小二乗分析を使用しています。増殖指数(PI)と前駆周波数(PF)は、増殖の程度の最も一般的に使用される指標です。 PIは、ModFitによって定義されるように、チミジン取り込みアッセイの '刺激指数'に類似アッセイの過程で細胞数の増加の尺度である。 PFは初期populat中の細胞の割合を返します増殖によって刺激に応答したイオン。用語は、ソフトウェアパッケージ( 例えば 、FlowJoとModFitが"増殖指数"が何を意味しているかで異なる定義や計算を使用)22の間で多少異なりますので、文献を読む場合は注意が、しかし、お勧めします。
蛋白質の染料を使用した場合の膜色素で標識及び増殖分析のためにここで説明する重要な問題も発生しています。例えば、混合技法に細心の注意を払うも、CFSE( 図6)2-4,13,18,24 を使用するときに均一な分布と区別娘のピークを得るために、死んだ/死細胞の排除とともに、遵守しなければなりません。表現型と生存率評価のための蛍光色素を適切に選択することは、特に、CFSE 2-4,11,13,16,18として可視発光タンパク質色素で、抗体陽性細胞を認識するために過度のスペクトルの重なりと不能を回避することも重要である。トラッキング色素の濃度を減少させると隣接スペクトルチャネルに補償の問題を減少させるだけでなく、娘細胞強度が自家蛍光と重なるように開始する前に監視することができる細胞分裂の数を制限します。あるいは、このような遠赤色発光CellVueクラレットなどの新しいセルトラッキング色素(Sigma-Aldrich社、セントルイス、MO)の使用または紫色発光CellTraceバイオレット(ライフテクノロジーズ、グランドアイランド、NY)は( 図6)補償の問題を減らすことができます。膜染料は一般的にあまり毒性11,26を示す傾向があるものの、最終的に、それは染料のいずれかのクラスを持つオーバーラベル細胞への可能性があります。それが使用されるトラッキング色素の濃度が追跡する細胞の機能( 図6)3,13,16,18 を変更していないことを確認するために常に必要がある。
開示事項
K·ハンフリー、JD Tario、ジュニアとPKウォレスはライフテクノロジーズ社とBD Biosciencesから評価用にあらかじめ市販の細胞追跡試薬を受けています。 ADはBantlyとJSムーア各種CellVue細胞追跡色素の準商用特性評価のためのPTIリサーチ社からライフテクノロジーズ社と資金からの評価のために事前に市販の細胞追跡試薬を受けています。 K·ミュアヘッドは(Phanosテクノロジーズ社にコンサルティングサービスを提供しています(PKHとCellVue染料の所有者)とシグマアルドリッチと分子標的·テクノロジーズ株式会社のバックアップテクニカルサポートを提供してSciGro社によって採用されているこれらの代理店染料)。
この記事への生産とフリーアクセスは、Sigma-Aldrich社が主催しています。
謝辞
ブルース·バグウェル(Verityのソフトウェアハウス)、NadègeBercovici(IDM)、Lizanneブレスリン(ZynaxisセルサイエンスおよびPTI研究):著者は、特に年間を通じてこれらの方法の開発への技術的·知的貢献のために以下の個人に感謝したいと思います、ブライアン·グレイ(PTIリサーチ)、ヤン·フィッシャー(ダートマス医科大学)、アリスGivan(ダートマス医科大学)、ベッツィオールソン·ヴィルヘルム(SciGro、Inc。)、およびメアリー·ウォー(ダートマス医科大学)。彼らはまた、 図2に示すようにデータを生成した年次調査方法のコースおよびフローサイトメトリーの応用、2006年からのボードンクラスに感謝したいと思います。
フローサイトメトリーは、NIHの共有インストゥルメント·プログラムから機器の助成金によって部分的に設立されたロズウェルパークがん研究所のフローサイトメトリー研究室で行われ、全国からコアグラント(5 P30-CA016056-29)からの支援を受けたがんロズウェルパークがん研究所へ、そしてアブラムソンがんセンターのフローサイトメトリーおよびNIH共有音源プログラムから機器の助成金によって部分的に設立されたペンシルベニア大学の細胞選別資源研究所の研究所、およびNIH#2P30から支援を受けて米国国立がん研究所からCA016520。 図3及び図5に示す作業もPTIリサーチ社に授与生体イメージングとバイオの国立研究所(NIBIB)からSBIRの助成EB00228によって部分的にサポートされていました
資料
飽和濃度
| Name | Company | Catalog Number | Comments |
| 試薬や機器 | 会社 | カタログ番号 | 注釈 |
| 市販品を購入する | |||
| 7-Aminoactinomycin D | シグマアルドリッチ | A9400 | |
| ウシ血清アルブミン(BSA) | シグマアルドリッチ | A4503 | |
| ウシ胎児血清(FBS) | アトランタバイオ | S11150 | |
| ハンクス平衡塩溶液(HBSS) | ライフテクノロジーズ | 14175-079 | フェノールレッドを含まないカルシウムとマグネシウムを含まない、 |
| ヒトIgGコーン画分IIおよびIIIグロブリン | シグマアルドリッチ | G-4386 | |
| マウス抗ヒトCD3-FITC | BD Biosciences社 | 349201 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD4-APC | BD Biosciences社 | 340672 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD4-PECy7 | BD Biosciences社 | 348799 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD8-FITC | BD Biosciences社 | 347313 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD8-APC | Caltag(Life Technologies)を | MHCD0805 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD19-APC | Caltag(Life Technologies)を | MHCD1905 | |
| マウス抗ヒトCD25-APC | BD Biosciences社 | 340938 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD127-PE | BD Biosciences社 | 557938 | 実験室での滴定により決定される飽和濃度 |
| マウス抗ヒトCD3 | eBiosciences | 16-0037-85 | 1.0 mg / mlで、アジ無料 |
| マウス抗ヒトCD28 | eBiosciences | 16-0289-85 | 1.0 mg / mlで、アジ無料 |
| PBS | ギブコ | 21300-058 | |
| EtOH中10-3M PKH26および希釈剤Cを含有PKH26赤色蛍光細胞リンカーキット | シグマアルドリッチ | PKH26GL-1KT または MINI26-1KT | ステップ1の手順も適用されますPKH67または他のCellVue染料を含有するキットへ |
| EtOHおよび希釈液Cで10-3M CellVueクラレットを含むCellVueクラレット遠赤色蛍光細胞リンカーキット | シグマアルドリッチ | MINCLARET-1KTまたはMIDCLARET-1KT | |
| 5 - (及び-6) - カルボキシフルオレセインジアセテートスクシンイミジルエステル(CFDA-SE) | Invitrogen社(Life Technologies)を | C34554 | 非蛍光性、形成する膜エステラーゼによって開裂蛍光アミノ反応性カルボキシスクシンイミジルエステル(CFSE) |
| LIVE / DEAD修正可能なバイオレット | Invitrogen社(Life Technologies)を | L34955 | |
| 円錐形の滅菌12×75ミリメートル ポリプロピレンチューブ&キャップ | VWR | 60818-102 | 良い膜染料染色効率を(;上清吸引中に小さいセル損失低減色素吸着)を与える |
| 12×75ミリメートルroundの底 ポリスチレンチューブ | ベクトン·ディッキンソン | 21008-936 | |
| フローサイトメーター | BD Bioscience社 | FACSキャリバー LSRFortessa | とAPC EX、FITC、PKH26、および7-AAD(全角それぞれ520 nmの567 nm、および655 nmであり、例:488 nm)を検出することができ、任意のメーター。 633から640 nmで、EM。 660 nm)を |
| フローサイトメーター | ベックマン·コールター | LSRIIシアン | とAPC EX、FITC、PKH26、および7-AAD(全角それぞれ520 nmの567 nm、および655 nmであり、例:488 nm)を検出することができ、任意のメーター。 633から640 nmで、EM。 660 nm)を |
| ラボラトリー準備 | |||
| 7-Aminoactinomycin D、 濃縮された株式 | NA | NA | PBS中1 mg / mlである。 -20℃でアリコートとストアでフリーズ |
| 7-Aminoactinomycin D、 WOR王株式 | NA | NA | PBS中での100μg/ mlの、1 mg / mlの凍結ストックから毎日用意しております。 |
| IgGをブロック | NA | NA | HBSS + 10 mg / mlのヒトIgGコーン画分IIおよびIIIグロブリン+ 10 mg / mlのBSA。 |
参考文献
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved