Method Article
RootChipを使用して、ルート環境の急激な操作によるシロイヌナズナの根の成長のタイムラプス蛍光イメージング
要約
この資料では、RootChipのシロイヌナズナ実生の栽培のためのプロトコル、細胞内の代謝産物レベルの微視的なルートのモニタリングおよびFRETベースの測定と成長条件の自動制御を組み合わせたマイクロイメージングプラットフォームを提供します。
要約
ルートプラントの物理的なアンカーとして機能し、そのような植物が土壌から取得する窒素、リン、硫酸塩および微量元素などの水やミネラルの栄養素の取り込みに関与する器官である。我々は、高収量を生産する持続可能なアプローチを開発する場合、我々がより良いルートが開発方法を理解する必要があり、栄養素の広い範囲を占めており、共生と病原生物と相互作用する。これらの目標を達成するために、我々は数分間から数日間までの期間にわたって微細な詳細にルーツを探索できるようにする必要があります。
ベースのマイクロ流体デバイス、イメージング1( 図1)の準備中に根に物理的なストレスを回避しながら、シロイヌナズナ実生から私たちが成長することができ、画像の根-私たちはRootChip、ポリジメチルシロキサン(PDMS)を開発しました。このデバイスは、流体の流れを誘導するマイクロメカニカルバルブを備えた分岐チャネル構造が含まれていますソリューションの入口から8観察室2の各々へ。この潅流システムは、ルートの微小環境を制御し、精度と速度を変更することができます。チャンバーの容積は、このように試験溶液の最小限の量を必要とする、約400 nlのです。
ここでは、実際の時間分解能でのイメージングベースのアプローチを使用してRootChip上のルート生物学を研究するための詳細なプロトコルを提供しています。根は時間経過顕微鏡を用いて数日間にわたって分析することができます。根は、培養液または阻害剤を灌流することができ、最大8つの苗を並行して分析することができます。このシステムは、化学物質、遺伝子発現の蛍光ベースの分析、バイオ分析の存在下または非存在下で根の成長の分析などのアプリケーションの広い範囲の可能性を秘めている、例えば、ナノセンサー3を FRETの。
プロトコル
注意:無菌条件下でのすべてのステップの準備の手順を実行します。
1。種子発芽用プラスチックコーンの調製
- 5ミリメートルの厚さに1%の寒天を含有する増殖培地で10cmペトリ皿を記入してください。我々は、ホーグランド媒体4を変更した半分の強度を使用していますが、培地組成は、個々の実験的な要件に合わせて選択する必要があります。
- 媒体がまだ液体であるが、シャーレから培地5μlの10μlのピペットチップを埋めるためにマルチチャンネルピペットを使用しています。
- 媒体が固体であるまで、直立固体増殖培地を含むペトリ皿に4ミリメートル長いプラスチックコーンと場所にカットし、ピペットチップボックス内の塗りつぶされたヒントを格納します。
2。種子の発芽および実生の成長
- 表面は、培地を充填した円錐のそれぞれの上に、単一のシードを配置し、滅菌水で3回洗浄し、5分間、5%次亜塩素酸ナトリウムで種子を消毒するだ。
- ℃で発芽を同期させるために4時に細孔テープ(3M)とストアと皿をシールします。
- 三日後、発芽を開始するために成長キャビネットにプレートを転送します。私たちの成長条件は16H高いlight/8h明暗サイクルで23°C(100μEm -2 s -1での光強度)である。
- 発芽後5〜7日の間、苗はRootChipへの転送のために準備する必要があります。この時点で、ルートヒントは、プラスチック製のコーンの底のコンセントの近くになければなりません。苗の状態、根の長さと、該当する場合は、解剖顕微鏡下で蛍光マーカーの発現を確認してください。
- チップ上に転送用の個々の苗をマークします。ケース1で10かそこらの苗を選択するには、転送中に破損しています。
3。 RootChip上に苗の転送
- 長期的な実験のためのRootChipを滅菌するために、ラップティッシュペーパー、ガラスのペトリ皿で行われ、オートクレーブ内のデバイス。
- RootChip、冷却した後、液体成長培地でそれをカバーしています。 RootChipは完全に浸漬する必要がありますが、液レベルがRootChip表面上以上3mm以下でなければなりません。
- 20μlのピペットを用いて、媒体との観測室を埋めるために、ルートの入口とチャンバー出口から培地を引き出します。
- RootChip口にステップ2.5で選択したプラグのプラスチックコーン。コーンは口にぴったり収まる必要があります。 RootChipは光学ガラスの薄い層にマウントされているので、チップにあまり圧力を適用されません。
- 液体培地で一晩RootChipインキュベートします。フローティング防止するために、チップ上に二つのガラススライドを配置します。磁気撹拌棒を追加し、皿を閉じます。
- マグネチックスターラーにアセンブリを移し、静かに培地を撹拌します。
- RootChipの口はfaciへの通常のデバイスに30°の角度で交差するチャンネルをチャネル( 図1A)に根の成長をlitate。さらに、所望の方向に成長をサポートするために、店のチップは反対側にペトリ皿の下にスライドガラスを配置することによって、若干のアセンブリを傾けます。
- タイマーに接続さ:明/暗サイクルを維持するために、リングランプ(100μEm -2 s -1での光強度)で苗木を照らす。
4。キャリアにRootChipを接続する
- 次の日、液体成長培地( 図1B)で密閉、加圧バイアルを記入してください。
- チップキャリアを反転させ、安定した面に置きます。液体培地からRootChipを削除し、チップキャリアの下部開口部にそれPDMS側を下に挿入します。オリエントチップができるように制御層入口を含んでいる側は、キャリア側の壁に圧力ラインのチューブのコネクタの側面に直面しています。
- 上にカバーガラスを乾燥させる優しくティッシュペーパーでブロッティングによるチップの底面。テープと右全体のアセンブリとキャリアにRootChipを固定します。
- チューブコネクタは5 cmの長さの部分に柔軟なプラスチック製マイクロボアチューブ(タイゴン、0.20 "ID X 0.060" OD)を切断し、ステンレス鋼マイクロボアチューブ(ニューイングランド小さな管、0.025 "外径x 0.013" ID×0.75 "にそれらを接続することによって作られてい長い)。チップ上の対応する制御層の入口に注射器とプラグインの各チューブコネクタを使用して、水でチューブコネクタを記入してください。水は後で制御層チャネルを記入し、マイクロメカニカルバルブへの圧力を送信するために使用することができます。
- メディア/溶液バイアル(S)に行の両端を差し込みます。空気のシリンジで溶液バイアルに圧力を適用します。溶液のバイアル内で増加した空気の圧力はラインに液体を強制します。
5。顕微鏡でRootChipをマウントする
- microscにキャリアを配置OPEステージ。客室内に振動による実験の経過とともにシフトアセンブリの可能性を減らすために、キャリアは、ステージインサートのノッチに正確に適合する必要があります。
- チップを介してチップバルブや媒体の流れは空気の圧力によって制御されます。規制当局との2行はメイン圧ラインから分岐されている - つはチャネルを介してメディアの流れを制御するために使用され、もう一方は制御層のプッシュアップバルブを作動させるソレノイド空気バルブに接続されています。ソレノイドバルブは、USBバルブコントローラ(ラファエル·ゴメス·シェーベルイ、ローレンス·バークレー国立研究所によって開発された)を介してコンピュータから運営されています。チップを接続する前に両方の圧力レギュレーターを閉じます。
- アセンブリ内の湿度を高く保つためにキャリアの貯水池への水の数mlを追加します。この手順は、乾燥から植物を維持するために長い実験の過程で繰り返されるべきである。 tを最小限に抑えるためにボリュームを低く保つ顕微鏡の上にこぼしたことができる液体の彼は額。長期的な実験のために、チップの電源プラグをコンセントから流出はマイクロボアチューブ(ステップ4.4を参照)貯水池にチップのコンセントを接続することにより、キャリアの貯水池に導くことができる。また、チップの表面に蓄積流出は、ピペッティングにより回収することができる。
- シートプロテクター(Cライン)から、透明なプラスチックの二乗シートを準備します。アセンブリ内の高湿度を維持するために両面テープでキャリアに透明なプラスチックを修正します。
- チップ上のリングの光を置き、明/暗サイクルを維持しています。リングの光が直接照明は、画像コレクションを妨害するように、蛍光マーカーを使用するすべての実験の開始前にオフにする必要があります。
6。 LabVIEWインタフェースを使用してRootChipを操作する
LabVIEWソフトウェア·プラットフォームのRootChipコントローラインタフェースことができます当社のウェブサイトからダウンロードすることがhttp://dpb.carnegiescience.edu/technology/rootchip 。
- チップ上のバルブは、ソレノイド空気弁を開くことによって、このケースでは、制御層に圧力を適用することによりクローズされます。コントローラ·インタフェースは、バルブ番号下のボタンをクリックして、バルブの作動を可能にします。明るい緑色は、チップバルブ( 図2B)の圧力と終了のアプリケーションを示しています。圧力レギュレータを開く前に、コントローラインターフェイスのすべての3つのソリューションの入口弁をアクティブにします。注:コントローラ·インタフェースは、システムのステータスの監視を可能にするフィードバックループを備えています。この機能は、コントローラ·インタフェースの "リードバック"ボタンをクリックしてアクティブにすることができます。
- 制御層の圧力レギュレータを開き、当初は15 psiに設定し、フロー層のためにレギュレータを開き、最初に5 PSIに設定されています。依鼎所望の流量で、圧力が後で調整されることがあります。
- 媒体とチャンバーをフラッシュするための選択肢の成長培地の入口バルブを開きます。
- 顕微鏡下での流路を確認してください。通常、空気は流路の中に閉じ込めて、削除する必要があります。さらに、制御層のチャネルは、まだチューブコネクタ(デッドエンド充填)からの水によって強制的に交換する必要があり空気を含んでいます。両方のタスクは、すべての空気がPDMSへのチャネル( "脱気")から強制されるまで、8室の各々数回(5 psi)をフラッシングすることによって達成される。注:コントローラーインターフェースは実験を自動化するためにプログラムすることができます。そのようなルーチンは、脱チップに使用することもできます。
7。代表的な結果
RootChipの主な目的は、高レベルの集積化を単一のデバイスのイメージングプラットフォームと灌流システムを組み合わせることです。操作を実証するために、根の微小環境の我々はダーク食品着色料(水耕培地中の1:4希釈)とチャンバーをフラッシュし、チャンバー内の流体の交換を測定した。 5 psiの推奨圧力で我々は、約1.5μL/分( 図3)の計算の流量で10秒以内に完全な交換を測定した。
また、この場合、暗闇の中で成長し、外部のエネルギー源( 図4)、10 mMグルコースに付属で、苗の根の成長を観察した。そのような媒体の光と組成物としての成長条件に応じて、植物は最大3日間までRootChipで観察することができます。
RootChipはフェルスター共鳴エネルギー移動(FRET)5-7に基づいて、遺伝的にエンコードされたナノセンサーを発現している根の細胞内グルコースとガラクトースレベルを監視するために使用されています。チップ内のルーツは、グルコースやガラクトース溶液の矩形パルスで灌流した( 図5)。糖の細胞内レベルが監視され、ここに示されているドナーECFPの強度に対するアクセプターフルオロフォアシトリンの強度の比として表されます。比率の上昇は、糖の蓄積を示しています。
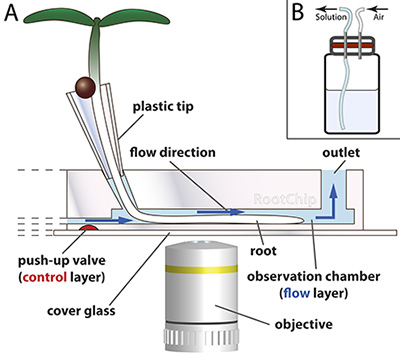
図1。 RootChip原理 。
- RootChipは根の成長とイメージングのための8つの観測室を備えています。種子は初のプラスチックコーンの発芽 - プラスチック製のピペットチップから作製 - 固形培地で充填されている。根の先端には、媒体を介して成長し、液体培地の連続的な流れはチャンバー一定の条件を保持室に達しています。マイクロメカニカルバルブ(赤)の流れを制御します。チップは、光のカバーガラスに搭載されている。
スケーリングしないように描画します。 (グロスマンら 、2011植物細胞からの許可を得て適応。) - SCHダイアフラム(赤)と加圧ソリューションバイアルのEME。
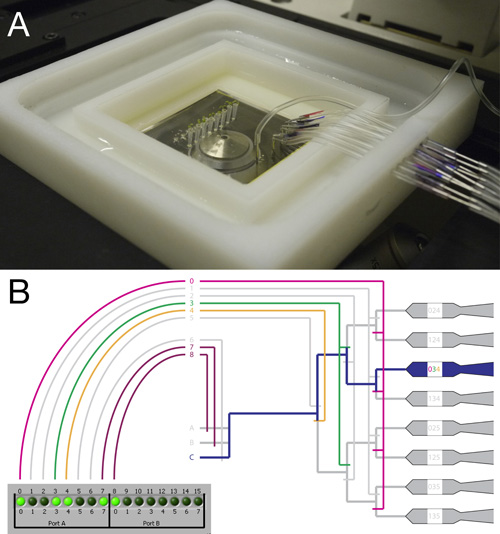
図2。 RootChipを接続して取り付け 。
- 完全に接続されたRootChipとキャリアのトップビューには、倒立顕微鏡に取り付けられた。
- スキームは、弁システムとコントローラ·インタフェースを示す。シングルチャンバーに流体の流れを導くために設定弁の例が示されている。バルブ4つのバルブとして8の行為を通じて、一方で、バルブグループの3行為を介して0になります。このシステムでは個々のチャンバーは、バルブの組み合わせを活性化することによって対処することができます。
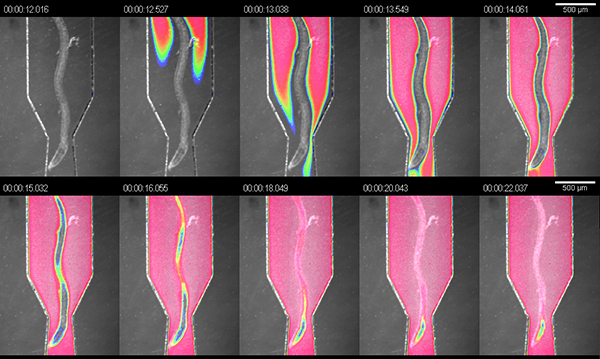
図3。観測チャンネルのソリューションの交換琥珀。染料溶液を用いて観察チャンバ内の流体の交換の可視化。画像は、明るいフィールドと色素信号の偽色の強度のオーバーレイです。
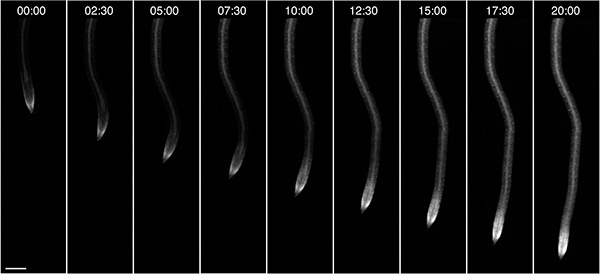
図4。オンチップの根の成長の蛍光を発現している単一の成長ルートの観察は、20Hのコース上にグ ルコース/ガラクトースためのナノセンサーFRETが。時間形式:HH:MM、スケールバー:100μmである。
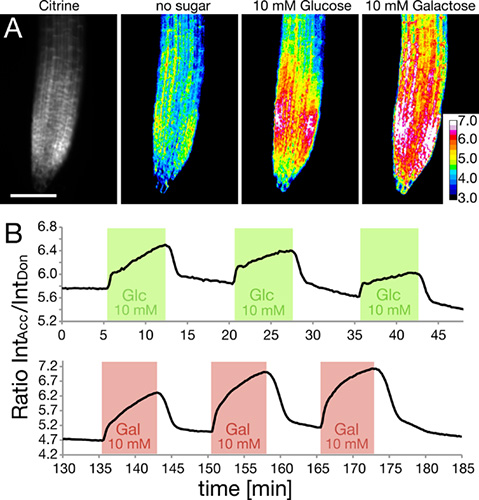
図5。用いた測定、細胞内の糖のレベルがナノセンサーをFRET。
- センサーの量は、根端内シトリン強度(左)と表示されます。細胞は、グルコースやガラクトースソリューションのアプリケーションへのナノセンサーFRETの応答は、レシオメトリック画像として表示されます。 (グロースマンらから許可を得て適応。、2011プラNT細胞)スケールバー:100μmである。
- トレースは、グルコース(緑色)とガラクトース(赤)の3繰り返し方形波パルスに対する応答として比の変化をFRETが。
ディスカッション
従来の成長方法に比べてRootChipの主な利点は、顕微鏡検査のために低侵襲の準備、可逆的に繰り返しルート環境を変更する機能、および数日間にわたって発達有能かつ生理学的に健康な組織の連続観測のための能力です。以前は、苗はゲルメディアに垂直に成長させただけで時間8時、単一の根を測定する実験を許可、直前の灌流システムに転送されます。マイクロ流体のツールは、シロイヌナズナのために、低集積度9または灌流制御10せずに使用されています。 RootChipは、正確なフローガイダンスを通して実験を自動化する機能との統合を高いレベルで兼ね備えています。このプラットフォームのもう一つの利点は、すべてのマイクロ流体デバイス11の特徴は、その液体の最小限の量が必要なナットでルートを入力する必要がありますです。でも、数日間にわたる実験のためのrients、。 RootChipは現在、シングルユースデバイスとして設計されたが、チップの製造コストが低いので、消費される試薬の少量はまだ非常に費用対効果の高いチップを作るされています。
苗の健康を保証するために注意する必要がありますいくつかの重要なステップがあります。
プラスチック製の円錐の体積は、空気にさらされると乾燥を開始します3〜4μlを、である。したがって、それはコーンがすぐにチップ上に転送され、根が十分な水でそれらを供給する観測室を、到達するまで湿度が高く維持されていることが重要です。ステップ4.2から4.5までは、苗木の乾燥を防ぐために迅速かつ中断せずに実行する必要があります。
ステップ3.5から3.8まで根が観察室に成長する間に、液体媒体中のチップのインキュベーションを記述します。この手順は、cにチップをマウントすることで、スキップされることがありますarrierはすぐに、成長培地で一定の灌流を開始します。それはいくつかの利点があるのでしかし、我々は、一晩増殖培地中に浸漬をお勧めします。苗は、彼らが観察室に成長するように乾燥になる可能性が低くなりますので、湿度の高い環境を作成する1)、2)チップが液体に浸しているので、脱気し(ステップ6.4)が速くなります。
低溶質濃度のメディアを使用することが重要です。より濃縮されたソリューションは、チップが数日間にわたって使用されている場合は特に、沈殿およびチャネルを詰まらせる可能性があります。
デバイスは、空気圧ラインに接続されると、媒体の流量は、バルブの油圧圧力を変えることにより制御されます。マイクロメカニカルバルブの適切なクロージャを保証するためには、流量、圧力の約3倍高くなって制御圧を選択することが重要です。流体が根口から押し出されるようにフローの圧力は15 psiを超えないようにしてください。より高い圧力ミリアンペアyは、チップが使用不能になり、チップの剥離が発生します。
RootChipの制限は、PDMSは、多孔質疎水性であるということです。材料は、水溶液に実質的に不活性であるが、それは有機化合物12を吸収することができます。これは、有機化合物はこの化合物の供給が入口で停止されていても、材料から漏れる可能性があるソリューションの迅速な交換を妨げる可能性があります。多孔性に起因する、有機溶剤を使用すると、PDMS 12の腫れの原因となります。
我々は、作物の根とRootChipを最適化し、例えば、その有用性を拡張し続けています。我々は治療法や観察のルートへのアクセスを改善することにより、RootChipのような流体のツールはルート研究の新たな次元を開くと信じています。
開示事項
利害の衝突が宣言されません。
謝辞
我々は、センサをFRETを発現する植物ラインを提供するためのビデオの準備とBhavnaチャウのヘルプはフィリップDenningerに感謝します。この作品は国立科学財団(MCB 1021677)からの補助金によって支えられて、SRQGGにWBF、国立衛生研究所、ハワードヒューズ医学研究所のエネルギー省(DE-FG02-04ER15542は)EMBO長いによってサポートされていました長期フェローシップ。 MMは、アレクサンダー·フォン·フンボルト財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| アイテム | ソース | 情報 | |
| チップキャリア、ソフトウェアおよびその他の情報を表示します。 | カーネギー研究所 - DPB | キャリアの製造、コントローラソフトウェアと詳細については、CADやCNCのファイルはWebサイトからダウンロードできますhttp://dpb.carnegiescience.edu/technology/rootchipのキャリアも、このウェブサイトから注文することができます。 | |
| RootChip | スタンフォードファウンドリー | マスクのデザインと製造プロトコルはリクエストを承ります。すぐに使用できるRootChipsはから注文することができhttp://www.stanford.edu/group/foundry/ | |
| チップコントローラ | 家庭を内蔵 | 自動バルブコントローラシステムは、もともとラファエル·ゴメス·シェーベルイ、ローレンス·バークレー国立研究所によって開発されました。どのようにあなた自身の作動バルブコントローラを構築するための詳細な命令を見つけることができますhttps://sites.google.com/a/lbl.gov/microfluidics-lab/valve-controllers |
参考文献
- Grossmann, G. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288, 113-116 (2000).
- Okumoto, S., Jones, A., Frommer, W. B. Quantitative Imaging with Fluorescent Biosensors: Advanced Tools for Spatiotemporal Analysis of Biodynamics in Cells. Annu. Rev. Plant Biol. , (2012).
- Loqué, D., Lalonde, S., Looger, L. L., von Wirén, N., Frommer, W. B. A cytosolic trans-activation domain essential for ammonium uptake. Nature. 446, 195-198 (2007).
- Okumoto, S. Imaging approach for monitoring cellular metabolites and ions using genetically encoded biosensors. Curr. Opin. Biotechnol. 21, 45-54 (2010).
- Fehr, M., Frommer, W. B., Lalonde, S. Visualization of maltose uptake in living yeast cells by fluorescent nanosensors. Proc. Natl. Acad. Sci. USA. 99, 9846-9851 (2002).
- Takanaga, H., Chaudhuri, B., Frommer, W. B. GLUT1 and GLUT9 as major contributors to glucose influx in HepG2 cells identified by a high sensitivity intramolecular FRET glucose sensor. Biochim. Biophys. Acta. 1778, 1091-1099 (2008).
- Chaudhuri, B., Hörmann, F., Frommer, W. B. Dynamic imaging of glucose flux impedance using FRET sensors in wild-type Arabidopsis plants. J. Exp. Bot. 62, 2411-2417 (2011).
- Meier, M., Lucchetta, E. M., Ismagilov, R. F. Chemical stimulation of the Arabidopsis thaliana root using multi-laminar flow on a microfluidic chip. Lab Chip. 10, 2147-2153 (2010).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98, 263703-26 (2011).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Lee, J. N., Park, C., Whitesides, G. M. Solvent Compatibility of Poly(dimethylsiloxane)-Based Microfluidic Devices. Anal. Chem. 75, 6544-6554 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved