Method Article
ネイティブ、繊維状の長い間隔と分節ロング間隔コラーゲンのin vitro合成
要約
シンプルかつ再現手順は一般的な市販のI型コラーゲンの単量体から3つの構造的に異なるコラーゲン組立部品を形成するために説明されます。ネイティブ型は、繊維状の長い間隔または分節長い間隔のコラーゲンは、300nm長いと1.4 nmの直径の単量体のビルディングブロックがさらされる条件を変えることにより構築することができる。
要約
コラーゲン線維は、構造の足場と機械的強度を提供するために、動物組織の細胞外マトリックスに存在しています。これらの天然コラーゲン線維は〜67 nmの特性バンディング周期性を持っており、長さ、直径1.4 nmの300 nmであるI型コラーゲンモノマーの階層的なアセンブリを介して生体内で形成されており、in vitroでは 、どちらに条件を変化させることによって、単量体のビルディングブロックが露出して、50ミクロンの長さスケールにまで及ぶユニークな構造は、ネイティブ型線維だけでなく、繊維の長い間隔と分節長い間隔コラーゲンだけでなく、を含めて、構成することができる。ここで、我々は共通の市販のコラーゲンの単量体から3つの異なるコラーゲン構造を形成するための手順を紹介します。我々と他の人がこれらの3つのタイプは、通常の構造の混合物につながるように、過去に発行したプロトコルを使用して。特に、unbandedフィブリルは一般的にFだった天然コラーゲンを作るときoundここ、繊維状の長い間隔のコラーゲンを作るときに、ネイティブフィブリルはしばしば存在していた。これらの新しい手順は、ほぼ独占的に希望するコラーゲン線維の種類を生産できるという利点があります。所望の構造の形成は、原子間力顕微鏡を用いたイメージングによって検証されます。
概要
コラーゲンは3本のポリペプチド鎖から形成された三重らせん構造を持っている構造タンパク質のクラスです。これらの三重らせんモノマーは、さらに徐々に大きく構造を形成する階層的な方法で組み立てる。 1が同定されている少なくとも28遺伝的に異なるコラーゲンの種類があります。組み合わせることで、コラーゲンはすべてコラーゲンタンパク質2の90%までのI優勢な形態の会計を入力して、動物に見られる全タンパク質の30%を占めています。 I型コラーゲンは、皮膚、靭帯、腱や骨にfibrillous構造として発見された。原子間力顕微鏡(AFM)と電子顕微鏡(EM)私天然コラーゲン繊維は通常約67 nmの3-5(多くの場合、D-バンドとも呼ばれる)の固有周期とバンディング見せるタイプのイメージ。
Iコラーゲンモノマーを入力すると、2つの同一のα1(I)鎖と比べてそれぞれ複数のα2(I)鎖から成る三重らせんヘテロです長い千個のアミノ酸である。それは、長さが300nm、直径1.4 nmの寸法を持つ細長いです。 Iコラーゲンモノマーを入力すると、自然に形成された高次構造6を破壊することによって容易に得ることができる。我々 7や他の多くの8-10は、これらの水溶性モノマーのビルディングブロックは、その後試験管 ( 図1) で 、D-バンドフィブリルを再構築するために使用されることが示されている。
天然コラーゲン線維のほかに、他の2つの高次コラーゲン構造が同一の単量体のビルディングブロックを用いてin vitro で形成することが見出されている。二つの構造は、繊維の長い間隔(FLS)と分節長い間隔(SLS)コラーゲン( 図1)です。 FLSのコラーゲンは天然コラーゲンのようなfibrillous構造ですが、天然コラーゲン11よりも大きいバンディング周期性によって特徴づけられる。コラーゲンモノマーは、α1-酸性糖タンパク質と組み合わされたときin vitroでは 、FLSのコラーゲン形成 12。 FLSコラーゲンはめったに13が、同様にin vivoで観察されている。モノマーは結晶格子14のようにレジスタに並んでいるので、SLSのコラーゲンが結晶として記載されている。コラーゲンモノマーは、アデノシン三リン酸(ATP)は15と組み合わせたときのSLSコラーゲンを形成します。天然由来のSLSのコラーゲンは線維芽細胞の培養液中で観察されなく抽出された組織サンプル中の、おそらくその小さなサイズと区別可能な地形の特徴16の不足のためにされています。
本稿の目的は、最も経験の浅い研究者が再現できるだけでなく、FLSおよびSLSコラーゲンと天然コラーゲン線維を作るための詳細な手順を提示することである。市販の高度な原料を使用して、我々はできるだけ単純なプロトコルを作ってみました、まだ彼らは確実に動作しています。我々の異なるコラーゲン構造を特徴づけるためにAFMを使用する方法についても詳細作られていますの。この作品は、これらの高次コラーゲン構造の1以上を研究、および/または他のアプリケーションでの前駆体として、それらを使用していますが、現在は専門知識の不足、または単に組織サンプルでは動作しないようにしたい研究者に有益なものとなろう。
プロトコル
注:すべてのプロトコルで使用される水は比抵抗> 18を有するMΩ.cm.
1。天然コラーゲン線維
- 水6μlの、200mMの20μlの2 HClおよびマイクロチューブとミックスにおけるKCl 400mMの10μlを用いてpHを7に調整しHPO 4·Naを兼ね備えています。
- マイクロチューブとのミックスにコラーゲンモノマー(0.01 N HClにて〜3 mg / ml)を4μlを添加する。解決策は、無色透明であるべきである。
- ℃で、3〜4時間放置37に予め温めた熱ブロック内の反応混合物を含むマイクロチューブを置きます。この時点で、解決策は、わずかに濁って、主に天然コラーゲン線維を含んでいる必要があります。
2。繊維状の長い間隔コラーゲン
- コラーゲンモノマーの1ミリリットル(0.01 N HClにて〜3 mg / ml)を、室温で24時間かけて水を4回変更すると、水400mlに対して12から14 kDaのMWCO膜を使用して透析する。透析しcollagすぐに使用されていないエンモノマーは4℃で、将来の使用のために保存することができます。
- 水20μl、水の3 mg / mlのα1-酸性糖タンパク質とマイクロチューブで透析コラーゲンモノマーの20μl20μlのを兼ね備えています。解決策は、無色透明であるべきである。
- 30分間室温で反応混合物を含むマイクロチューブを残す。この時点で、溶液は濁っなり、主にFLSコラーゲン線維を含むべきである。
3。分節ロング間隔コラーゲン
- 水の67μlの液、pH 3.3の100mMグリシン-HCl緩衝液60μlと微量遠心チューブとミックスの水に10 mg / mlのATPの40μlを兼ね備えています。
- マイクロチューブとのミックスにコラーゲンモノマー(0.01 N HClにて〜3 mg / ml)を33μlを添加する。解決策は、無色透明であるべきである。
- 2時間室温で反応混合物を含むマイクロチューブを残す。この時点で、解決策はまだ明確に見えますが、するべきでしょうほとんどSLSコラーゲンが含まれています。
4。 AFMのキャラクタリゼーション
- 薙ぎ払い粘着テープの切れ端で雲母の表面を覆うことにより、それを剥がすAFMの基板に取り付けられた雲母片の表面。マイカの全体の層が表面に凹凸を減らし、マイカが再利用されている場合、古いサンプルが削除されていることを確実にするために、切断されたことを確認し、その後テープを確認してください。
- 新たに切断されたマイカ基板にコラーゲン線維の溶液20μlを適用します。 5分間のままにしておきます。
- 優しく水でコラーゲン線維の溶液を洗い流してください。それは、マイカ基板の中央になくエッジで水を直接適用することは、それがサンプル全体に流れるようにしないことをお勧めします。
- 窒素ガス気流下で表面を乾かします。それは、マイカ基板の中央にエッジとしないでストリームを向けることをお勧めします。
- 200倍の倍率で光学顕微鏡下では、ネイティブとFLSコラーゲンサンプルは線維の塊を示すべきである。 SLSのコラーゲンは表示されません。
- 三つの異なるコラーゲン構造のユニークな特性は、AFMによって観察されています。窒化ケイ素AFMプローブを用いた接触モードのAFMと我々は通常、画像FLSおよびSLSのコラーゲン線維のに対し、シリコンAFMプローブを用いた間欠的な接触モードのAFMと一般的に、我々は、画像天然コラーゲン線維を、。我々は時間とコストの考慮のために、これを行う。シリコンAFMプローブは通常、イメージング天然コラーゲン線維の狭いバンド構造に特に有用に窒化シリコンAFMプローブ、よりシャープである。しかし、シリコンAFMプローブは、窒化シリコンAFMプローブよりコラーゲン試料による汚染をはるかになりやすいですし、頻繁に交換する必要があります。したがって、我々は主に解像度が大きい必要性であるイメージング天然コラーゲン線維のためのシリコンAFMプローブの使用を予約し、私たちはprolに間欠接触モードで動作有用性のオングは一生。
我々は、少なくともいくつかのコラーゲンの構成要素を示すべきである最初の100×100μm2のスキャンをお勧めします。そこから、10サイズ×10μm2とし、2×2のネイティブとFLSのコラーゲンのバンディング周期性を観察するためμm2であり 、またはSLSコラーゲンの細かい特徴をスキャンするにはズームイン。また、初期スキャンが代表的なものであることを確認するためにコラーゲンのサンプルには、少なくとも2つの他の領域を確認することをお勧めします。
結果
天然コラーゲン
100mMリンで〜0.3 mg / mlのコラーゲン単量体と37のままにしてpH7の100mMのKClの反応混合℃で3〜4時間クリア〜67 nmのは、D-バンドとネイティブ型コラーゲン線維を含む溶液が得られる、 unbanded線維なし。
200倍の倍率で光学顕微鏡の下で、いくつかの線維の塊は、通常、微分干渉コントラスト(DIC)顕微鏡( 図2)で閲覧する場合は特にマイカ基板上で見ることができます。典型的なサンプルでは、AFMによるランダム100×100μmの2スキャンは通常、長い5-50ミクロン( 図3a-c)は、少なくともいくつかの線維が表示されます。個々の、分離したコラーゲン線維が簡単にこの段階で特定することができます。 512×512画素2画像スキャンすると、10×10μm2でスキャンサイズにズームすると、すべてのフィブリルが団結していることを示している( 図3D-F )。正確にバンディング周期性を測定するためには、2×2μm2のスキャンサイズ( 図3G-i)に拡大することが最善です。
周期性をバンディングは単にいくつかのピークや谷の間の長手方向の距離を測定し、平均化することによって決定することができる。 AFMのソフトウェアが許可されている場合あるいは、1次元フーリエ変換は、長手方向の断面に沿って変換を使用することもできます。 図4はフィブリルとそれに対応する縦断面のAFM高さ画像を示しています。
FLSコラーゲン
1 mg / mlのμ1-酸性糖タンパク質、30分間室温で放置し、水に約1 mg / mlのコラーゲンモノマーの反応混合物は、FLSコラーゲン線維の解を得ることができます。
天然コラーゲンの場合に観察されるものに類似したフィブリルの凝集塊は、簡単に200×mでの光学顕微鏡下でマイカ基板上で見ることができagnification。典型的なサンプルでは、AFMによるランダム100×100μmの2スキャンは、通常、少なくともいくつかの線維が表示されます。 512×512ピクセルの2つの画像のスキャンサイズで、バンディング周期性を示し、10×、より正確には10μm2スキャン( 図5a)または2×2μm2のスキャン( 図5b)。図5cにズームすることによって測定することができるFLSフィブリルの長手方向断面図。
SLSのコラーゲン
2 mg / mlのATPの反応混合物、2時間室温で放置のpH 3.3の100mMグリシン-HCl緩衝液中のコラーゲンモノマーの〜0.5 mg / mlのはSLSのコラーゲン溶液を得ることができます。
典型的には、SLSの結晶は、光学顕微鏡下では表示されません。 AFMは、SLSの結晶の存在を確認するために必要です。典型的なサンプルでは、AFMによるランダム100×100μmの2スキャンは、通常、多くが表示されますドット。 10×10μm2でのスキャンに拡大すると、通常、いくつかのSLS結晶( 図6a)が表示されます。 2×2μm2のスキャン( 図6b)は SLSの結晶の微細構造を示しています。
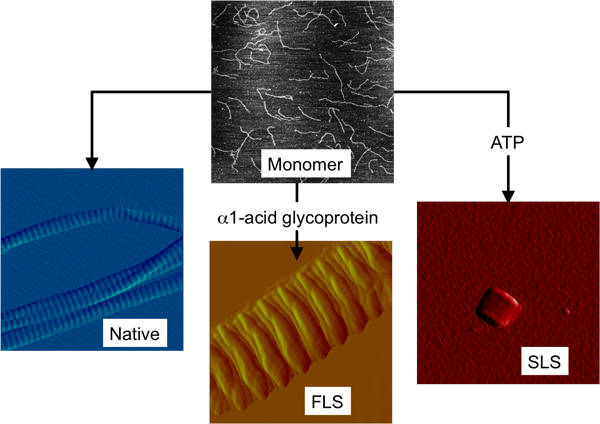
図1コラーゲンモノマーから in vitro で形成することができるコラーゲン線維の3つの構造的に異なる形。 AFM画像はすべて同じ大きさのスケール(2×2μm2)を上にコラーゲン単量体と3高次コラーゲン構造を描いた。
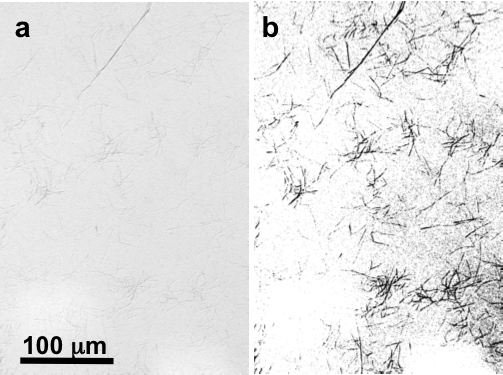
図2デジタルマイカ上に天然コラーゲン線維の光学DIC顕微鏡による〜200×倍率()手つかずの画像と(b)閾値に、尖ったトンフィブリルを強調O。

マイカ上の天然コラーゲン線維の図3 AFM像。断続的な接触モードAFM振幅画像が表示されます。

図4(a)は0.5×1μmの2間欠接触モードAFM高さ画像(縦軸は= 100 nm)と天然コラーゲン線維の(b)は縦断面図。

図5マイカ上にFLSコラーゲン線維のAFM像。 (a)は10×10μm2と接触モードAFM偏向画像、(b)は、2×2μm2と接触モードAFM偏向イメージと(c)の縦FLSのコラーゲン線維の断面。

図6マイカ上のSLSコラーゲンのAFM像。断続的な接触モードAFM振幅画像が表示されます。
ディスカッション
コラーゲン単量体を精製し、低pHおよび温度で安定しており、天然コラーゲン線維の形成は、基本的にコラーゲンモノマー溶液のpHと温度を上昇させることを含む。モノマーから縞状コラーゲン線維の再構成の手順については、50年以上存在していた。私たちの研究室では、7〜15年前にコラーゲンと私たちの最初の研究で使用されている手順は、1986年10にチャップマンとその共同研究者によってまとめられた手順に基づいていた。 34でその以前の仕事のコラーゲン線維形成のための条件のNa 2 HPO 4 / KH 2 PO 4(I = 0.2、pH7.4)中コラーゲンモノマーの0.18 mg / mlであったバッファ℃、我々が試みていることをこのおよびその他の手順の欠点は、所望のバンドと一緒にフィブリル形成unbandedフィブリルが常にあるということです。私たちの新しい条件は〜100mMリン酸のコラーゲンモノマーの0.3 mg / mlおよび37で放置し、pH7での100mMのKClで3〜4時間インキュベートする。 procedureは天然コラーゲン線維を作るために、以前の手順から、あらゆる面で異なって、本明細書に記載。しかし、最も著しく、我々は、緩衝液の濃度を高め、100mMのKClを加えることによってイオン強度を倍増しました。もっぱら団結コラーゲン線維のより一貫した形成にイオン強度結果の増加。
コラーゲンモノマー溶液は使用の製造元の推奨期限を過ぎていたときに私たちの経験では、この手順では、ネイティブ型コラーゲンを生産していないことだけで時間があった。これが発生すると、何がすべてまだ観察多くのフィブリルにunbandedしかし主unbandedアール少ないフィブリルから範囲を観察される。期限切れのコラーゲンモノマーはしばしばまだ正常に天然コラーゲンを作るために使用することができますが、それが失敗したときに、新しいコラーゲンモノマーは間違いなく購入することがあることに注意してください。
FLSは最初Highberger らによって同定された。Orekhovicに入金コラーゲン製剤中の17はH ら18。さらなる研究がHighbergerとシュミットは、それが、FLS 12の形成を促進するα1-酸性糖タンパク質であったと結論づけている。我々は、後で市販のコラーゲンモノマーおよび低pHでα1-酸性糖タンパク質を合成して、ゆっくりとpHは24時間11水に対して混合物を透析することによって上昇させることによって、FLSのコラーゲンを作るための手順を再現することができました。我々は今、最初の水に対するコラーゲンモノマーを透析し、単にFLSコラーゲンを形成するために水でα1-酸性糖タンパク質と組み合わせることで、その手順の変更を提示します。ここで説明するFLSコラーゲンアセンブリのための条件ははるかに少ない時間がかかります。コラーゲンモノマーは、まだ水に対して透析したプリである必要があるが、それは一括で行われ、その後℃で安定して、それが使用されるまで4℃で保存することができます。この新しい手順利回りは主に縞状のコラーゲン線維をFLS。
我々の経験から、α1-酸性糖低い結合タンパク質と水分含量、および推論によって、より高い糖度を持つタンパク質が、正常にFLS線維を作るために重要です。我々は通常、我々が使用するα1-酸性糖タンパク質がたくさん組み合わさ%のタンパク質および水82以下のコンテンツを持っていることを製造元に確認してください。と天然コラーゲン合成のための手順と同様に、古すぎるコラーゲンモノマーはまたFLSコラーゲンを生成するために失敗することがあります。また、透析のために使用される水の純度がこの手順で重要である。さえ〜8MΩ.cmはなく、FLSコラーゲンを形成しませんコラーゲン溶液中で> 18MΩ.cm水結果に対するコラーゲンモノマーの例については、透析。
3コラーゲン線維の種類、作成する最も簡単なのSLSのコラーゲンである。 SLSの早い準備がシュミットと同僚15によって記述されていた。我々は市販のコルを使用してSLSのコラーゲンを作るために12年前にその手続きの適応を発表アジャン14。手順は単純に2 mg / mlのATPおよび0.05%コラーゲンモノマーの0.5 mg / mlの(v / v)のpHは3.5で酢酸を組み合わせる伴、室温で一晩混合物を残す。
我々の経験では、制御しなければならない、SLSアセンブリの重要な側面は、反応溶液のpHである。 SLSは、微結晶の凝集した塊になって、より基本的な条件(pH約3.6から3.9)の結果に集まった。より酸性条件(pH約2.9から3.2)はpH 3.3から3.5の理想的な条件の下で組み立てるものより薄く、より分離した微結晶が得られる。この範囲外の反応pHは(<2.8> 4)任意のSLSコラーゲンを生むとは限らない。我々は過去に、酢酸を加えて反応混合物のpHを調整した。さらに手続きを簡素化するために、この原稿に、我々はpHを制御するためにグリシン-HCl緩衝液を導入しました。
文字を持っている上記のプロトコルから形成された三つの異なるコラーゲン構造唯一のナノメートルの分解能が可能な楽器で見分けることができるISTIC機能。ネイティブおよびFLSコラーゲンは〜67 nmと〜270nmの周期性をバンディングによって特徴付けられる。 SLSのコラーゲンの最長寸法はちょうど〜360 nmである。我々は、我々は、3つの異なるコラーゲン構造を特徴づけるためにAFMを使用する方法を具体的に説明しています。しかし、<10nmの半径を有する任意のAFMプローブと接触または間欠的な接触モードで任意のAFMの動作はまた、画像これらのコラーゲン構造をできるようにすべきです。また、電子顕微鏡では、することができ、19これらのコラーゲン構造を特徴付けるために使用されています。
これらの手続きの主な利点は、それらが所望のコラーゲン構築主に生成することである。これらの反応に見られるコラーゲンの唯一の他の形態は、多くの場合、AFM像の背景に表示されている原料モノマーである。ネイティブとFLSのコラーゲンの場合、それらは容易にunreaのほとんどから分離することができるその結果、ネイティブまたは水とFLSコラーゲンペレットの繰り返し遠心分離と洗浄によりCTEDモノマー。
我々は、先進的、商業的に入手可能な出発物質を使用して、ネイティブは、FLSおよびSLSのコラーゲンを作るための、シンプルで信頼性の高い手順を提示している。これらのすべての手順で使用されるコラーゲンモノマーは、精製された形で市販されている。 α1-酸性糖タンパク質とATPは、商業的にも利用できる両方である。
開示事項
特別な利害関係は宣言されません。
謝辞
我々は、我々の研究室ではコラーゲン線維の研究に時間と労力を貢献したすべての過去に多くの学部生、大学院生やポスドクの学生に感謝したいと思います。自然科学とカナダの工学研究評議会は、継続的に当社のコラーゲン研究のための資金を提供してきました。
資料
| Name | Company | Catalog Number | Comments |
| 材質/試薬 | 会社 | カタログ番号 | コメント(オプション) |
| Iコラーゲンモノマーを入力 (0.01 N HClにて〜3 mg / ml)を | Inamed アドバンストニッピ | 5409 5005-B | ロット1261443(2.9 mg / mlと、pHは2.1) ロット1629346(3.2 mg / mlと、pHは2.1) ロット6006(3.2 mg / mlで、pHは2.1) |
| ATP | 国際研究生化学 | -141 | ロットFBJ-1194A |
| ウシ血漿から、α1-酸性糖タンパク質 | シグマアルドリッチ | G3643 | ロット051K7440(89.8%) ロット011K7410(82%) ロット065K7405(71.2%) ロット063K7495(71.9%) ロット117K7535(75.9%) (タンパク質+水分含量) |
| A1-酸glycoprヒト血漿からotein | シグマアルドリッチ | G9885 | ロット128H7606(70.9%) ロット049K7565V(68%) (タンパク質+水分含量) |
| マイカ | テッドペラ | 53 | |
| Pointprobe - シリコンSPM-センサー | ナノワールド | NHC | 我々は断続接触モードで使用するシリコンAFMプローブ |
| Veeco社のナノプローブのヒント | Veeco社 (現在はブルカーAFMプローブ) | NP-S | 我々は接触モードで使用する窒化ケイ素AFMプローブ |
参考文献
- Kadler, K. E., Baldock, C., Bella, J., Boot-Handford, R. P. Collagen at a glance. J. Cell Sci. 120, 1955-1958 (2007).
- Abraham, L. C., Zuena, E., Perez-Ramirez, B., Kaplan, D. L. Guide to Collagen Characterization for Bio Studies. J. Biomed. Mat. Res. 87B, 264-285 (2008).
- Baselt, D. R., Revel, J. -. P., Baldeschwieler, J. D. Subfibrillar Structure of Type I Collagen Observed by Atomic Force Microscopy. Biophys. J. 65, 2644-2655 (1993).
- Petruska, J. A., Hodge, A. J. A Subunit Model for Tropocollagen Macromolecule. Proc. Natl. Acad. Sci. U.S.A. 51, 871-876 (1964).
- Smith, J. W. Molecular Pattern in Native Collagen. Nature. 219, 157-158 (1968).
- Gross, J., Highberger, J. H., Schmitt, F. O. Extract of collagen from connective tissue by neutral salt solutions. PNAS. 41, 1-7 (1955).
- Gale, M., Pollanen, M. S., Markiewicz, P., Goh, M. C. Sequential assembly of collagen revealed by atomic force microscopy. Biophys. J. 68, 2124-2128 (1995).
- Wood, G. C., Keech, M. K. The formation of fibrils from collagen solutions. Biochem. J. 75, 588-597 (1960).
- Williams, B. R., Gelman, R. A., Poppke, D. C., Piez, K. A. Collagen Fibril formation. J. Biol. Chem. 253, 6578-6585 (1978).
- Holmes, D. F., Capaldi, M. J., Chapman, J. A. Reconstitution of collagen fibrils in vitro; the assembly process depends on the initiating procedure. Int. J. Biol. Macromol. 8, 161-166 (1986).
- Paige, M. F., Rainey, J. K., Goh, M. C. Fibrous long spacing collagen ultrastructure elucidated by atomic force microscopy. Biophysical Journal. 74, 3211-3216 (1998).
- Highberger, J. H., Gross, J., Schmitt, F. O. The interaction of mucoprotein with soluble collagen; an electron microscope study. PNAS. 37, 286-291 (1951).
- Ghadially, F. N. . Ultrastructural pathology of the cell and matrix. , (1988).
- Paige, M. F., Goh, M. C. Ultrastructure and assembly of segmental long spacing collagen studied by atomic force microscopy. Micron. 74, 355-361 (2001).
- Schmitt, F. O., Gross, J., Highberger, J. H. A new particle type in certain connective tissue extracts. PNAS. 39, 459-470 (1953).
- Bruns, R. R., Hulmes, D. J. S., Therrien, S. F., Gross, J. Procollagen segment-long-spacing crystallites: their role in collagen fibrillogenesis. PNAS. 76, 313-317 (1979).
- Highberger, J. H., Gross, J., Schmitt, F. O. Electron microscope observations of certain fibrous structures obtained from connective tissue extracts. JACS. 72, 3321-3322 (1950).
- Orekhovich, V. N., Tustanovsky, A. A., Orekhovich, K. D., Plotnikova, N. E. O prokollagene kohzi. Biokhimiya. 13, 55-60 (1948).
- Lin, A. C., Goh, M. C. Investigating the ultrastructure of fibrous long spacing collagen by parallel atomic force and transmission electron microscopy. Proteins. 49, 378-384 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved