このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ゲノムDNAから5 - ヒドロキシの選択的捕獲
要約
説明は簡単で、密度に依存しない濃縮のためのビオチンリンカーを転送するために、クリックケミストリー、続いて5-HMCにアジド-グルコースを転送するために、β-グルコシルトランスフェラーゼ(β-GT)を用いた二段階ラベリングプロセスである。この効率的で特異的標識法は、次世代シーケンシングを介して非常に低いバックグラウンドと高いスループットepigenomicマッピングで5-HMCの濃縮を可能にします。
要約
5 - メチルシトシン(5-MC)は、ヒトのゲノムDNAの総シトシン〜2から8パーセントを構成しており、遺伝子発現、ゲノムの完全性の維持、親の刷り込み、X染色体不活性化の調節を含む生物学的機能の広い範囲に影響を与え発達、老化、癌1。最近では、酸化された5-MC、5 -ヒドロキシメチル(5 - HMC)の存在は、胚性幹(ES)細胞および神経細胞2-4の、特に哺乳動物細胞内で発見されました。 5-HMCは、TETファミリー鉄(II)/α-ケトグルタル酸依存オキシゲナーゼ2、3、5-MC触媒作用の酸化によって生成されます。 5-HMCは胚性幹(MES)細胞、正常な造血及び悪性腫瘍、および受精卵開発2、5月10日の維持に関与することが提案されている。良い5-HMCの機能を理解するために、信頼性が高く、簡単なシーケンシングシステムが不可欠です。従来のバイサルファイトシークエンシングは5-MC 11から5-HMCを区別することはできません12グルコース部分を追加したバクテリオファージ酵素を利用して、ラベルと5-HMCをキャプチャするための非常に効率的かつ選択的な化学的なアプローチを開発しました。
ここでは5-HMCの選択的化学標識するための簡単な2ステップの手順を説明します。第一の標識のステップでは、ゲノムDNA中の5 - HMCは、5 - HMCに6 - アジド-グルコースを転送する方法では、β-GTは、バクテリオファージT4からグルコシルトランスフェラーゼによる6 - アジド-グルコースで触媒で標識されている修正された補因子は、UDP-6-N3-GLC(6 N3UDPG)。第二段階、ビオチン化では、ジスルフィドビオチンリンカーをクリックケミストリーによりアジド基に装着されている。両方の手順は、ゲノム領域における5-HMCの豊富さに関わらず、ラベリングと非常に低いバックグラウンドを与えて完成につながる、非常に特異的かつ効率的である。 5-HMCのビオチン化に続いて、5-HMCを含むDNA断片を選択的に捕獲される密度に依存しない方法でストレプトアビジンビーズを使用。得られた5-HMC-濃縮したDNA断片を、次世代シーケンシングを含む下流の分析、を使用することができる。
私たちの選択的標識とキャプチャプロトコルは、変数/多様な5-HMCの存在量を用いたゲノムDNAの任意のソースに適用し、高感度を与える。このプロトコルの主な目的は、その下流のアプリケーション( すなわち 。、次世代シーケンシングは、ゲノム中の5-HMC分布をマップアウトする)ですが、それは単一分子であり、リアルタイムSMRT(DNA)の配列決定、と互換性があります5-HMCの単一塩基解像度のシーケンシングを提供することができる。
プロトコル
1。ゲノムDNAの断片化
ゲノムワイドなシーケンシングプラットフォームに適した所望のサイズ範囲に超音波処理を用いてゲノムDNA断片。 (私達は通常〜300 bpまで超音波処理。)を1%アガロースゲル( 図1)上の断片化したゲノムDNAのサイズ分布を確認します。
2。 DNAの調製
ゲノムDNA中の5-HMCの豊富に基づく出発DNAの量を決定します。 5-HMCのレベルが異なる組織型においても大きく変動するので、出発DNA量は、試料の5-HMCのレベルによって異なります。例については、 表1を参照してください。
3。 β-GTの触媒反応(グルコース転移反応)
- 1時間37℃の水浴中で表2の詳細かつインキュベートした混合物をピペッティング。
- インキュベーション後、当たり10μgのDNAを用いて、QIAクイックヌクレオチド除去キットを使用した反応をクリーンアップコラム。列あたり30μlの水で溶出し、組み合わせる。
4。ビオチン化反応(化学は、ここをクリックします)
- 150μMの( すなわち 、30μlのDNA溶液当たりの作業溶液5μl)の最終濃度に溶出したDNA溶液中のDBCO-SS-PEG3 -ビオチンコンジュゲートワーキング溶液(1mM)を(ステップ3から)を追加します。
- 2時間37℃の水浴中でピペッティングとインキュベートしてミックス。
- QIAクイックヌクレオチド除去キットとの反応をクリーンアップします。理想的な総溶出量は100μlです。
- マイクロスケール分光光度計( 例えば 。、光度計)を用いて回収したDNA量を定量化する。
5。 5-HMC-含むDNAの捕捉
- 製造元の指示に従って、1XのB&W緩衝液1mlでのDynabeadsストレプトMyOne C1の50μlを3回洗浄する。マグネチックスタンドでビーズを分離。
- 回収されたビオチン化Dに2X B&Wの等量のバッファーを追加洗浄したビーズに、NA(100 UL)。
- ローテーターで穏やかに回転しながら室温で15分間インキュベートする。
- マグネチックスタンドでビーズを分離し、1X B&W緩衝液1mlでビーズを3回洗浄する。
- ローテーターで穏やかに回転しながら室温で2時間、新たに調製し、50mMのDTTを100μlのビーズをインキュベートすることによってDNAを溶出する。
- マグネチックスタンドでビーズを分離。 DTTを除去するために、製造指示に従ってマイクロバイオスピンカラムに溶離液6と負荷を吸引します。標的DNAは現在のソリューションである。
- のEB緩衝液10μl中にキアゲンMinElute PCR精製キット、溶出DNAによる前工程から溶出したDNAを精製する。濃度が20 ngの/ ULより高ければ量子ビット蛍光光度、または光度計を用いてDNAを定量化する。 DNAは下流のゲノムワイドなシーケンシングライブラリの準備のための準備ができています。
6。代表的な結果
品質O IFfのゲノムDNAが高く、β-GTとビオチン化反応後の典型的な回収率は約60から70パーセントである。しかし、捕獲効率は試料の5-HMCのレベルに応じてさまざまな種類の組織と大きく異なります。一般的に、脳のゲノムDNAの捕捉効率は約4から9パーセントであり、いくつかの極端な場合には、効率が12%にまで達する可能性があります。 ES細胞については、平均捕集効率は、神経幹細胞のための〜0.5%とは対照的に、〜2-4%である。これまで見て最も低い効率は、がん細胞からのゲノムDNAのためだった。すべての濃縮されたDNAは、標準の次世代ライブラリ調製のプロトコルのための準備ができています。関連のプライマーが使用可能な場合だけでなく、捕獲されたDNAはまた、インプットDNAと比較して、いくつかの断片の濃縮を検出するリアルタイムPCR用テンプレートとして使用することができます。
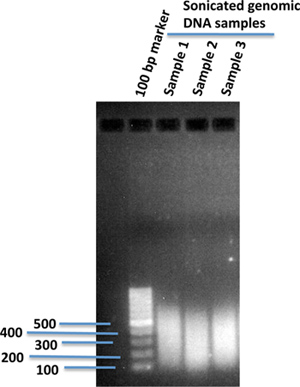
図1。中で超音波処理したヒトゲノムDNA断片1%アガロースゲル。1X TE緩衝液120μlのヒトiPS細胞から単離したゲノムDNA10μgを超音波処理装置(Covaris)を使用して超音波処理した。超音波処理後、超音波処理したDNAの2μlを超音波処理したDNA断片の大きさを比較するためのDNAマーカーの100 bpを使用して1%アガロースゲルにロードした。
| コンポーネント | ボリューム | 最終濃度 |
| 水 | _μL | |
| 10 Xのβ-GTの反応バッファー | 2μlの | 1つのX |
| 最大10μgのゲノムDNAへ | _μL | 最大500 ng /μlに |
| UDP-6-N 3 - GLC(3mM)を | 0.67μlの | 100μMの |
| β-GT(40μM) | 1μlの | 2μM |
| 全体積 | 20μlの |
組織のゲノムDNA(高5-HMCコンテンツ> 0.1%)のi)
| コンポーネント | ボリューム | 最終濃度 |
| 水 | _μL | |
| 10 Xのβ-GTの反応バッファー | 10μlの | 1つのX |
| 最大20μgのゲノムDNAへ | _μL | 最大500 ng /μlに |
| UDP-6-N3-GLC(3mM)を | μlの1.33 | 100μMの |
| β-GT(40μM) | 2μlの | 2μM |
| 全体積 | 40μlの |
ⅱ)幹細胞のゲノムDNA(中央値5-HMCコンテンツ〜0.05%)の場合
| コンポーネント | ボリューム | 最終濃度 |
| 水 | _μL | |
| 10 Xのβ-GTの反応バッファー | 10μlの | 1つのX |
| 最大50μgのゲノムDNAへ | _μL | 最大500 ng /μlに |
| UDP-6-N3-GLC(3mM)を | 3.33μlの | 100μMの |
| β-GT(40μM) | 5μlの | 2μM |
| 全体積 | 100μlの |
iii)癌細胞のゲノムDNA(低5-HMCコンテンツ〜0.01%)の場合
表1:インプットDNA選択的化学標識法による種々の5-HMCレベルで試料を用いてラベリング反応の量の例。
| サンプル | 5-HMCレベル | 出発DNA(μg)を | 標識後リカバリ(ビーズへの入力)(μg)を | 回収率 | プルダウンDNA(NG) | プルダウン得 |
| 成体マウス小脳 | 0.4パーセント | 10 | 7.5 | 75パーセント | 236 | 3.1パーセント |
| 生後7日目のマウスの小脳 | 0.1パーセント | 11 | 9 | 82パーセント | 140 | 1.6パーセント |
| マウスES細胞はE14 | 0.05パーセント | 60 | 42 | 70パーセント | 350 | 0.8パーセント |
表2。マウス脳組織およびES細胞からの代表的な結果。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
5 - ヒドロキシメチル(5 - HMC)は、特定の哺乳類の細胞型における実質的な量で最近同定されたエピジェネティックな修飾の存在しています。ここで紹介する方法は、5 - HMCのゲノムワイドな分布を決定するためのものです。我々は5-HMCのヒドロキシル基にアジド基を含有する人工グルコース部分を転送するために、β-グルコシルT4バクテリオファージを使用しています。アジド基を化学的...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
この研究は、米国国立衛生研究所(CHとNS051630/MH076090/MH078972にPJにGM071440)によって部分的にサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 名前 | 会社 | カタログ# | コメント |
| 試薬 | |||
| 5M塩化ナトリウム(NaCl) | プロメガ | V4221 | |
| 0.5M pH8.0エチレンジアミン四酢酸(EDTA) | プロメガ | V4231 | |
| 1Mトリズマベース(トリス)pH7.5 | インビトロジェン | 15567-027) | |
| HEPES 1M、pH7.4の | インビトロジェン | 15630 | |
| 1M塩化マグネシウム(MgCl 2) | アンビオン | AM9530G | |
| ジメチルスルホキシド(DMSO) | シグマ | D8418 | |
| ツイーン20 | フィッシャーBioReagents | BP337-100 | |
| DBCO-SS-PEG3 - ビオチンコンジュゲート | 化学ツール]をクリックし | A112P3 | |
| 1,4 - ジチオスレイトール、超純(DTT)の超純粋な | インビトロジェン | 15508-013 | |
| QIAクイックヌクレオチド除去キット | キアゲン | 28304 | |
| マイクロバイオスピンカラム6 | バイオ·ラッド | 732-6222 | |
| ダイナMyOne | インビトロジェン | 650から01 | |
| ストレプトアビジンC1 | |||
| キアゲンMinElute PCR精製キット | キアゲン | 28004 | |
| 超高純度アガロース | インビトロジェン | 16500500 | |
| UDP-6-N 3-グルコース | アクティブモティ | 55013 | |
| 酵素 | |||
| (β-GT)は、β-グルコ | ニューイングランドBiolab | M0357 | |
| 機器 | |||
| 超音波処理装置 | Covaris | ||
| デスクトップの遠心分離機 | |||
| 水浴 | フィッシャー·サイエンティフィック | ||
| ゲルランニング装置 | バイオ·ラッド | ||
| NanoDrop1000 | サーモサイエンティフィック | ||
| Labquakeチューブシェーカー | Barnstead | ||
| Labquakeチューブシェーカー | Thermolyne | ||
| 磁気分離スタンド | プロメガ | Z5342 | |
| 量子ビット2.0蛍光計 | インビトロジェン | ||
| 試薬のセットアップ 10 Xのβ-GTの反応緩衝液(500mMのHEPES pHは7.9、250 mMのMgCl 2)2 X結合および洗浄(B&W)緩衝液(10mMトリス(pH7.5)、1mMのEDTA、2MのNaCl、0.02%Tween 20)で。 |
参考文献
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. , Suppl 33. 245-254 (2003).
- Ito, S. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification. Nature. 466, 1129-1133 (2010).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Kriaucionis, S., Heintz, N. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Science. 324, 929-930 (2009).
- Ko, M. Impaired hydroxylation of 5-methylcytosine in myeloid cancers with mutant TET2. Nature. 468, 839-843 (2010).
- Koh, K. P. Tet1 and tet2 regulate 5-hydroxymethylcytosine production and cell lineage specification in mouse embryonic stem cells. Cell Stem Cell. 8, 200-213 (2011).
- Iqbal, K., Jin, S. G., Pfeifer, G. P., Szabo, P. E. Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine. Proceedings of the National Academy of Sciences of the United States of America. 108, 3642-3647 (2011).
- Wossidlo, M. 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming. Nat. Commun. 2, 241(2011).
- Gu, T. P. The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes. Nature. 477, 606-610 (2011).
- Dawlaty, M. M. Tet1 is dispensable for maintaining pluripotency and its loss is compatible with embryonic and postnatal development. Cell Stem Cell. 9, 166-175 (2011).
- Huang, Y. The behaviour of 5-hydroxymethylcytosine in bisulfite sequencing. PLoS One. 5, e8888(2010).
- Song, C. X. Selective chemical labeling reveals the genome-wide distribution of 5-hydroxymethylcytosine. Nat. Biotechnol. 29, 68-72 (2011).
- Pastor, W. A. Genome-wide mapping of 5-hydroxymethylcytosine in embryonic stem cells. Nature. 473, 394-397 (2011).
- Matarese, F., Pau, C. arrillo-deS. anta, E,, Stunnenberg, H. G. 5-Hydroxymethylcytosine: a new kid on the epigenetic block. Mol. Syst. Biol. 7, 562(2011).
- Szwagierczak, A., Bultmann, S., Schmidt, C. S., Spada, F., Leonhardt, H. Sensitive enzymatic quantification of 5-hydroxymethylcytosine in genomic DNA. Nucleic Acids Res. 38, 181(2010).
- Terragni, J., Bitinaite, J., Zheng, Y., Pradhan, S. Biochemical characterization of recombinant β-glucosyltransferase and analysis of global 5-hydroxymethylcytosine in unique genomes. Biochemistry. , (2012).
- Rusmintratip, V., Sowers, L. C. An unexpectedly high excision capacity for mispaired 5-hydroxymethyluracil in human cell extracts. Proc. Natl. Acad. Sci. U.S.A. 97, 14183-14187 (2000).
- Globisch, D. Tissue distribution of 5-hydroxymethylcytosine and search for active demethylation intermediates. PLoS One. 5, e15367(2010).
- Yildirim, O. Mbd3/NURD Complex Regulates Expression of 5-Hydroxymethylcytosine Marked Genes in Embryonic Stem Cells. Cell. 147, 1498-1510 (2011).
- Szulwach, K. E. Integrating 5-hydroxymethylcytosine into the epigenomic landscape of human embryonic stem cells. PLoS Genet. 7, e1002154(2011).
- Szulwach, K. E. 5-hmC-mediated epigenetic dynamics during postnatal neurodevelopment and aging. Nat. Neurosci. 14, 1607-1616 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved