Method Article
両生類網膜スライス標本における感光体と2次ニューロンからの同時ホールセル録音
要約
私たちは、水生虎サンショウウオ(から薄い網膜スライスの調製を記載 Ambystomaのtigrinum)、我々は光受容体と二次の水平および双極細胞からデュアルホールセル電圧クランプ記録を取得することにより、網膜におけるシナプス処理を研究するために、これらのスライスを使用方法について説明します。
要約
網膜の神経科学の中心的なタスクの1つは、網膜神経細胞の回路とどのようにそれらの接続が脳に送信された信号を整形するための責任がありますを理解することです。光子は、それが視神経を介して処理され、脳内の中央ターゲットに通信される他の網膜ニューロンにそれを送信し、電気信号に変換し、そのエネルギーを桿体と錐体光受容体によって網膜に検出される。網膜3,4の出力セル-網膜の回路と視覚処理に重要な初期の洞察は、網膜神経節細胞のスパイク活動の電気生理学的記録から、後で、カハール1,2の組織学的研究から来て。
網膜における視覚処理の詳細な理解は、感光体から網膜神経節細胞への経路の各ステップでシグナリングを理解する必要があります。しかし、多くの網膜細胞の種類はいがある電気生理学的記録のために相対的にアクセスできないので、組織の奥深くとiedを。この制限は、網膜の層の各々内に存在する細胞がはっきりと見えると電気生理学的記録のためにアクセスされた垂直スライスを操作することによって克服することができる。
ここでは、幼虫の虎サンショウウオ(Ambystomaのtigrinum)から網膜の垂直方向のセクションを作るための方法を記載する。この準備は、もともと鋭い微小電極5,6とのレコーディングのために開発されたが、同時に記録しながら、我々は光受容体の膜電位を操作する光受容体と二次水平および双極細胞からデュアルホールセル電圧クランプ記録するための方法を説明する記事を、水平または双極細胞におけるシナプス応答。虎サンショウウオの光受容体は、このTに着手する中で理想的な準備のこと、哺乳動物種のものよりもかなり大きくなっている彼の技術的に困難な実験的なアプローチ。よくトニック神経伝達物質の放出7の高レートを維持するために適していますロッドとコーン光受容体を含む神経細胞のほんの一握りで発見専門のシナプスの構造-これらの実験は、シナプスリボンのシグナリング特性をプロービングに向かって目で説明されてい、8 -とどのようにそれは、この最初の網膜シナプスのユニークなシグナリング特性に貢献しています。
プロトコル
1。網膜スライスの準備
- チャンバー( 図1に示される設計)を組み立てる。場所真空グリースの2つのビード、superfusateためのチャネルを形成し、網膜切片を埋め込むする記録チャンバを横切る離間〜8〜10ミリメートル。堤防とリミット波及として機能するように数ミリ遠くからグリース、これらの2つのビーズの各越えグリースの第2のビードを追加します。基準電極と流体接触を確保するために、チャンバの端部にキムワイプの小さい三角形の部分を配置する。
- 真空グリースの二つの小さなビーズにガラス顕微鏡スライドに対してフラット、ニトロセルロース膜(0.8μmの孔〜5×10㎜)の部分を押してください。これが付着するの網膜を防ぐことができますように、直接ニトロセルロース膜の中央下にグリースを入れないようにしてください。
- 組織スライサーを準備するには、4の部分にダブルエッジかみそりの刃を分解し、スライシング腕にものを添付してください。 nitrocellulの薄いスライスをカット大証は膜カミソリ刃の刃先が、記録室に対して平らに産むので、ニトロセルロース膜を通ってきれいにカットしていることを確認する。
- 解剖駅で氷の上で両生類食塩水( 表1)の小さなビーカーを保管してください。
- 断頭によりサンショウウオを安楽死させる。脊髄を通してsagitally頭と髄を二等分する。綿の部分での頭の代わりに半分はリノリウムブロックの上両生類生理食塩水で湿らせた。頭のもう半分は湿ったペーパータオルで包み、4℃で保存できます一日で後で使用するためのC。
- 目を摘出。小さなVannasはさみを使用して、周囲の軌道に目を接続する皮膚を切った。周囲の軌道組織から目の前を解放した後、前方に目を引いて、軌道から目を解放し、目の筋肉と視神経を切断するために目の下ハサミをスライドさせます。
- 上の綿のベッドの上で摘出目を置きリノリウムブロック。半分頭を破棄。目の奥から余分な眼窩脂肪をトリミング。
- 鋭い外科刃で角膜の中央に小さな切開を行います。切開に細かいVannasはさみをスライドし、鋸状縁に向かって放射状にカットを拡張することにより、角膜を削除します。リノリウムブロックやカットの間に綿を回転させることにより、鋸状縁の周りに円周方向にカットします。
- 目の周りのすべての道をカットした後、アイカップの側面からそれらを引いて、角膜とレンズを取り外します。両生類の食塩水で湿らせたリノリウムブロックの硬い表面に生じたアイカップを移動します。あなたは強膜を介してすべての道をカットしていることを確実にするために細かい鋸モーションを使用して、鋭利なカミソリの刃を持つ分にそれをカットします。
- 下向き網膜表面とニトロセルロース膜上のアイカップの1つまたは2つのピースを置きます。水没追加の食塩水で、残りの部分をして〜4℃の冷蔵庫の中に置いてください
- Geのntly細かいピンセットでニトロセルロース膜に対して、アイカップの部分を押してください。網膜が付着するのに役立つようにキムワイプとエッジで冷たい両生類生理食塩水とブロットを数滴と水没ニトロセルロース膜とアイピース。冷たい両生類生理食塩液と剥がれ強/脈絡膜/(無漂白ロドプシンの存在に起因するピンク色現れることができます)網膜を分離する網膜色素上皮を数滴ともう一度、水没アイカップ、ニトロセルロース膜。必要に応じて、網膜を解放するために視神経を切った。
- 網膜がしっかり付着していない場合は、ニトロセルロース膜にもっとしっかりと網膜をプルダウンするキムワイプで生理食塩水を離れて排出します。生理食塩水を交換してください。必要に応じて繰り返します。
- 冷たい両生類生理食塩水室を記入し、組織スライサーの段階に転送します。バーニアマイクロメータを回して、もう一方の端から作業し、薄い短冊状に網膜とニトロセルロース膜をスライス125μm刻み。網膜とニトロセルロース膜を通して慎重に、しっかりとカミソリの刃を押してください。
- 記録室のメインチャンネルにニトロセルロース膜のストリップを移動することによって網膜スライスを転送します。遊離膜のストリップを持ち上げ、その下に室を動かしながらスライスが水没維持することを確認され、所定の位置に保持。網膜の層を表示するためにそれらを90度回転させ、真空グリースのストリップでニトロセルロース膜の端を埋め込む。
- ガラス面に対して平らニトロセルロース膜を押してください。すべての作品で網膜がない場合でも、灌流チャネルの全長に沿って一定の間隔(離れ〜1㎜)でニトロセルロース膜の代わりにストリップは表面張力を壊すと流体の流れを改善するのに役立ちます。
2。ペアの全細胞録音
- すべてのスライスが転送された後、固定された、直立のステージに記録チャンバを移動させるステージ顕微鏡および基準電極リードを接続します。長いワーキングディスタンス、水浸漬、40-60X対物レンズを用いてスライスに焦点を当てています。顕微鏡は、振動を減衰するためのエアテーブル上に配置され、電気的干渉を低減するためファラデーケージで囲むべきである。
- 100%のO 2でバブリング両生類食塩水で1ml /分の速度で連続的にスライスを表面かん流する。流入と流出のバランスがあることを確認しながら、吸引を接続します。流出は、吸引針の面取り端部を回転させることにより、または近づけたり遠く流出針からチャンバの端部にキムワイプを動かすことによって調整することができる。製剤は、室温に保たまたはペルチェ素子、または単に顕微鏡のステージ上にアイスパックを設定することにより冷却することができる。
- 薄暗いまたは赤外光の下でスライスを調べ、細胞のペアを識別 - 全細胞記録の対象に - 光受容体(ロッドまたはコーン)、近くの水平または双極細胞を。ロッドはIすることができますそれらの大きな細胞体と著名な棒状の外節( 図2A)によりdentified。コーンは棒よりも小さいと小さなテーパー外側セグメントを持っている。双極細胞と水平細胞の細胞体は、内顆粒層における細胞体(; 図2Bおよび2C INL)の最も外側の行にある。
- スライスを準備する前に、ホウケイ酸ガラス(1.2ミリメートル外径、ガラス繊維と0.95ミリメートル、内径)から、マイクロピペットを製造するピペットプラーを使用しています。各マイクロピペットの先端は直径〜1-2ミクロンであるべきである。
- 非金属充填針( 例えば、1 ccのシリンジまたはMicroFilから製造1)を用いて、細胞内液( 表1)とピペットを記入し、電極ホルダに取り付ける。
- 若干顕微鏡対物を高める。目的の下に感光ピペットを置き、次に先端がただのスライスの上に位置するようにそれを下げる。 Tで繰り返し彼二ピペット。
- アンプのベースライン、現在のレベルで任意のオフセットを調整します。 5-10 mVの脱分極パルスでピペットの抵抗をチェックします。我々は一般的に10〜15MΩの範囲、シャフトの長いテーパーと両生類ピペットソリューションの低浸透圧の結果というピペットを使用しています。高い浸透圧哺乳類のソリューションにより、これらの同じピペットはMΩ〜8-12の抵抗値を示す。我々は両生類溶液中の3-4MΩの抵抗値を有するより大きなチップ直径を使用しているが、より低いアクセス抵抗によって提供される利点は、細胞膜およびカルシウム電流および他のセカンドメッセンジャーのより迅速な要約上に封止における大きな困難によって相殺される敏感な反応。
- 若干の正圧、位置をシナプス後ピペットをかけながら、それが接触する水平または双極細胞体をそのように。それは接触ロッドや錐体の細胞体をするようにシナプス前ピペットを配置。録音付ピペットチップではなくソーマより内側のセグメントに連絡する際、Arは特にコーンで、より安定しています。
- 抵抗を監視しながら、シナプス後ピペットで正圧を解放。時には、正圧の放出はギガオームシールを形成するのに十分である。そうでない場合は、1ミリリットルのシリンジでまたは口から優しい吸引を適用します。先端抵抗がMΩ> 100に成長した後、-60 mVでの保持電位を適用します。ギガオームシールを取得した後、任意のピペット容量過渡をnullにし、-70 mVでの保持電位を適用する、体ピペット用シーリング手順を繰り返します。
- 破裂あなたの口や順番に各セルに吸引を適用するための注射器を使用してパッチ。ロッド、コーン、および双極細胞は穏やかな吸引破裂通常ます。水平細胞と細胞全体のコンフィギュレーションを取得する"ザップ" Fに付属の強力なクイック電圧パルスとの組み合わせでより大きな吸引力を(3 ccのシリンジとIE)が必要な場合がありパッチクランプアンプの特集。全細胞構成の膜と設立の破裂は全細胞キャパシタンスの過渡電圧の出現によって明らかになるであろう。
- 光フラッシュを適用し、20 mVの増分( 図3、図4)-120〜+40 mVの電圧からの一連の手順を提供することで、生理的にシナプス後細胞の身元を確認してください。
- 細胞のペアがシナプス接続している場合、体に短い(25から100ミリ秒)、60 mVのステップの脱分極を実現(-10 mVにまで、L型電位依存性カルシウム電流のピーク付近)と見て評価するために、二次ニューロンにシナプス後電流( 図5)。強い脱分極ステップはコーン( 図5)から、小胞の放出のバーストによって引き起こされるシナプス後水平またはOFF双極細胞に速く、過渡内側シナプス後電流を呼び起こす必要があります。
結果
サンショウウオ網膜の垂直スライスのニューロンからの光反応の代表的なトレースは、 図3に示されている。コーン、水平細胞、および双極細胞OFFは、すべての光発症に応じ外向き電流を表示します。水平方向と双極細胞の録音で光フラッシュに続く著名な内向き電流は、それらが光オフセットで脱分極と光受容体からのグルタミン酸放出の増加によって引き起こされる。双極細胞ON TRPM1チャンネル9の符号反転代謝型グルタミン酸受容体シグナル伝達カスケードと活性化に起因する光発症時向き電流で応答します。水平細胞および双極細胞は、それらのIV関係( 図4)によって互いに区別することができる。双極細胞が高入力抵抗があるが、水平細胞は、典型的には( 図4AMΩ<500)直鎖又は内方IVおよび低い入力抵抗を整流してい(0.5-2GΩ)と私を外向き整流- V( 図4B)を図5に円錐水平細胞のペア( 図5A)とコーン-OFF双極細胞のペア( 図5B)の録音から代表的な結果を示しています。それぞれにおいて、-70 mVでの保持電位から-10 mVまでコーンを脱分極は水平または双極細胞におけるコーンと速い内側EPSCの現在の電圧依存性カルシウムを誘発。この強い刺激は〜47 PA /リボン10のEPSCの結果、各シナプスリボンから〜20小胞の容易に剥離プールを空にするのに十分である。 図5Aに水平細胞のEPSCは、それがシナプス前コーンから5リボンコンタクトを受信したことを示唆し、232 pAのだった。オフ双極細胞における178 pAのEPSC( 図5B)から同様の推定値は、それがシナプス前コーンから4リボンコンタクトを受信したことを示唆している。
| 両生類生理食塩水 | シナプス前ピペット | シナプス後ピペット | |
| NaClを | 116 mMの | 3.5 mMの | 3.5 mMの |
| 塩化カリウム | 2.5mMの | ||
| CaCl 2を | 1.8 mMの | 1mMの | 1mMの |
| MgCl 2を | 0.5mMの | 1mMの | 1mMの |
| HEPES | 10mMの | 10mMの | 10mMの |
| グルコース | 5 mMの | ||
| CS-グルタミン酸* | 40mMの | ||
| CS-グルコン** | 50mMの | 90 mMの | |
| 塩化テトラエチルアンモニウム | 10mMの | 10mMの | |
| ATP-Mgの | 9mmの | 9mmの | |
| GTP | 0.5mMの | 0.5mMの | |
| EGTA | 5 mMの | 5 mMの | |
| のpH *** | 7.8 | 7.2 | 7.2 |
| 浸透圧**** | 245 mOsm | 240 mOsm | 240 mOSM |
*セシウムグルタミン酸、ピペット溶液中の40ミリメートルCsOHを持つ40ミリメートルL-グルタミン酸を中和することによって行われる。セシウムグルコン酸** 1 Mストックは45から50パーセント、D-グルコン酸とCsOHをの解を中和することによって作られる。 *** pHはピペットソリューションの細胞外溶液とCsOHをためNaOHで調整する必要があります。 ****外液の細胞腫れを防ぎ、記録の寿命を高めることだけ下ピペットソリューションの浸透圧を維持する。
テーブル1。このプロトコルで使用される標準的な細胞内と細胞外のソリューションのコンポーネントとパラメータ。
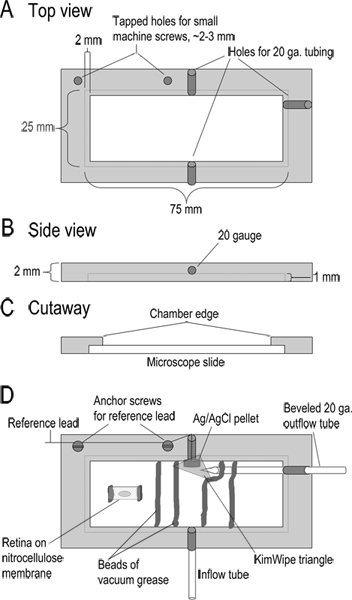
図1。録音室の設計。(AC)がトップ、サイド、および寸法を示す記録室の断面ビュー。チャンバーは、アクリルの厚さ2mmから機械加工されています(D)組み立て室が。 Superfusateはテフロンチューブの長さ10cm(;タイプ24LW 流入管 )を通してチャンバに入る。 Superfusateは、チャンバの反対側に面取りされた20ゲージの金属管に軽度の吸引を適用することによって除去される。この出力管に隣接して銀/塩化銀ペレット参照電極である。この参照電極からのリードヘッドステージの基準入力に接続されている。キムワイプの小さな三角形溶液と接触してそれを維持し、流出管に液流を調整するように基準電極上に配置される。チャンバは、チャンバの底部の凹部の縁にガラス顕微鏡スライドを配置することによって形成されている。スライドは真空グリースのビードで所定の位置に保持される。網膜スライスをニトロセルロース膜のストリップが流れ溶液のチャネルを形成する真空グリースのビーズに埋め込まれている。従来のスライスを製造する、ニトロセルロース膜5×10ミリメートル片を真空グリースの二つの小さなビーズでチャンバに固定される。アイカップの部分は、このニトロセルロース膜上に硝子体の側を下に配置され、網膜に付着一度離れて持ち上げられる。 より大きい数字を表示するには、ここをクリックしてください 。
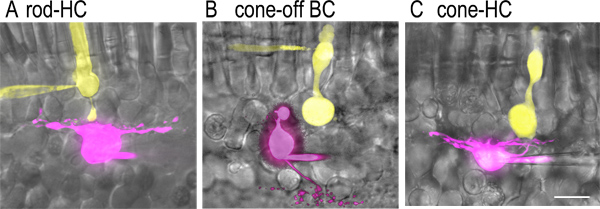
図2。再構築中の色素が充填されたセル対rticalスライス標本。同時ホールセル記録中のパッチピペットを介して導入された対照的な蛍光色素に満ちていた)ロッドの画像とシナプス結合水平細胞。ルシファーイエロー(2 mg / ml)でロッドピペット溶液(黄色)とsulfarhodamine B(1 mg / ml)で水平細胞のピペット溶液(紫)に含まれていたに含まれていた。蛍光画像は、冷却CCDカメラ(オルカER)を備えており、固定ステージ顕微鏡(60X、1.0 NA水浸対物レンズとニコンE600 FN)に取り付けられた回転する円盤共焦点顕微鏡(パーキンエルマーUltraview LCI)を用いて捕捉した。これらのイメージは)Adobe Photoshopの。Bを使用して、対応する網膜のスライスの明視野画像にコーンの画像を重ねて双極細胞OFFシナプス結合された。双極細胞軸索ターミナル内顆粒層との国境に近い内網状層の最も外側の(S1)sublaminaでramifies。 C)コーンとシナプス結合水平細胞の画像。コーン端末はロッドの軸索末端よりかなり大きいことに注意してください。水平細胞は、その細胞体、ON-OFFし、INL内型双極細胞を容易に記録前に区別することができないの細胞体の長方形の形状によって識別することができない。しかしながら、当変位円錐駆動ONL中の細胞体を有し、内側及び外側のセグメントの欠如によって錐体と区別することができる双極細胞OFFを標的とすることができる。スケールバーは20μmである。
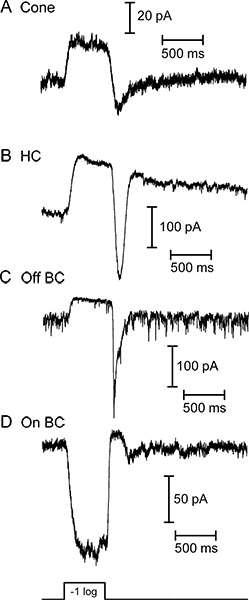
図3。白色光の明るい500ミリフラッシュに対応して四つの異なる網膜ニューロンからの電圧クランプの下に記録された電流を光誘発。コーン()、水平細胞は、 (B)、および双極細胞から(C)は、すべての外向き電流で点灯するように答えた。(D)の双極細胞は、内向き電流と同じ光刺激に反応した。オフ双極細胞(C)によって示されたベースラインノイズは、光受容体が光に過分極時に減少する暗闇の中でのシナプス小胞の継続的な放出を反映している。これらの4つのセルからの応答は、白色光の下準備のスライスを使用して別々のレコーディングで得られた。これらの例で使用されて白色光刺激の強度が1×10 5光子/秒/μm2での580 nmの光子束に相当する水平および双極細胞内応答を生成した。
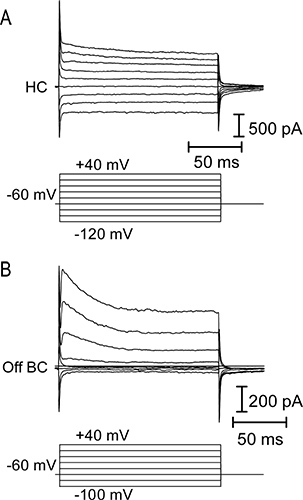
図4。 Hの電流-電圧(IV)の関係orizontalとオフ双極細胞。() トップパネル 、-120から水平細胞に20 mVの刻み( 下パネル )で適用+40 mVの〜150ミリ秒の電圧の一連の手順により誘発される膜電流。水平細胞は、典型的には低い入力抵抗と直鎖または内向き整流IV関係を有する。電圧一連のステップに応答してオフ双極細胞の(B)IV関係 。双極細胞は、電位依存性カリウム電流の活性化による高入力抵抗と外向き整流IVを有する。
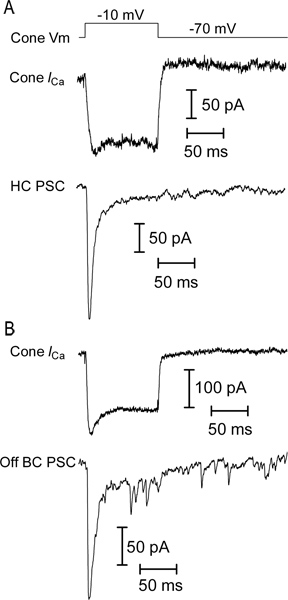
図5。ペアの記録データの例。コーン電圧依存性カルシウム電流( コーン I のCa()記録コーンV M)の保持電位から-10 mVの〜100ミリ秒の段階に応じて、UB>)。リークキャパシタンスの過渡P / 8リークサブトラクションプロトコルを使用して差し引いた。 (EPSC; HC PSC)速い興奮性シナプス後電流は、これら二つの細胞がシナプス結合されていることを示す、水平細胞から同時に記録された(B)EPSCは、別の同じ刺激に応じてオフの双極細胞に計上された。コーン。
ディスカッション
網膜スライス標本は、視覚情報を処理する網膜によって使用される回路とメカニズムを分析するために非常に有用であることが分かっている。前とシナプス後ニューロンから同時に全細胞記録を入手する能力は、この努力で特に役立っています。異なる網膜層が露出しているので、ペアになって全細胞記録は、フラットマウント網膜の準備よりもスライスを達成することがはるかに簡単です。また、ために彼らの大網膜神経細胞の、サンショウウオは、網膜準備として長い歴史を持っているので、特によく特徴付けモデルシステムを提供します。
練習すれば、サンショウウオの網膜の健全なスライスは定期的に調製することができる。いくつかの重要なステップは、成功と失敗の違いを作ることができます。 1)それはきれいにティッシュとunderlyi両方のにガラス面とスライスに対して平らになるようにカミソリの刃が組織スライサーに搭載されていることを確認してくださいngのニトロセルロース膜。あなたはニトロセルロース膜を通してきれいにカットを加えた場合はカミソリの刃がスライドガラスの表面に当たるように、かすかなクリック音が聞こえます。 2)網膜は、ニトロセルロース膜に付着していることを確認します。そうしないと、網膜は手順の任意のステップの間に膜から離れて浮くことができます。 3)これは表面的な細胞の多くが損傷しますように、空気にカットスライスをさらさないでください。 4)スライスし、ニトロセルロース膜は網膜の層は解剖顕微鏡の下に明らかになるようにスライドガラスに対して平らに確認してください。 5)録音室のオーバーフローを回避するために、superfusate流入と流出率のバランスをとる。これは、急激な組織の動きを引き起こす可能性があり、ソリューションレベルの急激な変化を防ぐことができます。 6)お互いに近い細胞の健全なペアを選択します。スムーズな細胞質を有する細胞が粗く細胞質と細胞よりも健康的です。スライス内より深い細胞は無傷シナプス詐欺を保持する可能性が高くなりますtacts。 7)ピペットチップは、細胞への途中でダウンして壊れたり、他の組織やゴミをかすめていないことを確認してください。 8)は、それがデブリ又はことが困難品質ホールセル記録を得るようにすることができ、どちらも泡で詰まっていないことを確認するためにピペット抵抗をチェックする。
むしろニトロセルロースろ紙に網膜を取り付けるのではなく、いくつかの研究者は、寒天のブロックで網膜を埋め込み、網膜のスライスをカットするビブラトームを使用しています。我々はこのアプローチを試していないが、Kim ら11は 、両方のアプローチの利点を説明します。自分の経験では、寒天ベースのアプローチは、よく線引き網膜層がフラットスライスのより一貫した収量を提供しますが、フィルター紙ベースのアプローチでは、健康的な光受容体が得られます。
ロッドとコーンは、膜電位の変化に光を伝達する責任があります。一対の録音と、ロッドまたは錐体の膜電位はmanipulすることができ細胞の種類を同定するのに役立つが、必須ではないかもしれないが、直接かつその光レスポンスを生成する能力をated。したがって、我々は、多くの場合、白色光でスライスを準備します。図応答によって示されているようしかし、明るい照明の下準備た場合でも、サンショウウオ網膜神経細胞は、大きな光の応答を生成することができます。 3。これは、大外セグメント量の発色団の比較的大きな貯水池が一因ですが、またコーン12に対して11 -シス-レチナール再生成するミュラー細胞の能力を反映しているのかもしれない。完全に暗順応光の応答を取得するためには、赤外線照明の下でスライスを準備することができます。赤外光下での解剖のために、我々は解剖顕微鏡の接眼レンズにGenIIIイメージインテンシファイアを(Nitemate NAV3、リットン·インダストリーズ、テンペ、アリゾナ州)を添付し、赤外線LEDの懐中電灯で組織を照らす。スライシングおよび解剖顕微鏡下で実施されていない他の手順については、我々は、ヘッドマウントいまを用いるGEインテンシファイア。パッチピペットの配置のために、我々は直立、固定ステージ顕微鏡に取り付けられた赤外線感度CCDカメラ( 例えばワテック502H、ワテック社、ミドルタウン、ニューヨーク州)を使用してスライスを視覚化する。これらの注意事項では、1つは単一光子感度6、13を示すロッドレスポンスを得ることができます。
網膜のスライスで作業の1つの制限は、大規模なフィールド網膜ニューロンの長い細胞プロセスはスライシング手順の間にそれらの樹状突起の多くを失うかもしれないということです。網膜スライス標本は、したがってシナプス接点が細胞体に近いプロセスを伴うている細胞の生理機能を研究するための、より便利です。両生類や哺乳類の網膜は、同じ種類の細胞の多くを共有し、同じような生理学的メカニズムを14-16を使用しています。サンショウウオの網膜は、哺乳類網膜の多くの側面のための優れたモデルですが、一つの重要な違いは、哺乳動物の専用ロッド経路の存在であるように見えることINVOAIIアマクリン細胞の上に特殊なロッド双極細胞のlves接点14。サンショウウオの網膜の追加の制限は、この種のために特別に開発された遺伝的なツールの数が少ないです。他の種でターゲットのよく保存された領域がサラマンダーで正常に使用できることが、抗体およびshRNAの試薬、多くの小分子阻害剤とペプチド試薬ができますように。また、この技術にはいくつかの変更を加えて、網膜切片を、これらのツールの一部は、より容易に入手可能である他の種から調製することができる。
ペアの全細胞記録のためにその有用性を超えて、サンショウウオ網膜スライス標本は、他の様々なアプローチの影響を受けやすいです。上述したように、網膜切片を、様々な電圧クランププロトコル17との組み合わせで光反応を研究するために使用することができる。網膜神経細胞はまたのCa 2に敏感な蛍光色素でロードすることができます+、Cl -の、又はNa+パッチピペットを介して、またはバス·アプリケーション15,18-20によって導入されました。シナプスリボン21に結合する蛍光性ペプチドは、パッチピペットを介して導入されたときフルオレセインに結合した、急性及び選択的にリボン22を損傷する撮像リボン10又は、使用することができる。また、ロッドにおける個々のカルシウムチャンネルとコーンシナプス端子23の動きを監視するために量子ドットとの組み合わせにおける網膜のスライスを使用している。このように、縦の網膜スライスは、基本的なシナプスのメカニズムや視覚シグナル伝達経路の最初のシナプスで行われるユニークな処理機能を研究するための多目的な実験的な準備です。
開示事項
利害の衝突は宣言されていない。
謝辞
この作品は、失明や保健助成EY10542の国立研究所を防止する研究によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| Tissue slicer | Stoelting | 51425 | |
| Double edge razor blades | Ted Pella, Inc | 121-6 | |
| Nitrocellulose membranes | Millipore | AAWP02500 | Type AAWP 0.8 mm pore |
| Borosilicate glass pipettes | World Precision Instruments | TW120F-4 | 1.2mm OD 0.95 mm ID |
| Ag/AgCl pellet | Warner | E206 | |
| MicroFil | World Precision Instruments | MF34G-5 | 34 ga. Filling needle, 67 mm long |
参考文献
- Ramòn y Cajal, S., Thorpe, S. A., Glickstein, M. . The Structure of the Retina. , (1972).
- Piccolino, M. Cajal and the retina: a 100-year retrospective. Trends Neurosci. 11, 521-525 (1998).
- Hartline, H. K. The response of single optic nerve fibers of the vertebrate eye to illumination of the retina. Am. J. Physiol. 121, 400-415 (1938).
- Kuffler, S. W. Discharge patterns and functional organization of mammalian retina. J. Neurophysiol. 16, 37-68 (1953).
- Werblin, F. S. Transmission along and between rods in the riger salamander retina. J. Physiol. 280, 449-470 (1978).
- Wu, S. M. Synaptic connections between neurons in living slices of the larval tiger salamander retina. J. Neurosci. Meth. 20, 139-149 (1987).
- Heidelberger, R., Thoreson, W. B., Witkovsky, P. Synaptic transmission at retinal ribbon synapses. Prog. Retin. Eye Res. 24, 682-720 (2005).
- Schmitz, F. The making of synaptic ribbons: how they are built and what they do. Neuroscientist. 15, 611-624 (2009).
- Morgans, C. W., Brown, R. L., Duvoisin, R. M. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells. Bioessays. 32, 609-614 (2010).
- Bartoletti, T. M., Babai, N., Thoreson, W. B. Vesicle pool size at the salamander cone ribbon synapse. J. Neurophysiol. 103, 419-423 (2010).
- Kim, M. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis. Exp. (59), e3345 (2012).
- Wang, J. S., Estevez, M. E., Cornwall, M. C., Kefalov, V. J. Intra-retinal visual cycle required for rapid and complete cone dark adaptation. Nat. Neurosci. 12, 295-302 (2009).
- Thoreson, W. B., Tranchina, D., Witkovsky, P. Kinetics of synaptic transfer from rods and cones to horizontal cells in the salamander retina. Neuroscience. 122, 785-798 (2003).
- Wu, S. M. Synaptic organization of the vertebrate retina: general principles and species-specific variations: the Friedenwald lecture. Invest. Ophthalmol. Vis. Sci. 51, 1263-1274 (2010).
- Babai, N., Thoreson, W. B. Horizontal cell feedback regulates calcium currents and intracellular calcium levels in rod photoreceptors of salamander and mouse retina. J. Physiol. 587, 2353-2364 (2009).
- Babai, N., Morgans, C. W., Thoreson, W. B. Calcium-induced calcium release contributes to synaptic release from mouse rod photoreceptors. Neuroscience. 165, 1447-1456 (2010).
- Thoreson, W. B., Burkhardt, D. A. Contrast encoding in retinal bipolar cells: current vs. voltage. Vis. Neurosci. 20, 19-28 (2003).
- Thoreson, W. B., Bryson, E. J., Rabl, K. Reciprocal interactions between calcium and chloride in rod photoreceptors. J. Neurophysiol. 90, 1747-1753 (2003).
- Cadetti, L., Bryson, E. J., Ciccone, C. A., Rabl, K., Thoreson, W. B. Calcium-induced calcium release in rod photoreceptor terminals boosts synaptic transmission during maintained depolarization. Eur. J. Neurosci. 23, 2983-2990 (2006).
- Luo, J., Boosalis, B. J., Thoreson, W. B., Margalit, E. A comparison of optical and electrophysiological methods for recording retinal ganglion cells during electrical stimulation. Curr. Eye Res. 37, 218-227 (2012).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Snellman, J., Mehta, B., Babai, N., Bartoletti, T. M., Akmentin, W., Francis, A., Matthews, G., Thoreson, W. B., Zenisek, D. Acute destruction of the synaptic ribbon reveals a role for the ribbon in vesicle priming. Nat. Neurosci. 14, 1135-1141 (2011).
- Mercer, A. J., Chen, M., Thoreson, W. B. Lateral mobility of presynaptic L-type calcium channels at photoreceptor ribbon synapses. J. Neurosci. 31, 4397-4406 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved