Method Article
脳移植マイクロデバイス及び周辺組織の無傷の組織学的性状
要約
ここでは、光学的にクリアし、齧歯類の脳組織における慢性的に注入されたマイクロデバイスの周りにイメージング無傷の脳組織のインターフェイスを、ラベリング、キャプチャするための組織学的手法を提案する。この方法を含む技術から得られた結果は、その周囲の組織の様々な鋭い脳インプラントの影響を理解するために有用である。
要約
このような微小電極アレイとして脳注入マイクロデバイスの設計と利用の研究は、脳組織を周囲の慢性的インターフェースの臨床的に関連するデバイスを製造することを目指しています。これらのインプラント周囲の組織は、デバイスの周囲の絶縁 "グリア性瘢痕"の形成を含む時間を超えるデバイスの存在に反応すると考えられている。しかし、これらの組織変化の組織学的分析は、一般的に関心の組織の形態を混乱させることができるプロセスでは、デバイスをexplanting後に実行されます。
ここでは、皮質の注入装置は、げっ歯類の脳組織を取り巻く内にそのまま収集されているプロトコルを示しています。我々は一度固定液で灌流方法、説明し、脳をexplantingデバイスを回避するような方法で除去し、スライスされています。我々は有益な、まだ厚い組織を製造するために有用な蛍光抗体標識と光決済方法を概説セクション。最後に、我々は脳注入装置周辺の生体界面を調べるために、これらの組織切片のマウントおよびイメージングを実証している。
概要
neuroprosthetic研究の分野では、デバイス1,2をインターフェースCNSを通じて体内に罹患または損傷した構造をバイパスすることにより、様々な障害や疾患を患っている人を支援することを目指しています。このような微小電極アレイ(MEAの)などの脳注入マイクロデバイスは、記録または刺激する脳の構造を、したがってエレクトロニクスおよびCNS組織3から5の間に長期的なインタフェースの構築を可能にするために使用することができます。貫 通MEAS、脳組織に追い込まれているデバイスは、彼らが近くのニューロン6の比較的小さいセットに電極を提示し、その中に近接のための双方向インターフェイスとして特定の約束を保持する。
しかし、貫通MEAの長期注入から複雑な組織応答の結果は、多くの場合、数日から数カ月にわたって変数と徐々に分解する電気生理学的信号対雑音比で、その結果、および電気インピーダンスの増加電極部位とグランドの間に7,8インピーダンス。これらの変化の推定上の起源は、ミクログリアの活性化、マイクロデバイスに沿って反応性星状細胞、及び移植デバイス9月11日に周囲の組織から神経細胞の損失または移行が含まれています。慢性的、浸透MEAの周りこれらの組織変化を理解するための主要な課題は、慢性的に注入されたデバイス12を取り囲む無傷組織界面の組織学的データをキャプチャすることが困難であることである。デバイス/組織界面で組織の組織学的分析は依然として存在し、現在のデバイス取り外し学的プロトコルによって改善するであろう。組織に邪魔されずに残っているデバイスでは、このような生体適合性コーティング13,14または電極表面15,16の電気的清算の活用など、比較的微妙な相互作用、生物学的影響は、画像化することができ、インプラントに関して分析した。
HERE我々は、収集する方法、プロセス、および画像周囲の脳組織の詳細な顕微鏡ベースの分析のために無傷マイクロデバイス·インターフェースを示しています。この方法では、デバイスとその周辺の脳組織をビブラトームを用いて厚さ(> 250μm)で組織切片内で収集されます。これらの厚いスライスに組織学的ラベルの浸透を改善するために、蛍光組織化学的および免疫組織化学のラベルが複数日のブロッキング血清および界面活性剤を含有する溶液中に高濃度で適用されます。光学決済ソリューションは、顕微鏡イメージング深度を向上させるために採用され、組織は共焦点顕微鏡17をスキャンし 、その後のレーザー用両面室に搭載されている。完全な組織学的インタフェースをキャプチャするには、コンピュータ制御された並進ステージは、インプラントの長さに沿ってzスタックパノラマを収集するために、撮像時に使用されます。イメージングに加え、インプラントから戻っレーザ反射率を集め、組織のラベルを適用と組織の両方の助けを介して透過光は、周囲の組織との関係でデバイスインターフェイスをローカライズします。組織が この"デバイスキャプチャ組織学"を用いて調製し(DCHist)プロトコルは、形態学的に保存された組織/デバイスの相互作用のイメージングのアクセスを提供し、その結果以前のデバイス取り外し学的プロトコル18を改良したものです。
プロトコル
ソリューション
pH7.4で9グラムのNaCl、0.144グラムのKH 2 PO 4、0.795グラムのNa 2 HPO 4、; G / Lで- リン酸緩衝生理食塩水(PBS)
4%ホルムアルデヒド -ミリリットル/リットルで、202ミリリットルナトリウム二塩基性リン酸ナトリウム溶液(0.4 MのNa 2 HPO 4)、48ミリリットルの一塩基性リン酸ナトリウム液(0.4MのNaH 2 PO 4)、500ミリリットル8%ホルムアルデヒド溶液、250ミリリットルのMilli- pH7.4のQ DDI水、
HEPESはアジ化ナトリウム(HBHS)とハンクス緩衝生理食塩水 - G / Lで、7.5グラムのNaCl、0.3グラムのKCl、0.06グラムのKH 2 PO 4、0.13グラムのNa 2 HPO 4、2gのグルコース、2.4グラムのHEPES、0.05グラムのMgCl 2 6部のH 2 O、0.05グラムMgSO 4を 7部のH 2 O、0.165グラムのCaCl 2、pH7.4で0.09グラムのNaN 3
洗浄液(WS) - 1%体積/体積、NORアジ化ナトリウム(NaN 3を )とHBHSにおけるMALヤギ血清、0.3%トリトンX-100、。 4℃、後続のステップで使用する前にWSを冷蔵してください。
U2スカL Eソリューション - 4 M尿素、30%グリセロール、0.1%トリトンX-100 17
PROCEDURE
全ての実験は、パーデュー大学の動物実験委員会とパデュー大学実験動物プログラムの監督の下で行われた。
1。手術
- 様々な無菌手術方法は、提示された組織学的方法と互換性があります。定位フレームと自動インサータの使用は、定位の面に関して再現性と微小電極アレイ(MEA)の制御注入角度を改善するために推奨されています。
注:このデモでは私たちの手術方法は次のとおりです。定位earbars薬用に、げっ歯類の件名を保持イソフルラン麻酔下でeは(1-3%の間)は、医療グレードの酸素によって運ばれる。つま先ピンチの欠如のための試験は、動物が完全に麻酔であることを確認するためにマウスの尾ピンチ反射のラットまたは不足に反映されます。眼軟膏を塗布し、ベタジンとエタノールの3交互に洗浄して手術部位を清掃してください。手を洗う、夜明け手術用手袋、ヘアネット、マスクとガウン。 、手術領域を麻痺はさみや骨スクレーパーと綿のアプリケーター付きメス、明確骨膜を用いた切開を作成し、歯科用ドリルハンドピースとドリルビットを使用して開頭術を作成するためにリドカインのボーラスを注入します。マイクロマニピュレーターを用いて大脳皮質にシングルシャンクMEAを駆動します。無菌手術の条件を維持するために外科助手の援助を持っており、手術の進行状況を文書化します。
- 脳へのMEAの注入に続いて、Bの周りから頭蓋骨の最終的除去を知らせるために手術用顕微鏡を介して画像を収集雨。デバイスの移植部分はその場で保存されます。
注:現場のデバイスの持つ組織の最終的なコレクションは、密接に組織切片の平面を持つデバイスの挿入面をマッチングに依存しています。脳への相対的な装置の挿入面について詳細なメモは、このように非常に重要である。
- デバイス注入後、任意の露出MEAシャンクまたはケーブルの周りに、シリコーンエラストマークウィク-SIL(WPI)を適用し、治すことができます。例えばカットピペットチップとして滅菌プラスチック片は、硬化しながら開頭の周りの小さな井戸におけるシリコーンエラストマーを含めるために使用されるかもしれません。
- クイック·ジンシル、公開された頭蓋骨の上の2つの部分からなる歯科用アクリル( "ジェット液体"とラング歯科から "ジェットパウダー")の層を適用します。
注意 :以降のステップでは、headcapは分離されるべきインプラントを可能にするために経由して溶融され頭蓋骨から。この非常に硬質アクリル、後で除去することが困難であるとして、UV硬化アクリルは、クイック·ジンシルと開頭の上に避けるべきである。インプラント周囲に視覚的に不透明材料も回避すべきである;クリアクウィク-Silはこのプロトコルの後続のステップの間にインプラントのビューを提供します。
- 動物愛護条例のローカルプロトコルに従って術後ケアの手順を実行して、シングルケージに収容され、箱に歩行する被験者を返す。
2。灌流および組織採取
注:ゲージらを参照してください。ラット動物モデル19の詳細な灌流手順のチュートリアルの。
- 金融機関の動物のケアと使用委員会によって承認され麻酔し、灌流プロトコルを使用しています。深くげっ歯類(ラットまたはマウスにおけるテールピンチ反射でつま先のピンチ反射の欠如によって確認された)麻酔し、心臓を露出させた後、はさみで浅いカットを作る左心室と右心房へ。左心室に鈍針を挿入し、部屋一時PBSを届ける。ラットにおける〜100ミリリットル/分で、マウスで〜5 mL / minで約200 mlのPBSで〜10mlのPBSの合計を提供します。中に肝臓から血中クリアランスを探してください。
- 所望であれば気泡を導入することを避けるように注意注意して注射器の配信によって、transcardially組織学的に関連する化学のラベルを注入します。
注:血管ラベル( 例えば DII)と核酸対比染色色素( 例えばヘキスト33342)が灌流時成果物化学ラベルの例です。適切に投与される場合、これらの組織学的マーカーが全体の動物20を付けなければなりません 。
- 動物を修正するtranscardiallyバッファリングされた、室温、4%ホルムアルデヒドを提供します。灌流時に肺鼻排水によって証明することができる心の向こう側隔穿孔を避けてください。大きな筋肉で固定の震えを探す完全灌流を示すことができます。マウスで〜5ml /分およびラットで〜100ml /分で約200mlの固定液で〜10mlの固定の合計を提供します。
- 次の灌流、動物の首を、4℃で一晩、4%ホルムアルデヒド溶液でrongeurs、ハサミと場所のヘッドを使用して脳幹や小脳の一部を露出℃に
- 洗浄の間一から四時間の間隔で、PBSで3回頭を洗ってください。
- ヶ月日間、4℃でアジ化ナトリウムを含むHBHSに固定ヘッドを格納します。
3。 現場デバイスの持つ脳の取り外し
注:適切な個人用保護具を着用した状態で、ドラフト内では、このセクションを実行します。定期的にソリューションをHBHSする固定ヘッドを返すことによって、組織の乾燥を避けてください。
- 慎重にピンセットや小さなハサミを用いてアクリルスカルキャップの周りから皮膚や他の組織を離れて解剖する。
- 熱-iを装着したままnsensitive手袋は、歯科用アクリルを削除してクイック·SIL( 図2a)明確な基盤となる領域を露出させるために、はんだごてを使用します。
注:このステップの目的は、脳移植のコンポーネントが頭蓋骨に固定成分から分離することができるように、マイクロはさみ移植デバイスが脳に入る位置へのアクセスの適切な角度を可能にすることです。
- 手術用顕微鏡下に、下にデバイスが脳に入る位置にピンセットでクイック·ジンシルの小片を除去し、湾曲したマイクロはさみでシリコーンエラストマーに切る。
- 脳に移植部品からポリシリコンと頭蓋骨に取り付けられた別のデバイス·コンポーネントに湾曲したマイクロハサミで開頭の表面に沿って切断を続行します。露出したデバイスコンポーネントを切断するときに再度impを押すか、またはドラッグしないように注意しながら、顕微鏡の倍率と細心の注意を使用する固定組織でlants。
- rongeursを使用して注意してheadcapの周りの骨を削除します。頭蓋骨から注入された機器と脳を分離するためにへらを使用しています。スライスする準備ができるまでHBHS溶液中で脳に保管してください。
- HBHSで満たされたガラスシャーレに脳を置き、彼らがデバイス注入の場所に関連しているかどうかに応じて、例えば脊髄、小脳、または嗅球として、無関係な組織を除去するためにカミソリの刃を使用しています。セクションに脳を脳ブロック(テッド·ペラ)とかみそりの刃を使用し、密接に植え込まれたデバイスの角に一致する平面を作成し、これはそのような任意のその脳を方向付け、適切なサイズの脳ブロックで脳を配置することによって達成されるインプラントの目に見える部分は、カミソリの刃のガイドと一緒に平行であり、インプラントから少なくとも2ミリメートルブレードガイドにカミソリの刃を配置する。組織を介して、カミソリの刃を押します。ビブラトームプラットフォームにこの面をマウントします。オルタナtively、マイクロマニピュレーターにマウントされたカミソリの刃は、密接に、インプラントの方向と一致する平面を作成するために、脳のブロックと同様に制御された方法で使用することができます。
- 場所はビブラトームプラットフォーム下の氷、そして、組織表面が簡単にペーパータオル上で乾燥させた後、スーパー接着剤を使用してビブラトームに脳を遵守します。接着剤は、前のステップで作成されたフラット·組織面では、ステージにある。非対称の組織の大きさで、東洋最大幅が潜在的に組織の上をたたいて刃を避けるためビブラトームブレードの移動方向と平行ダウン接着されたことなどのサンプル。接着剤セット(〜1-2分間)した後、チルド追加(〜4℃)、PBS組織の周りビブラトーム皿に。
- HOから10°の刃角で、最大振動速度(〜100 Hz)と遅い刃の進行速度(毎秒<0.2 mm)を使用して、制御組織を含む200から400μmの間に厚い組織切片を収集rizontal。 4で、24ウェルプレートでHBHSでブラシやスコップへらや店舗で丁寧にスライスを収集℃に
- 現場装置で肉眼または手術用顕微鏡に表示されていれば、100μm以下のスライス単位で装置に接近するシンナーのセクションを収集します。
注意:代表的なシリコンマイクロインプラントは、デバイス表面から300〜500μmのホルムアルデヒド固定した齧歯類大脳皮質組織中の肉眼で見ることができます。
- 現場装置内で今、組織の表面に近い内にデバイスが含まれている> 250μmの組織切片を収集します。必要な厚さの推定は、以前に収集されたスライスを参照することによって支援することができます。
注:大型のデバイス、multishankデバイス、および角度のデバイスは1組織片でデバイスをキャプチャするために、より厚い組織切片(> 500μm)を必要とするかもしれません;再適用されたラベルの浸透と顕微鏡イメージング·深さの両方がこれらの非常に厚いスライスから最終的なデータ収集に制限されることをメンバー。可能であれば、これは組織的および形態学的変形を介してデバイスのドラッグ原因となりますので、ビブラトームブレードを使用してデバイスをぶつからない。
4。組織の処理とクリア
- HBHSで洗浄あたり5分で3倍のスライスを洗う
- 30分合計の水素化ホウ素ナトリウム(HBHSの5mgのNaBH 4月 1日ml)を(15分スライスのそれぞれの側)でインキュベートする。ステンレス鋼またはテフロンコーティングされたマイクロスプーンと小さな絵筆(テッド·ペラ)を使用してスライスを反転します。ゆっくりと思いやりの動きが各スライスフリップの成功を向上させる。ブラシを使用して埋め込まれた装置の周りの任意の領域に触れないようにしてください。可能な場合には、必要な(> 2ミリリットル)よりもはるかに多くのソリューションを追加すると、1がより容易に組織切片を操作し、反転させることができます。
注意:この手順では、内因性の自家蛍光を低減し、蛍光標識が灌流の間に適用またはXFPジェニックマーカーが存在していた場合は、このステップをスキップします。
- 室温で洗浄液で洗浄あたり5分で3倍のスライスを洗う。
注意:洗浄及びインキュベーションステップ中の撹拌はオプションです。著者らは、周囲の脳組織に対して硬いインプラントの微妙な不快感を与えるが、攪拌で発生する可能性があると推測している。ソリューションの動きを向上させながらしかし、穏やか率(<60 rpm)で動く軌道ミキサーはこれを回避することができる。
- 室温で洗浄液に2時間(1時間後にフリップスライス)用のブロック。
- 4℃で約48時間(スライスの各側に24時間)のために一次抗体(洗浄液で希釈)でインキュベートする
- 洗浄溶液で6クイック3分の洗浄を行います。
- 6日1時間の洗浄(3洗浄を行う洗浄溶液中の組織切片の両側にES)(4℃で保存晩洗濯する場合)。
- 4℃で約48時間(各側に24時間)のために二次抗体(洗浄溶液で希釈したもの)でインキュベートする
- 洗浄溶液で6クイック3分の洗浄を行います。
- 一晩洗濯場合は4℃で保存、洗浄溶液中の6,1時間の洗浄(各側面に3回の洗浄)を行います。
- 決済ソリューション-ソリューションを洗い、グリセロールベースの"SCA L E U2"を追加して削除します。 4℃で非常に厚い組織切片(>500μm以下)の厚いスライス(250から500μm)または2〜3週間に約1週間をクリアすることができます
- 4℃で箔とストアとカバープレート
- マウントメディアとして清算ソリューションを使用して、明確なマニキュアで封厚い組織切片( 図2b、2c)を収納するスライドにマウントします。 4℃で保存光年からのC。
5。フルTiのパノラマ画像ssueおよびデバイス·インタフェース
- 長期作動距離顕微鏡対物レンズ(> 2mm)を用いて、共焦点顕微鏡や2光子レーザ走査型顕微鏡でイメージングを開始します。我々は、ツァイスLSM 710、Carl Zeissの "禅"ソフトウェア(2010)、画像、インプラントの周囲に3Dパノラマを、コンピュータ制御されたXY変換ステージとデモンストレーションを行います。
注:いずれかのソフトウェアで、客観的に是正襟裏、または収集後のデータ処理における決済ソリューションの屈折率の正しい。このデモでは、我々はライカ禅顕微鏡ソフトウェアに1.4の "U2"の決済ソリューションの屈折率の値を入力し、この設定が微妙に屈折率のミスマッチを考慮するために、Z-ステップ間隔を調整します。
- デバイスの近くで組織においては、概ね低レーザパワー(〜0を使用して、各蛍光チャネルに対してz次元の適切なz軸ウィンドウとデータ収集の設定を評価する0.5から5までパーセント)と大きなz-ステップサイズ(> 25μm)である。
注:追加の上の空間と下の組織は、スライドガラス(〜20μmの各方向)に完全に平らになるわけではないので、パノラマのデータ収集のためにセットアップするときに、z軸を設定することが含ま。
- あなたの最終的なパノラマのxy中心に目標を設定し、禅パノラマソフトウェアを使用して、関心のあるあなたの地域をカバーするために、各軸(xとy)に必要な収集位置の数を決定します。
- z軸コレクション·ウィンドウを再評価し、完成させる。
- 手動で増加した深さで適切に上昇するため、検出器の感度とレーザパワーを設定します。目的は、組織切片にかかわらず撮像深度とほぼ同じ画像強度を維持することが、高バックグラウンドノイズをも回避することが典型的である。
- 各蛍光画像データシリーズを収集します。信号が重ならないように、必要に応じて、レーザーラインを実行します。順次だ。
注:利用可能な場合には、自動的にコレクションにハードディスクにデータを保存するために、ソフトウェアを設定します。
- "反射"と"透過率"データを収集するために、ソフトウェアの設定を変更し、これらのチャネルを捕捉するために、より長く浸透波長レーザー( 例えば 633 nm)を使用しています。 "反射"と "透過"コレクションのために適切なレーザパワーと検出器の感度を決定し、移植された装置の周りに同じコレクションシリーズを繰り返す。
- 後で処理し、定量化、および分析のためのデータをエクスポートします。
結果
脳移植MEAは、第一の脳に埋め込 まれたコンポーネントから任意の頭蓋骨実装部品を分離することにより、組織切片に収集することができます。 図2aは、歯科用セメントheadcapとMEAケーブルを取り巻くクイック·シルの部分の片側を削除した結果を示していラット頭蓋骨。はんだごては、ドラフト内で歯科用セメントとクイック·シルを除去するために使用されていました。ケーブル配線と、任意の非注入MEAの構造は次のゆっくり固定脳の表面にクイック·ジンシルを通って下掘削によってマイクロはさみで切断した。
スライスした後、ラベリング、および組織をクリアし、シンプルなカスタムメイドのスライドが厚い組織切片( 図2b)を搭載するのに便利です。注入されたマイクロデバイスを含むマウント脳切片を図2cに示されている。 図3に示されるように、スライドのどちら側を通ってイメージングを使用すると、装置の周りのインターフェイスを評価できるようにすることができます、( 図3a)とミクログリアは反対側( 図3b)上に表示されます。
マウントされた組織は、XY移動ステージを用いて画像化することができる。全体の組織切片全体で蛍光標識の概要は、所望の分解能( 図4)で生成することができます。注入されたマイクロデバイスの周りに形態学的に保存された組織·インターフェースの詳細な検証は、局所組織反応( 図5)の分析のための高倍率下で収集することができます。
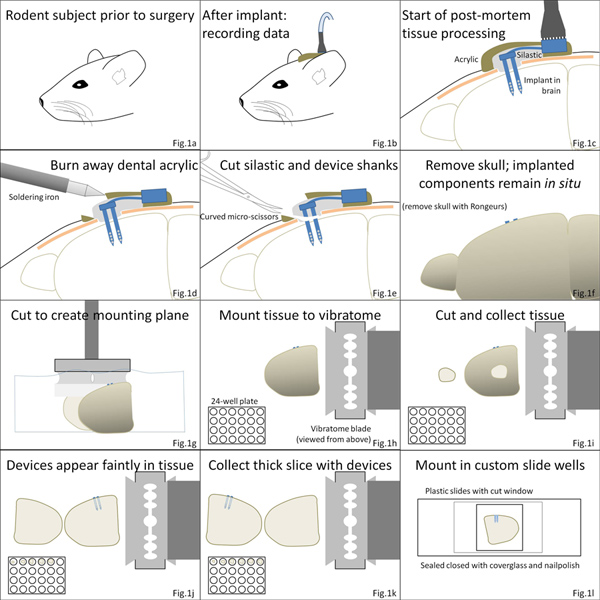
図1。手順の概要。(AC)脳マイクロインプラント手術はFINAアールカバーアクリルセメントに続いてすぐにデバイスを取り巻くクウィク-Silのポリマーの層でlized。 (D、E)に続いて安楽死、アクリル層が離れて焼かれ、デバイスの頭蓋骨実装部品は、シリコーンエラストマーを介して切断することにより注入された成分から分離される。 (f、g)は脳はその後頭蓋骨から削除され、カットとビブラトームステージに取り付けられている。 (HK)組織切片は、デバイスを含む組織切片を含めて、収集されます。 (L)組織が 処理され、詳細な顕微鏡用のカスタムチャンバーに取り付けることができます。 拡大図を表示するには、ここをクリックしてください 。
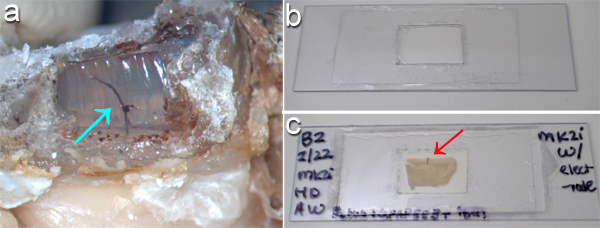
図2(a)のクイック·シルシリコーンエラストマーsuをクリアrroundingを電極アレイ·ケーブル(矢印)は、はんだごてを使用して灌流し、げっ歯類の頭の上に歯科用セメントのキャップでウィンドウを離れて燃焼させて暴露された。 (b)の厚い組織切片のいずれかの側にイメージングに対応するために、単純な"スライド室"プラスチック製のスライドをカットし、組織の周りにどちらかの側にカバーガラスを接着し、ソリューションを実装することによって行うことができる。 (c)は無傷のインプラント(赤矢印)とラット脳組織切片をマウントした後に表示されます。組織のいずれかの側には、この設定で顕微鏡画像にすばやくアクセスできます。パネル(A、B、C)が下部に渡って80ミリメートルいる間スケールの場合、パネル(a)は 、下部に渡っ25mmである。
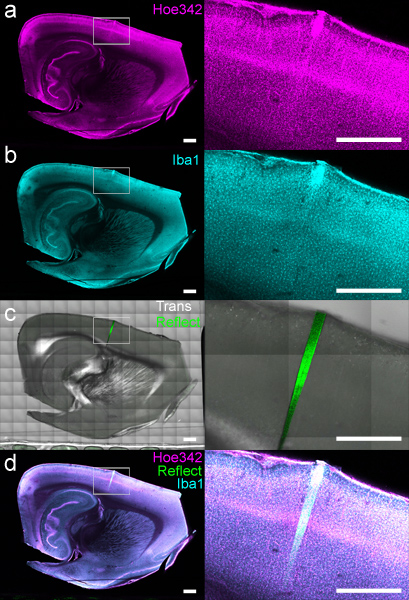
図3の最大値intensityは40μm厚の画像スタックのz予測、裏面()および移植微小電極アレイの前面(b)の周りに集めた。ミクログリア(抗Iba1とAlexa Fluor 633で標識された、白)とデバイスの表面から採取したレーザー光の反射率(赤)は、順次400μmの厚い組織切片の両側から撮像した。脳インプラントはしばしば不透明であるように、両側に光アクセスでマウントすると、顕微鏡の対物レンズに対するインプラントの "背後"とラベルされた組織構造のクリアな視界を提供します。スケールバーは50μmである。
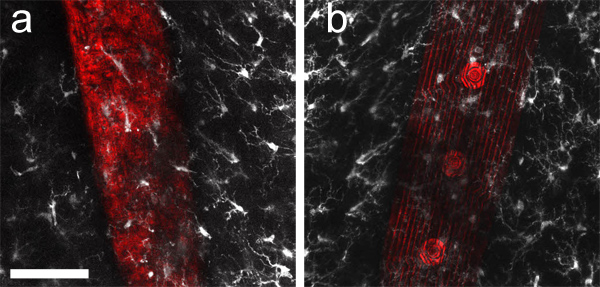
図4:共焦点レーザ走査型顕微鏡にコンピュータ制御されたステージを用いて画像化ラベル付きDCHistスライス。 (a)細胞核(ヘキスト33342で染色)及び(b)の単球/ミクログリア(抗Iba1で標識)を同時に別々のチャネル上に結像された。 (c)は透過光と反射率もヘキストとIba1データに対して4週間のインプラントの位置を示す、収集した。 (d)すべてのチャネルが、送信のオーバーレイも表示されます。白い長方形の領域が右側に現れるイメージで展開される。スケールバーは1mmである。
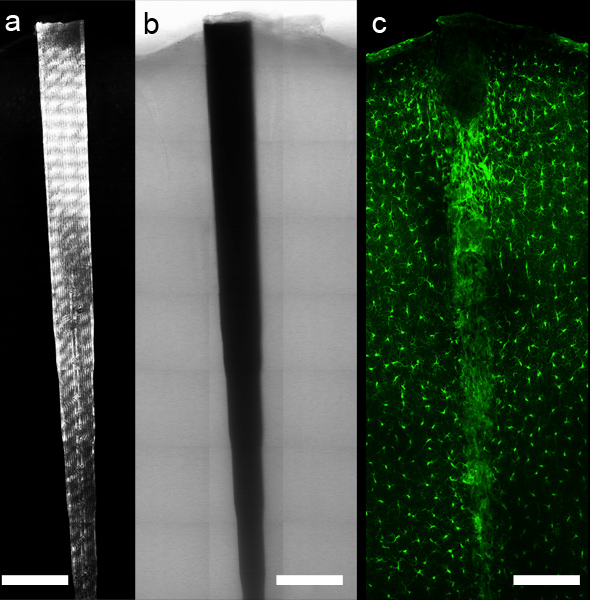
図5:コンピュータ制御顕微鏡ステージ、適切なソフトウェアを使用して、パノラマ画像データはインプラントの周りを収集することができる。反射率()と透過率(b)の蛍光抗体又は化学的標識(C、ミクログリアおよびmacの抗Iba1ラベリングしながら、装置の局在を許可rophages)は無傷の組織の界面に沿って組織成分の詳細なイメージングを可能にする。スケールバーは200μmである。
ディスカッション
ここで示した "デバイスキャプチャ組織学"(DCHist)メソッドは、脳組織および組織形態学的にインプラント間の相互作用の維持に近い組織学的評価が可能になります。 DCHistの組織採取は、脳に移植したコンポーネントから頭蓋骨にマウントされたデバイスコンポーネントを慎重に分離する必要があります。 DCHistも厚い組織学的組織切片(> 250μm)のコレクションを必要とします。これらの組織切片は、一度、標識されたクリアされ、搭載され、画像化され、注入傷害またはデバイス留置後に慢性的な応答に新たな洞察を提供することができます。 図3-5で示されるように、高度な顕微鏡検査ツールを使用して、組織とデバイス間のインターフェイスは、高詳細に画像化し、分析することができます。
彼らの現在の形で紹介する手法は、ゆっくりと注入装置のポイントは2つの部分から成る歯科用セメントとクイック·ジンシルから作らheadcapを離れ発掘する能力に依存しています。離れて燃焼またはそうでなければ削除することができます歯科用セメントと小さなハサミが視覚的に非常に正常にその頭蓋骨実装部品から移植された装置を分離するのに役立つと導くことができるそれを通して明確なシリコンエラストマーを利用。頭蓋骨にマウントされたインプラントは、脳のかなりの量を引き出されるように、その場でそれを収集するために、頭蓋骨の下に、脳上記デバイスを切断しようとすると、推奨されません。
そのようなNeuroNexus TechnologiesからシングルシャンクのMEAとしてシンナー、小さなインプラントは、DCHistに最も適していますが、原則は、シングル·デバイス·シャンクまたは微小電極アレイに限定されません。コレクションおよびイメージング戦略は要件がそれらがどんな頭蓋骨マウントから分離し、厚い組織切片内で収集しなければならないことであることと、マルチシャンクデバイスやカニューレなどの大型インプラントに広く適用されています。著者は、組織の分析に焦点を当てていますが周囲の皮質インプラントは、脳の奥深くに駆動装置はまた、収集され、画像化される可能性があります。インプラント挿入の深さは、挿入の既知の角度から激しく逸脱していないデバイスを提供してスライスにインプラントの取り込みに影響を与えるべきではない。
制限はDCHist法の有用なアプリケーションに存在しています。光学決済ソリューションが大幅に様々な組織21の撮像深度を向上させることができますが、脳組織切片は、特に白質の分野で、数百マイクロメートルを介して画像に挑戦しています。さらに撮像深度を向上させるために、2光子励起顕微鏡を説明した光クリアと一緒に使用することができる。
記載された方法のもう一つの潜在的な制限は、研究者によって使用される特定の蛍光免疫組織化学法と抗体であり得る。受動拡散は、典型的には、固定組織を介してこれらのマーカーの取り込みを駆動および抗原結合部位へ。最終抗体作業濃度が背景標識の高いレベルを回避しながら、ラベルの普及率を最大化するために、ケースバイケースでの研究者によって決定されなければならない。抗体標識は、同じように処理されるスライス間の変数であってはならないが、別の抗体は、いくつかの抗体が容易に抗原をマイクロメートルの唯一の数十が深い抗原を標識する多くの深い、数百マイクロメートルと他人をラベリングして、それらの抗原を貫通してタグ付けする能力が大幅に異なる場合があります。我々は、アプリケーションの複数日間、および希薄洗剤とブロッキング血清を含有する溶液中で、典型的な濃度よりも高い抗体でラベルを適用することによって、この拡散を改善について説明します。定期的にスライスをひっくり返すこともあってもラベリングを推進しています。抗原賦活手順や代替固定プロセス( 例えばグルタルアルデヒド、電子レンジなど)は、特定の抗原に対して適切であるかもしれません。二次抗体-fluorochローマコンジュゲートはまた、これはInvitrogenからのAlexa Fluorラベルを使用して執筆者によって観察されていませんが、厚い部分にラベルを付ける彼らのパフォーマンスは異なる場合があります。あるいは、目的の細胞型で蛍光タンパク質を発現するトランスジェニック動物の被験者は、抗体のラベルの浸透の問題を回避するために利用することができるようeGFPのような多くの蛍光タンパク質として、ホルムアルデヒド処理した後、その蛍光を保持し、組織切片での即時視覚化することができる。
DCHistは、脳組織に注入されたマイクロデバイスの影響をキャプチャし、分析するための技術の強力なセットです。電気の質と電極インピーダンスデータの in vivo評価22 で 、この組織学的プロトコルを結合することにより、大幅に生理の変動や劣化の生物学的起源についての我々の理解を向上させることができます。特に移植神経補装具の分野には、詳細なDCHist IMAの恩恵を受ける可能性があり生物学的に中性のMEA機器の更なる発展を知らせるために無傷デバイス/組織界面の変更する。
開示事項
著者は、金融やそれ以外の場合、宣言する関連する開示を持ちません。
謝辞
全ての実験は、パーデュー大学の動物実験委員会とパデュー大学実験動物プログラムの監督の下で行われた。
この作品は、を介して、信頼性の高いニューラル技術プログラムの一環として、博士ジャック·W·ジュディ(jack.judy @ darpa.mil)の後援の下に、米国防総省の国防高等研究計画庁(DARPA)のマイクロシステム技術事務所(MTO)が主催したスペースと海上戦システムコマンド(SPAWAR)システムセンター(SSC)の太平洋助成金番号N66001-11-1から4013まで。
著者らは、これらの顕微鏡の専門知識を共有するためのミハイルSlipchenko、ドン·レディ、グレッグ·リヒター、アーロンテイラー、ケビンEliceiriに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| ヘキスト33342 | インビトロジェン | 14533 | DNAマーカー |
| ウサギ抗Iba1 | 和光市(日本) | 019から19741 | 単球抗体 |
| 歯科アクリル | ラング歯科(様々な代理店) | ジェット義歯修理パウダー&リキッド | Headcap建設 |
| クイック·シル | ワールド·精密機器 | KWIK-SIL | 露出した頭蓋インプラントをカバー |
| 正常ヤギ血清 | ジャクソンイムノリサーチ | 005-000-121 | 組織処理 |
| トリトンX-100 | シグマアルドリッチ | X100-500ミリリットル | 組織処理 |
| 尿素 | シグマアルドリッチ | U4883 | ソリューションをクリア |
| グリセロール | シグマアルドリッチ | G20225 | ソリューションをクリア |
| 機器 | |||
| 湾曲したマイクロ剪刀 | ワールド·精密機器 | 14208 | 脳を取り外す前に、インプラントを切断 |
| 剃刀の刃 | テッドペラ | (各種サイズ) | 脳のブロックを使用するため |
| アクリル脳Matrice | テッドペラ | 15054 | 組織における初期平面を作成するための脳のブロック |
| プラスチック製のスライド | テッドペラ | 260225 | 取付組織 |
| カバーガラス | テッドペラ | (各種サイズ) | 取付組織 |
| 電極アレイ | NeuroNexusテクノロジーズ | (様々なデザイン) | 例のMEA |
| ビブラトーム | ライカ | VT1000のS | 提示された方法で使用される特定のシステム |
| ビブラトームブレード | (様々なサプライヤー) | スライスを収集 | |
| 24ウェルプレート | (様々なサプライヤー) | 組織切片の保存と処理 | |
| 電動XYスキャニングステージと共焦点顕微鏡 | カールツァイス顕微鏡 | ツァイスLSM 710および '禅2010'ソフトウェア | 提示された方法で使用される特定のシステム |
| はんだごて | (様々なサプライヤー) | headcapを掘る |
参考文献
- Schwartz, A. B. Cortical Neural Prosthetics. Annual Review of Neuroscience. 27, 487-507 (2004).
- Normann, R. A. Technology Insight: future neuroprosthetic therapies for disorders of the nervous system. Nature Clinical Practice Neurology. 3, 444-452 (2007).
- Rousche, P., Normann, R. A. Chronic recording capability of the Utah Intracortical Electrode Array in cat sensory cortex. Journal of Neuroscience Methods. 82, 1-15 (1998).
- Koivuniemi, A., Wilks, S. J., Woolley, A. J., Otto, K. J. Multimodal, longitudinal assessment of intracortical microstimulation. Prog. Brain Res. 194, 131-144 (2011).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing Research. 210, 112-117 (2005).
- Drake, K., Wise, K., Farraye, J., Anderson, D., BeMent, S. Performance of planar multisite microprobes in recordingextracellular single-unit intracortical activity. IEEE Transactions on Biomedical Engineering. 35, 719-732 (1988).
- Liu, X., et al. Stability of the interface between neural tissue and chronically implanted intracortical microelectrodes. IEEE Trans. Rehab. Eng. 7, 315-326 (1999).
- Williams, J. C., Hippensteel, J. A., Dilgen, J., Shain, W., Kipke, D. R. Complex impedance spectroscopy for monitoring tissue responses to inserted neural implants. J. Neural Eng. 4, 410-423 (2007).
- Polikov, V., Tresco, P., Reichert, W. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).
- Szarowski, D. H., et al. Brain responses to micro-machined silicon devices. Brain Research. 983, 23-35 (2003).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. J. Neural Eng. 6, 056003 (2009).
- Holecko, M. M., Williams, J. C., Massia, S. P. Visualization of the intact interface between neural tissue and implanted microelectrode arrays. J. Neural Eng. 2, 97-102 (2005).
- Pierce, A. L., Sommakia, S., Rickus, J. L., Otto, K. J. Thin-film silica sol-gel coatings for neural microelectrodes. J. Neurosci. Methods. 180, 106-110 (2009).
- Wilks, S. Poly(3,4-ethylene dioxythiophene) (PEDOT) as a micro-neural interface material for electrostimulation. Frontiers in Neuroengineering. 2, (2009).
- Johnson, M. D., Otto, K. J., Kipke, D. R. Repeated voltage biasing improves unit recordings by reducing resistive tissue impedances. IEEE Trans Neural Syst. Rehabil. Eng. 13, 160-165 (2005).
- Otto, K. J., Johnson, M. D., Kipke, D. R. Voltage pulses change neural interface properties and improve unit recordings with chronically implanted microelectrodes. IEEE Trans. Biomed. Eng. 53, 333-340 (2006).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14, 1481-1488 (2011).
- Woolley, A. J., Desai, H. A., Steckbeck, M. A., Patel, N. K., Otto, K. J. In situ characterization of the brain-microdevice interface using Device Capture Histology. Journal of Neuroscience Methods. 201, 67-77 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep Tissue Fluorescent Imaging in Scattering Specimens Using Confocal Microscopy. Microscopy and Microanalysis. 17, 614-617 (2011).
- Wilks, S. J., Richner, T. J., Brodnick, S. K., Kipke, D. R., Williams, J. C., Otto, K. J. Voltage Biasing, Cyclic Voltammetry, & Electrical Impedance Spectroscopy for Neural Interfaces. J. Vis. Exp. (60), e3566 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved