このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
トライリーフレットポリマーバルブの相対的な流体力学的評価のためのプロトコル
要約
ポリマーバルブの開発に関心がリニューアルしました。ここでは、目的は、三尖形状を収容するために、近同一の条件下で収集されたネイティブおよび人工弁データと比較して、ポリマー弁流体力学的データを提示するためのプロトコルを定義するために商業的なパルスデュプリケータを変更することの実現可能性を実証することである。
要約
現在利用可能な人工弁、異種移植、および同種移植の制限はトライリーフレットポリマーバルブ補綴物の分野における開発の最近の復活を促した。しかしながら、ポリマー弁流体力学的機能の初期評価のためのプロトコルの識別は、設計プロセスの初期段階で非常に重要である。 インビトロパルス複写システムにおける伝統的な可撓三尖材料を収容するように構成されていない、加えて、ポリマー弁機能の評価は、同一の試験条件下でネイティブおよび人工心臓弁に対する文脈でなされる必要があるというように異なるからの測定値のばらつき器具を回避することができる。そこで、私の流体力学的評価を実施)ネイティブ(N = 4、直径、D = 20ミリメートルを意味する)、ii)の双方向リーフレットメカニカル(N = 2、D = 23㎜)及びiii)ポリマーバルブ(N = 5、市販のパルス複写システム(ViVitroラボの使用を介したD = 22㎜)トライリーフレットバルブジオメトリに対応するために変更された株式会社、ビクトリア、BC)。フロリダ大学で開発された三尖弁は、シリコーンポリマーバルブ基を含んでいた。水、グリセリン35:65の比率の混合物は、血液の物理的特性を模倣するために使用された。圧力が心室と大動脈の位置に記録しながら瞬時流量は、左心室と大動脈単位の界面で測定した。双リーフレット及び文献から自然弁データは、流量及び圧力測定値を検証するために使用した。次の流体力学的指標が報告された:順流圧力降下は、大動脈二乗フォワード流量、大動脈閉塞、漏れや逆流量、transaortic閉鎖、リーク、及び全エネルギー損失を意味する。代表的な結果は、3つの弁グループから流体力学的メトリックが正常に市販のパルス複写システムとsubsequentlに特注のアセンブリを組み込むことによって得られることが示されたyは、客観的にポリマーバルブ設計の機能的な側面についての洞察を提供することを比較した。
概要
心臓弁膜症は、多くの場合、退行性弁石灰化1、リウマチ熱2、心内膜炎3,4または先天性先天性欠損症に起因する。バルブの損傷は狭窄および/または逆流弁逸脱を引き起こし、外科的に修復することはできません、発生した場合、ネイティブバルブは通常、人工弁に置き換えられます。現在利用可能なオプションは、機械弁(ケージボールバルブ、傾斜ディスク弁、 等 )、同種移植、およびバイオ人工弁(ブタおよびウシバルブ)が含まれています。機械弁は、多くの場合、それらの耐久性に基づいて若い患者には推奨されていますが患者は5血栓性合併症を防ぐために、抗凝固療法に残るために必要です。同種移植片および生物人工弁は、血液薄く治療を避けるために有効な選択肢であったが、これらのバルブは、線維症リスクが高い、石灰化、変性、および弁の故障6に至る免疫原性合併症を有する。組織工学バルブが新たな技術7-9として調査が、はるかにはまだ明らかにされるように残っています。代替的耐久性、生体適合性、補綴弁は心臓弁膜症患者の生活の質を向上させるために必要とされる。再び、この弁の設計は、心臓弁疾患10と選択された患者の治療を変換するための可能性を示す塞栓アプローチで、経バルブ技術において使用されるプロテーゼを置き換えることができる。
現在の基準で述べたように、成功した心臓弁の代用には、次の性能特性を持っている必要があります "1)許容小さな平均圧力差ドロップフロー前進ができ、2)許容小さな逆流と逆流を防ぐ、3)塞栓に抵抗する、4)抵抗溶血; 5)血栓形成に抵抗; 6)生体適合性であり、7)生体内診断技術に互換性があり、8)目標に成果と植込み型です人口; 9)一度配置固定されたまま、10)許容ノイズ·レベルを持っている、11)再現可能な機能を持って、12)は、ジェネリッククラスと一致して、合理的な寿命のためにその機能を維持し、13)合理的な棚のためにその機能と無菌性を維持する移植前の生活。 "11。既存弁プロテーゼの欠点のいくつかは、潜在的にポリマー弁によって克服することができる。生体適合性ポリマーは、生体安定性、加水分解防止剤、抗酸化、などの有利な機械的特性に基づいて上位候補と考えられてきた高強度、粘弾性、特に、弾性ポリマーは、ネイティブ弁のダイナミクスに似た材料変形を提供することができる。エラストマーは、軟組織特性を模倣するように調整することができ、それらは生体トレラントであり、それが結合に耐えることができる利用可能な唯一の人工材料であってもよいin vivoで 、流体誘発性、曲げおよび引張応力は、まだ、健康に似た方法で移動ネイティブ弁運動。また、エラストマーは容易に格納され、様々なサイズで大量生産することができ、費用対効果の高いデバイスであると予想される、構造繊維強化材で補強することができる。
三尖弁を組み立てるための高分子材料の使用の概念は新しいものではなく、限られたバルブの耐久性のために、主に放棄された過去50年間12、上のいくつかの研究調査の対象となってきた。しかし、小説の製造方法13,14の出現で、高分子材料15,16と経カテーテルバルブ技術を有するポリマーバルブ代替の潜在シームレスな統合の強化は、最近になって潜在的にポリマーバルブの開発に新たな関心と活動があった現在市販バルブに実行可能な代案。この観点から、流体力学的機能を評価するためにこれらのバルブのテストを可能にするプロトコルが最初のステップである評価プロセスにおいて、まだ市販のパルスシミュレータシステムは、一般的に三尖弁の設計に対応するために装備してくると市販の心臓弁( 例えば傾斜ディスク、バイリーフレット人工心臓弁)を挿入するための環状の間隔が含まれていません。第二に、ポリマー弁は、その流体力学だけ相対コンテキストで評価することができる新たな技術である。天然の心臓弁の圧力および流量データが利用可能であっても、そのように考慮するための高分子バルブを評価するために使用されるのと同じ脈動シミュレータを用いて、ヒトバルブ生物学的に類似しているネイティブ大動脈ブタ弁のテストを実施することが重要であるシステムに依存するかもしれない測定の違い。したがって、本研究の目的は、市販のパルスシミュレータは三尖弁構造に対応するために、体系相対CONTにおけるポリマーバルブ流体力学的指標を評価するためにアセンブリを取り付けることができるかを実証することであった機械的およびネイティブブタ心臓弁の対応と比較してEXT。この例では、予めフロリダ13大学で開発された新規な三尖弁シリコーンポリマーは、ポリマー弁群を含んでいた。
プロトコル
1。準備
- トライリーフレットバルブ形状を収容するためにアセンブリを設計し、製造する。これは、少なくとも弁尖縫合糸での弁ホルダとパルス複写システムにアセンブリを固定するためにバルブホルダと周囲の付属品を収容するチューブを含むであろう。我々のケースでは、我々はViVitroラボ社(ビクトリア、BC)から入手できる市販のパルス複写システムを利用した。バルブホルダの設計と同様に前後アセンブリの構成は、図1に示されている。
- ループ全体は使用前にプライミングする必要があります。これには2つのステップが含まれます。ⅰ)使用前に任意の劣化チューブの交換及びii)ループに接続されている機器のキャリブレーション、すなわちポンプが使用されている、フロープローブを含む石鹸液と水を使用して、全体のループシステムの洗浄、および圧力変換器(一般的に心房、大動脈と心室の位置で測定)。キャリブレーションは、initをすることができますially 1%生理食塩水を用いて行うことが、血液アナロググリセリン溶液を使用する前に繰り返されるべきである。
2。ネイティブ大動脈弁の解剖
- USDA公認の虐殺家(機関動物実験委員会(IACUC)の承認が必要になることがあります)から、そのまま大動脈で4新鮮な豚の心を得る。我々のケースでは、我々の解剖プロトコルはフロリダ国際大学(:11から020プロトコル承認番号)でのIACUCによって承認された。脱イオン水で心をすすぎ、流体力学的試験所に氷の上に生理食塩水(PBS)溶液及び輸送をバッファリングされた1%の抗生物質/抗真菌剤、滅菌リン酸で満たされた容器に入れてください。
- 解剖鍋に心を置き、慎重に心膜を取り除く。腹側が手前になるように心を置きます。視覚的に検査し、心臓の4室を特定し、無傷の大動脈に大動脈弓を見つけます。
- TWに心を分離oは約0.75アニュラス下時に水平に横断することによって半分に、大動脈と左心室の間の接合部、すなわち 。慎重にまだ左心室組織セグメントに接続されているそのまま大動脈を分離。
- 全く損傷や石灰化の兆候がないことを保証する大動脈ルートにある大動脈弁、上行大動脈と下弁輪との間の領域を調べます。
- アニュラス上で〜1で大動脈を分割し、大動脈弁( 図2a)を分離するアニュラス下左心室組織セグメントを分離する。
3。ポリマーとネイティブバルブ縫合プロセス
- 各バルブのベースは、ポストホルダーのベースと揃うように、バルブホルダーの内側心臓弁を配置します。ペーパークリップで一時的に各ポストでの場所でバルブを固定しますが、交連または尖を損傷しないように注意してください。
- で縫合糸を挿入針。外側から針が簡単に下から引っ張られる可能性があることなどの内部に、最初の穴から針を通過させることによってバルブホルダーの底に縫合始まる。ルーピングファッションでは、バルブホルダーの支柱の上に垂直弁を縫合開始。
- ホルダーとホルダーポストの先端の周りに追加の縫合糸との安全の円周に沿って縫合(図2b)の進捗。バルブが完全に3ポストに、バルブホルダ( 図2dおよび2eの )の周囲で縫合糸を用いて固定されているときにクリップ( 図2c)を除去することができる。
4。流体力学的評価
注:実際のプロトコルが使用されている特定のパルス複写システムに応じて変化するであろう。すべての情報はここにViVitroパルスデュプリケータソフト仕様(ViVitroラボ社、バンクーバー、BC)使用caontained。
- バイリーフレットVALVE
- 70拍/分にパルス複写システムの心拍数を設定します。
- (ViVitroシステムの場合にはS35波形がすべての流体力学的試験のために選択した)ポンプを駆動するためのフロー波形を選択する。実験で使用される特定の波形は、リムら (2001)17によって示されている。
- アンプとピストンポンプの電源をオンにします。 15分間ウォームアップ。
- 大動脈の位置に置き、双リーフレットバルブ( 図2F)。
- 漏れが発生する可能性があり、デバイスのすべての接合にスミア真空グリース。
- 心房コンパートメントにグリセリン/生理食塩液を注ぐ。 35%/ 0.7 Lグリセリン、65%/食塩水1.3 L:拍複写システムはと液体の2 L上で実行されることに注意してください。食塩水9 mg / mlの(重量/体積)の濃度で脱イオン水によく溶解し、共通の塩を用いて調製される。
- 大動脈の位置に配置されたフロートランスデューサをオンにします。
- 番目のキャリブレーション電子ポンプ。
- 圧力トランスデューサ続いフロートランスデューサ校正に進みます。同様にポンプには、単純に、キャリブレーションタブの下にそれぞれの流量と圧力のためViVitestソフトウェア(ViVitroラボ株式会社)によって与えられた指示に従ってください。
- キャリブレーションが完了すると、流体が大動脈コンパートメントをいっぱいになるまで、低回転でポンプを起動します。漏れがないかチェックします。必要に応じて追加の真空グリースを使用してください。
- 2ストップコック(大動脈と心室トランスデューサ)の位置を開くために回します。
- ストローク量が80ミリリットル/ビートに達するまで、ポンプの回転数を増やします。
- 流れが安定するまで、システムが10分間実行することを許可します。フロー安定化は、画面に表示された流量と圧力の波形を観察することにより確認することができる。サイクル間に低なしバリエーションは、システム安定の良い指標である。
- ViVitestソフトウェアでモードを取得する]を選択します
- 10サイクルを収集]をクリックします。
- 分析モードから、Cテーブルの上になめて、ファイルを保存します。またViVitestで写真スナップオプションを使用して、波形の画像を保存します。
- ネイティブおよびポリマーバルブ
- 3.1.3双方向リーフレットバルブ命令から - ポリマーと動物のバルブについては、同じ手順3.1.1に従ってください。
- カスタムメイドのアセンブリからガラス管内部に縫合バルブとバルブホルダーを置きます。上部と下部の部分とサンドイッチ管と横ネジとナットで、所定の位置に固定します。
- 大動脈室とオリジナルの大動脈弁ホルダー間のアセンブリを配置します。
- 3.1.16双方向リーフレットバルブ命令から - ステップ3.1.5に進みます。
5。後処理
- 流量と圧力波形
- 平均波形を回収し、 すなわち動脈圧(AP)、心室圧(VP)、および流量(Q)毎に収集されたデータ。
- バルブの各グループ(ポリマー、ブタnについてative大動脈弁と双方向リーフレット)、同じプロットに対応するAP、VPとQ対時間の関係をプロットします。
- APの場合は、通常、ネイティブ大動脈弁18、および検証の目的のために文献から双方向リーフレット人工弁19プロットを重ねる。
- 流体力学的評価指標
- 試験した各バルブについては、以下の流体力学的なメトリックを計算する必要があります。)順流圧力降下と最大transvalvular圧(TVP)、b)の大動脈根が大動脈順流、クロージング、漏れ平方根(RMS)前方の流量、C)を意味と総逆流量、d)のバルブエンドオリフィス面積(EOA)、e)のtransaortic順流、クロージング、漏洩、総エネルギー損失。
- 順流の圧力降下はTVP測定値から計算され、3時間間隔、Pに分類することができます。順流とHとの間隔:間隔0 TVPで始まり、0流れで終わる0 TVP、Fから始まり、終わる間隔。最大TVPはmAです大動脈と心室圧の測定値からバルブ全体で記録ximum圧力勾配。
- RMSフォワード流量(Q 実効値 ) は次のように前方流量の大きさを定量化するための有用な指標を提供する。

'N'は、 'Q I'を集めた時点の合計数であるために、収集した瞬時流量測定は'i'です。 - 前方の大動脈、閉会と漏れボリュームはフォワード、次の時間間隔に基づいて計算されます:順方向の流れの最後にバルブを通る順方向の流れの先頭(T O)、(T 1);クロージング:T 1からインスタンスまでバルブ閉鎖(T 2)の、リーク電流:T 2からの心周期(T 3)の終わりまで。合計逆流量は単にCLOSの合計ですり、漏れボリューム。
- 血プロパティに基づいてEOAは20として、これらの各期間中の平均TVPから3時間間隔、P、FとHのために計算することができます:
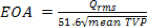
- エネルギー損失は、次の21のように定義されます。
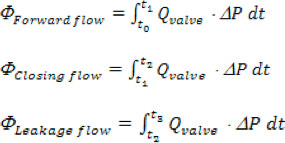
- 試験した各バルブについては、以下の流体力学的なメトリックを計算する必要があります。)順流圧力降下と最大transvalvular圧(TVP)、b)の大動脈根が大動脈順流、クロージング、漏れ平方根(RMS)前方の流量、C)を意味と総逆流量、d)のバルブエンドオリフィス面積(EOA)、e)のtransaortic順流、クロージング、漏洩、総エネルギー損失。
結果
代表的な流量と圧力波形は図3、図4および図5に示されている。プロットされた各グループのテストバルブのサンプルサイズで平均化され、nはそれぞれ= 5,4、およびポリマー、ネイティブブタと双方向リーフレットグループの2バルブ、。平均流体力学的メトリックおよびこれらのサンプルサイズの平均値の標準誤差を表1に示す。
ディスカッション
本研究では、ポリマーとネイティブブタ弁のその流体力学的試験を行うことができるように、三尖弁の形状を収容するために、市販の複写拍動部を変更することの有用性を実証した。具体的に我々の場合には、修正されたシステムはViVitro左心とViViTestデータ収集システム(ViVitroシステムズ、ビクトリア、BC、カナダ)を介して制御全身シミュレータシステム( 図1a)であった。?...
開示事項
著者らは、開示することは何もありません。
謝辞
フロリダ大学から種子助成 - 大学医学部は感謝して承諾されます。 NIH / NIGMS R25 GM061347:科学的な強化のための研究イニシアティブ(MBRを-RISE)フェローシップ - 大学院(マヌエル·サリナス)は生物医学研究プログラムの少数の機会を通じてサポートされていました。フロリダ国際大学の通じウォレスH.コールター財団、バイオメディカル技術部からの財政支援にも感謝して承諾されます。カマウ桟橋、マラキSuttle、ケンドール·アームストロングとアブラハムアルフォンソ:最後に、著者は、実験的なプロセスの様々な段階の間に彼らの支援のため、次の学生に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
参考文献
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved