Method Article
間葉転換を誘導し、上皮の分析
要約
簡単な方法は、種々の細胞型における間葉移行(EMT)上皮の誘導のために記載されている。免疫細胞化学によるEMT状態にある細胞の分析のための方法が含まれる。
要約
間葉移行(EMT)上皮は、開発中に、適切な形態形成に必須である。このプロセスの制御ミスは、線維症における重要な事象および転移性状態への癌の進行が示唆されている。 EMTを根底のプロセスを理解することは、早期診断とこれらの疾患状態の臨床的制御のために不可欠です。 in vitroでの EMTの確実な誘導は、診断目的のための一般的な遺伝子発現シグネチャを同定するために有用な薬物発見のためのツールとしてだけでなく、です。ここでは、種々の細胞型におけるEMTの誘導のための簡単な方法を実証する。細胞を免疫細胞化学による前後のEMT誘導の分析のための方法も含まれる。さらに、当社は抗体ベースのアレイ解析とマイグレーション/浸潤アッセイを使用してこの方法の有効性を示す。
概要
間葉移行(EMT)上皮は、偏光上皮細胞は非常に運動性、線維芽細胞様の間葉系細胞に生じる変化のさまざまなを受けるプロセスである。このプロセスは、移動し、侵入する能力の増大を生じる、遺伝子発現の変化および接着結合の分解によって、部分的には生じる。生理学的には、EMTは、胚発生および創傷治癒の際に重要な役割を果たしている。 EMT上の適切な制御の喪失は、線維症および癌の1,2の転移につながることができます。
上皮細胞の表面上のE-カドヘリンの減少は、EMT 3,4を通して細胞の進行における重要なステップである。 E-カドヘリンは、直接隣接細胞上のカドヘリンタンパク質と相互作用する一回膜貫通タンパク質である。細胞接着におけるその役割に加えて、E-カドヘリン、E-カドヘリンANの細胞質尾部の間の相互作用を介したシグナル伝達に影響を与える細胞調節タンパク質のDA品種、特にβ-カテニン。 β-カテニンは、接着結合の安定化に役割を果たしている。カノニカルWntシグナル伝達の際に、β-カテニンは、E-カドヘリンから解放され、それがWnt経路3,4,5の下流転写因子として機能する核に移行。核において、β-カテニンは、ツイスト、スラグ、フィブロネクチン、およびマトリックスメタロプロテアーゼ3,6様々なEMTを含むいくつかの関連因子の転写を増加させることが示された。
Wntのに加えて、TGF-βシグナル伝達は、正常な発達中および7,8,9疾患状態の両方においてEMT誘導に重要な役割を果たすことが示されている。 TGF-βは口蓋形成中および発達中の心臓10に発生したEMTに関与している。それはまた、線維症および転移7に癌の進行に関与している。
ここで説明する手順PRovides遺伝子操作を必要とすることなく、種々の細胞型におけるEMTの一貫した誘導。この手順では、E-カドヘリンのカクテルを使用して、SFRP-1、およびDkk-1遮断抗体およびWnt-5aおよびTGF-β1組換えタンパク質。このカクテルはWntおよびTGF-βのシグナル伝達を増強しながら、E-カドヘリンベースの付着をブロックするように設計されています。堅牢なEMT誘導のための能力は、このプロセスの生物学とどのように治療目的のためにそれを操作するを理解するために重要です。 EMT(EMTにダウンレギュレート)E-カドヘリンおよびビメンチン(EMTでアップレギュレート)の現在の一般的なマーカーは、癌で共発現されていますので、潜在的な転移性細胞12の最良の診断マーカーを提供していません。重要なことは、EMTを経験した様々な細胞型の分析は、癌および線維症11における診断目的のために使用することができる共通の遺伝子発現シグネチャーを開発するのに有用である。さらに、最近の研究は、EMTは、EMTを受けた細胞は、これらの細胞13を標的とすることができる化合物を同定するための薬物スクリーニングのために有用であり得ることを示唆し、癌幹細胞の形成において役割を果たし得る。
プロトコル
1。 EMTの誘導
- 水浴中で37℃まで暖かい培養培地。使用培地は興味のある細胞の標準培養に使用するメディアと同じです。例えば、A549ヒト肺癌細胞株を、10%ウシ胎児血清および2mMグルタミンを補充したF12 Kaighnの中で増殖される。
- 解離溶液( 例えばのTrypLEエクスプレス)を使用して、関心のある細胞を回収。
- 15ミリリットルコニカルチューブに予め温め培養培地中の細胞を一時停止します。
- 5分間400×gで細胞懸濁液を遠心分離する。
- 慎重に廃棄物容器に注ぐことにより、上清を除去します。
- 予め温めた培養培地中で細胞ペレットを一時停止します。
- トリパンブルーを用いて生細胞を数える。細胞懸濁液のサンプルを取り出して、0.4%トリパンブルー溶液中に希釈する。血球計数器に希釈した試料を10μlを配置し、生存細胞(青色にしない細胞)をカウントします。セルdを決定するために、細胞数を使用しソリューション内ensity。
- 組織培養プレート上に細胞を1cm 2当たり0.9〜1.0×10 4細胞でプレートまたはフラスコを治療した。 1X EMTを誘引培地添加物(100ミリメートルプレート当たり6ミリリットルメディア)を含む培地中で100mmのプレートに蒔い例えば、0.5×10 6個の細胞。
- 培養は、37℃/ 5%CO 2インキュベーター中で細胞を播種した。毎日の細胞形態を監視します。
- 三日めっき後、メディアを取り出し、1X、EMTを誘引培地添加物を含有する新鮮な予め温めた培養培地と交換してください。 37℃/ 5%CO 2インキュベーター内で培養を続ける。
- 五日めっき後、細胞を、分析のために準備ができている。細胞形態は、倒立光学顕微鏡によって可視化される。
2。免疫細胞化学によるタンパク質発現の解析
- 95%エタノールを含有するペトリ皿にカバースリップを置くことによって、24ウェルプレートのための無菌の12mmカバースリップを準備する。優しく私たちエタノールからカバースリップを削除針と湾曲したピンセットや火炎滅菌してING。 24ウェルプレートの1ウェルに無菌カバーガラスを配置します。残りのカバースリップを繰り返します。
- 1.7 - 1.1節で説明したように細胞懸濁液を準備します。
- プレート1.6×10 4細胞/ウェル0.5ミリリットル1X EMTを誘引培地添加物を含む予め温め培地中。
- 1.11 - のセクション1.9で説明したように細胞を培養して食べます。
- 五日めっき後、培地を除去し、室温で20分間、1×リン酸緩衝生理食塩水(PBS)中の300μl/ウェルの4%パラホルムアルデヒドで細胞を固定。
- 固定液を除去して、細胞が1×PBSで2回すすぎ、500μL/ウェル。
- ブロッキング緩衝液を400μl/ウェルで細胞をインキュベートし、室温で1時間(1%ウシ血清アルブミン(BSA)、10%正常ロバ血清、および0.3%トリトンX-100を含有する1×PBS)。
- 400μL/ウェル室TEMPERATURで3時間ブロッキングバッファーメーカー推奨濃度で一次抗体でインキュベートEまたは4℃で一晩直接蛍光色素にコンジュゲートした一次抗体を使用する場合は、暗闇の中でサンプルをインキュベートする。
- 各洗浄5分間、0.1%BSAを含む1×PBSを500μl/ウェルの細胞を3回洗浄します。直接蛍光色素にコンジュゲートした一次抗体を使用する場合は、2.12のステップに直接進む。
- 暗所で室温で1時間1%BSAを含む1×PBSを400μl/ウェルで、メーカーの推奨濃度で二次抗体で細胞を培養する。
- 各洗浄5分間、0.1%BSAを含む1×PBSを500μl/ウェルの細胞を3回洗浄します。
- 必要に応じて、DAPI溶液で核を対比染色。
- 脱イオン水で細胞を洗浄し、カバースリップをマウントメディアを使用してスライドに伏せてマウントします。
結果
。T98Gグリオブラストーマ細胞、HT29結腸腺癌細胞:ここで説明EMT誘導する培養条件は、種々の細胞型におけるEMTの誘導のためのロバストな方法を提供するA 1及びA 2は 4つの異なるヒト細胞株についての形態学およびマーカー発現レベルを実証する図 、A549肺癌細胞、およびMCF10A乳房上皮細胞。紡錘状の形態( 図1E - 1H)、間葉に- EMTを誘引培地添加物で処理した細胞は、古典的な上皮形態(1D図1A)から変更。 EMT誘導した細胞は、非誘導細胞と比較してタイトなコロニーにパックあまり密集して現れた。非誘導MCF10Aサンプルはより緩く詰まった細胞に囲まれた密集したクラスタを含んでいた。これらの密集したクラスタ( 図2D)E-カドヘリン陽性で、EMTを誘引メディア補遺での処理の際に姿を消したement( 図2H)。
EMTはまた、上皮マーカーおよび間葉マーカーのアップレギュレーションのダウンレギュレーションによって評価した。 E-カドヘリン発現のダウンレギュレーションは、一般的に異なる細胞型3,4内のEMTの誘導後に観察されている。図2は、未処理細胞の大部分では、E-カドヘリンの表面発現を示す( 図2A - 2D、赤)。その不在と比較した後にEMTの誘導( 図2E - 2H、赤)。 One細胞株T98Gは、従来の分析を妨げEMT誘導にE-カドヘリンの非常に低い基礎レベルを有することが見出された。間葉系マーカー、フィブロネクチンのアップレギュレーションは、EMTを誘引培地補充(;緑- - 2D図2Eに対して2H図2A)で誘導した後にも見ることができた。
E-カドヘリンおよびフィブロネクチンの発現レベルは、免疫細胞化学から見たさらに、全細胞溶解物のウェスタンブロッティング( 図3)を介して確認した。ウェスタンブロットは、E-カドヘリンおよび免疫細胞化学から見たフィブロネクチン発現のアップレギュレーションのダウンレギュレーションを確認した。バンドは、EMTの誘導後の相対倍数変化を決定するために、デンシトメトリーおよびGAPDHに正規化を使用して定量した。 E-カドヘリンレベルはそれぞれ、A549およびMCF10A細胞に6.4と3.4倍に減少した。フィブロネクチンのレベルは、それぞれ、4.1を4.6に増加し、2.3倍でT98G、A549、およびMCF10A細胞た。ウェスタンブロットは、ポストEMT誘導HT29細胞におけるE-カドヘリンタンパク質レベルの有意な低下を示していないが、免疫細胞の結果がで識別することができなくなる、E-カドヘリン(2Fに対して図2B)の表面発現の減少を実証全細胞溶解物のウェスタンブロット。
さらにEMTの状態、追加の既知のマーカーを評価するために、EMTのためのsが前後のEMT誘導を分析した。以前の結果と一致して、E-カドヘリンは、EMTを誘導したことを示す、調べた全ての細胞株において下方制御された。また、間葉系マーカーは、ビメンチンおよびカタツムリは、EMTを誘引培地添加物( 図4)で処理した後、A549、T98G、およびMCF10A細胞でアップレギュレートされた。 HT29細胞株は、これらの細胞がEMTの誘導のための代替経路を利用することを示すことができるEMT誘導(データは示さず)の有無にかかわらず、これらのいずれかの間葉系マーカーの発現を示さなかった。
TGF-βは、特定の細胞においてEMTを誘導するのに十分である7,8,9のコンテキストが、他の細胞型は、TGF-βの添加14のみに応答しない。 MCF7ヒト乳癌細胞およびPANC-1ヒト膵臓癌細胞は、両方のTGF-β単独14シグナル伝達に応答しないことが報告されている。両方のラインがvitrで EMTを受けることができるかどうかを判断するにはO、細胞がEMTを誘引メディアサプリメントの存在下で培養した。細胞は、EMTを誘引培地添加物内の濃度で、単独の組換えTGF-β1で刺激した。これらの細胞は、E-カドヘリンレベルは対照細胞( 図5Aおよび5Bに対して、図5Cおよび5D)に見られるものと同様であった密集した細胞のコロニー(データは示さず)および表面からなる、それらの上皮形態を保持していた。これとは対照的に、EMTを誘引培地添加物で刺激された細胞は、表面のE-カドヘリンのレベルの劇的な減少( 図5Eと5F)を示した。細胞がより少なく、よりコンパクトになり、紡錘状(データは示さず)、これらの細胞はまた、より多くの間葉形態を得た。これらの結果は、ここで説明する方法は、EMT誘導EMT形態およびTGF-β-iを代表的に耐性の細胞におけるマーカー発現の変化を促進することができることを実証nduced EMT。
マーカー発現の変化に加えて、間葉細胞の別の特徴は、移動し、侵入する能力である。とともに培養またはEMTを誘引培地補充なしで細胞の移動および浸潤は、製造業者の指示に従って、96ウェルBMEの細胞浸潤アッセイを用いて分析した。簡単に述べると、細胞を8.0ミクロンの細孔を有するフィルターインサートを含有する(50,000細胞/ウェル)を96ウェルプレートに播種した。 48時間後、遊走をフィルターを通して移動した細胞のAM染色をカルセインによって評価した。各サンプルは同様の結果で二回三重に試験した。一つの実験からの代表的結果を図6Aに示されている。細胞移動の統計学的に有意な増加(P値<0.003)がA549およびEMT誘導後PANC-1細胞の両方で見られた。 ( すなわち、細胞外マトリックスを通って移動)浸潤するこれらの細胞の能力を評価するために、同じアッセイであった基底膜抽出物でコーティングされたフィルターを用いて行った。 EMT-誘発された細胞は、 図6Bに示すように、未処理の細胞と比較して、浸潤能力において統計的に有意(P値<0.001)増加を示した。
EMTのロバストな誘導は、これらの細胞で起こる遺伝子発現の変化およびシグナリングの分析のために有用である。両方の処理および未処理細胞からの溶解物を用いた抗体ベースの配列解析は、単一のサンプル中の様々な分子の発現レベルを分析するための一つの方法である。例として、プロテオームプロファイラ人間ホスホ-MAPKアレイキットを使用した非誘導やEMT誘発性MCF7およびA549細胞由来の溶解物中のリン酸化MAPKファミリーのメンバーのレベルを分析した。配列は、同様の結果を独立したEMT誘導治療から2回実行されました。 図7は、1配列から代表的なデータを示しています。両方の細胞型は、CREB(S133)のリン酸化の増加を示し、ERK1(T2対照と比較して、EMT誘導細胞における02/Y204)、およびERK2(T185/Y187)。シグナル伝達事象における相違は、同様に2つの細胞型の間で観察された。 MCF7細胞は増加したp70S6K(T421/S424)リン酸化を示し、一方、A549細胞は、GSK-3β(S9)のリン酸化の増加を示した。
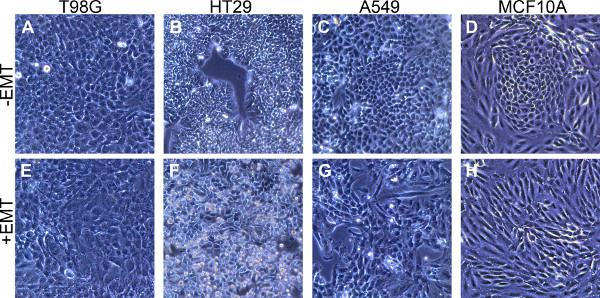
図1。 EMTを誘引培地添加物による刺激後の間葉の形態の誘導(A - D)。4の細胞型における上皮形態は、EMTを誘引培地添加物なしの標準培地中で5日間培養して、次の指示さ(E - H)での間葉モルフォロジー4つの細胞型は、5日間、EMTを誘引培地添加物とともに培養示した。
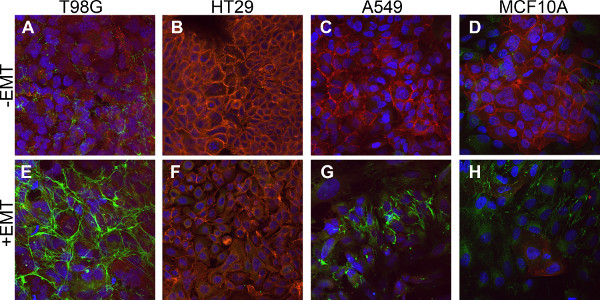
図2。上皮マーカーの発現とEMT誘導性細胞における間葉マーカー発現のアップレギュレーションのダウンレギュレーションは。細胞上皮マーカー、E-カドヘリン(赤)の発現を検出するための免疫蛍光法により染色し、間葉マーカーフィブロネクチン(緑色)。(A - D)5日間、EMTを誘引培地添加物なしで培養した対照細胞(E - H)5日間、EMTを誘引培地添加物で培養した細胞。すべての細胞をDAPI(青)で対比されています。
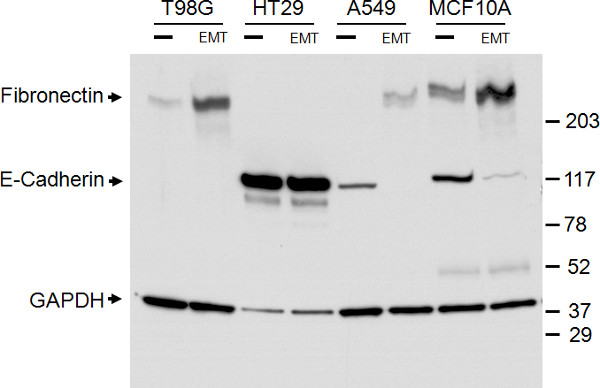
図3。ウェスタンブロットANと上皮および間葉マーカー発現の確認 ( - )5日間、EMTを誘引メディアサプリメント4つの細胞型の全細胞溶解物のウェスタンブロットalysis(EMT)の有無にかかわらず処理され、示された。左側に示されているように、E-カドヘリン、フィブロネクチン、およびGAPDHローディングコントロールのためのバンドがあります。右側に示されているようにサイズマーカーです。
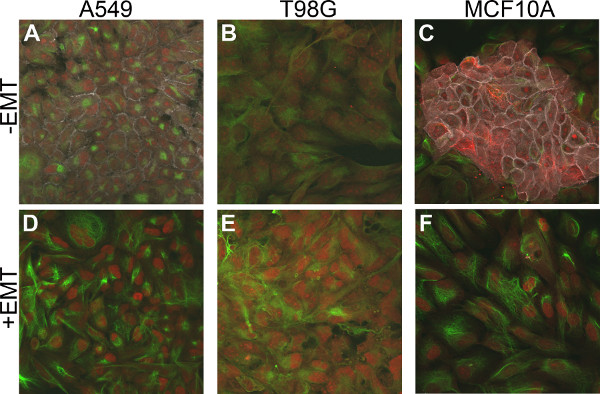
図4。間葉系マーカー、EMT誘導細胞におけるビメンチンとカタツムリのアップレギュレーションは。細胞は上皮マーカー、E-カドヘリン(グレー)の発現を検出するために、多色免疫蛍光法により染色し、間葉系マーカー、ビメンチン(緑)、かたつむり(赤) (A - C)5日間のEMTを誘引培地添加物なしで培養した対照細胞(D - F)5日間、EMTを誘引培地添加物で培養した細胞。
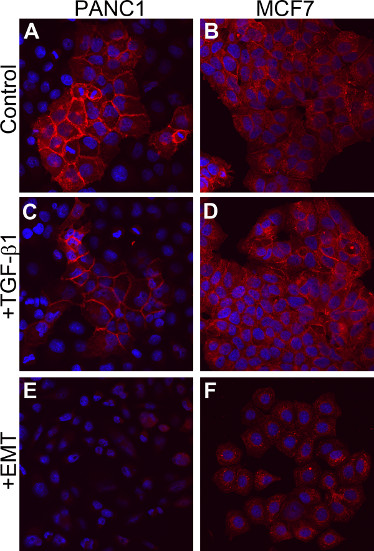
図5。 TGF-β1非応答性細胞におけるEMTの誘導。(AとB)5日間、培地単独で培養された細胞。(CとD)5日間のTGF-β1の10 ng / mlのを含む培地で培養された細胞。(E 5日間、EMTを誘引培地添加物で培養し、F)細胞。すべての細胞は、E-カドヘリン発現(赤色)について染色およびDAPI(青)で対比されています。
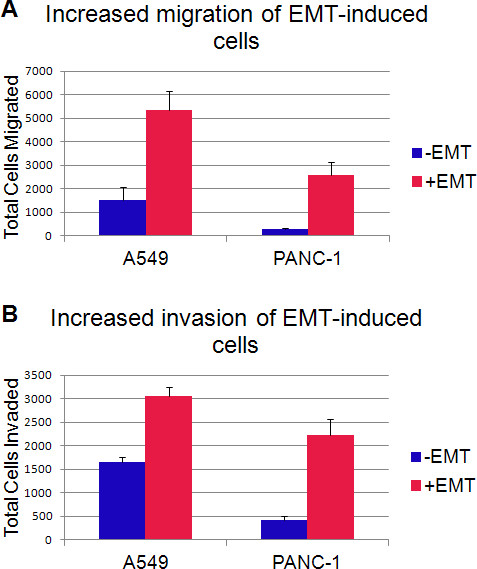
図6。 EMT誘導した細胞は、遊走および浸潤能力を増加している。48時間インキュベーション後に8ミクロンの孔のフィルターに通して移動した細胞のA.平均数。B.の平均数48時間のインキュベーション後に基底膜抽出物でコーティングされた8ミクロンの孔のフィルターに通して侵入することができました細胞。エラーバーは3ウェル以上の標準偏差を示す。
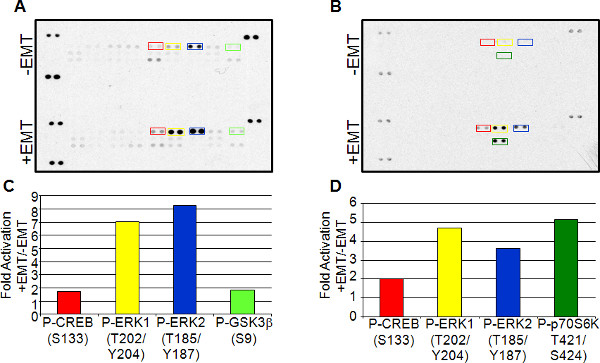
EMT誘導の図7。抗体ベースのアレイ発現解析。 EMTを誘引メディア補助の有無にかかわらず培養したA549(AおよびC)からの溶解物およびMCF7(BおよびD)細胞は、ヒトプロテオームプロファイラホスホ-MAPKアレイキットを使用してアレイ分析に使用した。スポットはAで強調表示し、Bはその後、デンシトメトリーを用いて定量した。非誘導するEMT-誘発される溶解物の比較は、(CとD)下記の対応するバーグラフに表示されます。 大きな画像を<見るにはここをクリックしてください/>。
ディスカッション
EMT誘導のための以前の方法は、一般に、TGF-β刺激または遺伝子改変を使用している。 TGF-β単独では、いくつかの細胞型においてEMTを誘導することが示されているが、現在ではTGF-βのEMTのために必要であるが、それはすべての細胞型6,14で十分でないことが実証されている。 EMT誘導のための遺伝的修飾を使用すると、時間がかかり、労働集約的である。ここで説明する方法を確実にEMTを誘導するために、抗ヒトE-カドヘリン、抗ヒトのsFRP-1、抗 - ヒトのDkk-1、組換えヒトのWnt-5aは、組換えヒトTGF-β1を含む要因の組合せを使用する。要因のこの組み合わせは、E-カドヘリンベースの付着をブロックするように設計されたEMT誘導4のための重要なステップ、およびWnt-5Aタンパク質の追加だけでなく、Wntシグナル阻害剤に対する遮断抗体を使用することにより、Wntシグナル伝達を強化、SFRP-1およびDkkさ-1。 WntおよびTGF-βシグナル伝達は間葉細胞スタットを誘導し、維持するために、自己分泌ループに作用することが示されているE 6。この誘導方法は、遺伝子操作を回避し、単独でTGF-βを使用するよりも効果的である。重要なことに、我々は以前に( 図5)14 TGF-β刺激にのみ応答しないことが示されているMCF7およびPANC-1細胞を含む、細胞タイプにおいてEMTの誘導を観察することができる。
EMTを誘引培地補充ショー少なくコンパクトで増加紡錘状の形態( 図1)で処理した細胞。さらに、EMT( 図2および3)の特徴であるフィブロネクチン発現の増加による表面E-カドヘリン発現の同時の減少がある。例えば、ビメンチン及びSnailのような追加の間葉マーカーはまた、非誘導対照と比較して、EMT誘発された細胞( 図4)においてアップレギュレートされている。増加遊走および浸潤能力は間葉細胞の主な機能特性である。 試験管内での遊走および浸潤アッセイは、EMTを誘引培地添加物で処理した細胞( 図6)を移行し、侵入する有意に増加した能力を示した。
図7に示す抗体アレイ発現データを用いて実証されるようにEMT誘導のためのこの単純な方法は、EMTシグナル伝達の研究のために有用である。異なる細胞型は、CREBリン酸化の増加およびMCF7及びA549 EMT誘導性細胞の両方で見られるERK1 / 2のようなEMTに関連する一般的な発現サインを得るために、前後のEMT誘導を比較することができる。 CREBのS133のリン酸化は、DNA結合を刺激し、TGF-β1によって誘導されるEMT 15の下流側に作用することが示されている。 ERK1 / 2リン酸化はまた、TGF-β1によって誘導されるEMT 16の下流側に作用することが示されている。 P70S6対A549細胞におけるGSK-3βのリン酸化の増加に見られるような細胞型の間のシグナル伝達経路の差異も明らかにすることができるMCF7におけるKのリン酸化。セリン9におけるGSK-3βのリン酸化は、それの機能を低下させ、GSK-3βは、プロEMT転写因子、カタツムリ17を阻害することが示されている。対照的に、p70S6Kのは、Snail活性を誘導し、そのリン酸化はこのタンパク質18の活性化と関連している。
全体的に、EMTの簡単で信頼性の高い誘導が、特に以前に、TGF-βのみに応答しないように示された細胞で、予後マーカーとして使用するための一般的な発現サインを特定、EMTの生物学を理解するために有用であり、癌の新規治療薬を開発し、評価するおよび線維性の疾患。
開示事項
R&Dシステムズ社は、営利、株式公開企業です。
この記事への生産とフリーアクセスは、R&Dシステムズ社が主催している
謝辞
著者らは、有用な議論や論文審査のためにジュリアHatlerとマーティンラムスデン(R&D Systems)を承認したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Epithelial cells of interest | We have tested: A431, A549, HT29, T98G, MCF10A, MCF7, and PANC1 | ||
| EMT Inducing Media Supplement | R&D Systems | CCM017 | |
| Recombinant Human TGF-β1 | R&D Systems | 240-B | Used at 10ng/ml |
| Anti-E-Cadherin NL557 conjugated antibody | R&D Systems | NL648R | Used at a 1:10 dilution for immunocytochemistry |
| Anti-E-Cadherin | R&D Systems | MAB1838 | Used at 0.1 μg/ml for western blotting |
| Anti-Fibronectin | R&D Systems | MAB1918 | Used at 10 μg/ml for immunocytochemistry; Used at 0.5 μg/ml for western blotting |
| Anti-GAPDH | R&D Systems | AF5718 | Used at 0.2 μg/ml for western blotting |
| Goat Anti-Mouse NL493 Secondary Antibody | R&D Systems | NL009 | Used at a 1:200 dilution for immunocytochemistry |
| Donkey Anti-Goat HRP Secondary Antibody | R&D Systems | HAF109 | Used at 1:2000 for western blotting |
| Goat Anti-Mouse HRP Secondary Antibody | R&D Systems | HAF007 | Used at 1:2000 for western blotting |
| EMT 3-Color Immunocytochemistry Kit | R&D Systems | SC026 | Used according to the manufacturer’s instructions. This kit contains directly conjugated antibodies against E-cadherin, Vimentin, and Snail. |
| 96 Well BME Cell Invasion Assay | R&D Systems | 3455-096-K | This kit was used according to the manufacturer's recommendations. |
| Proteome Profiler Human Phospho-MAPK Array Kit | R&D Systems | ARY002B | This kit was used according to the manufacturer's recommendations19. |
| Mounting Media | R&D Systems | CTS011 | |
| 0.4% Trypan Blue Solution | Life Technologies | 15350-061 | |
| 1X Phosphate Buffered Saline (PBS) | |||
| 95% Ethanol | |||
| Bovine Serum Albumin | Sigma | A3311 | |
| Normal Donkey Serum | Jackson Labs | 017-000-121 | |
| Triton-X-100 | Roche Molecular Biochemicals | 789-704 | Dilute in 1X PBS to make a 10% stock solution |
| Paraformaldehyde | Sigma | P6148 | Dilute in 1X PBS to a 4% working concentration. |
| DAPI Solution | Sigma | D9542 | Make stock solution at 14.3mM by dissolving in water. Working solution is a 1:5000 dilution of the stock solution in 1X PBS. |
| Fine pointed curved forceps | Thermo-Fisher Scientific | 08-875 | |
| 12 mm coverslips | Carolina Biological | 633009 | |
| Nonfat dry milk | Used at 5% in TBST for blocking in western blotting | ||
| TBST [25mM Tris, pH 7.4, 0.15M NaCl, 0.1% Tween 20] | For western blotting blocking and washing | ||
| PVDF Membrane | For western blotting | ||
| 4-20% SDS-page gel | For western blotting | ||
| ECL substrate | For western blotting | ||
| 15 ml conical tubes | |||
| Plates/flasks, tissue culture treated | |||
| 24-well plates, tissue culture treated | |||
| Pipettes / pipette tips | |||
| Pipet Aid / pipets | |||
| Hemocytometer | |||
| 37 °C Water Bath | |||
| 37 °C/5%CO2 Incubator | |||
| Centrifuge | |||
| Inverted light microscope | |||
| Fluorescence microscope |
参考文献
- Kalluri, R., Weinberg, R. A. The basics of epithelial-mesenchymal transition. Journal of Clinical Investigation. 119, 1420-1428 (2009).
- Thiery, J. P. Epithelial-mesenchymal transitions in tumour progression. Nature Reviews Cancer. 2, 442-454 (2002).
- Heuberger, J., Birchmeier, W. Interplay of cadherin-mediated cell adhesion and canonical Wnt signaling. Cold Spring Harbor Perspectives in Biology. 2, 1-23 (2010).
- Onder, T. T. Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways. Cancer Research. 68, 3645-3654 (2008).
- Tian, X. E-cadherin/β-catenin complex and the epithelial barrier. Journal of Biomedicine and Biotechnology. 2011, 1-6 (2011).
- Scheel, C. Paracrine and autocrine signals induce and maintain mesenchymal and stem cell states in the breast. Cell. 145, 926-940 (2011).
- Xu, J., Lamouille, S., Derynck, R. TGF-β-induced epithelial to mesenchymal transition. Cell Research. 19, 156-172 (2009).
- Kasai, H. TGF-β1 induces human alveolar epithelial to mesenchymal cell transition. EMT). Respiratory Research. 6, 56-70 (2005).
- Miettinen, P. J., et al. TGF-β induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. Journal of Cell Biology. 127, 2021-2036 (1994).
- Pelton, R. W., et al. Differential expression of genes encoding TGFs β1, β2, and β3 during murine palate formation. Dev. Biol. 141, 456-460 (1990).
- Taube, J. H. Core epithelial-to-mesenchymal transition interactome gene-expression signature is associated with claudin-low and metaplastic breast cancer subtypes. PNAS. 107, 15449-15454 (2010).
- Roussos, E. T., et al. AACR special conference on epithelial-mesenchymal transition and cancer progression and treatment. Cancer Research. 70, 7360-7364 (2010).
- Polyak, K., Weinberg, R. A. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nature Reviews Cancer. 9, 265-273 (2009).
- Brown, K. A. Induction by transforming growth factor-β1 of epithelial to mesenchymal transition is a rare event in vitro. Breast Cancer Research. 6, 215-231 (2004).
- De Falco, V., et al. CD44 proteolysis increases CREB phosphorylation and sustains proliferation of thyroid cancer cells. Cancer Research. 72, 1449-1458 (2012).
- Xie, L. Activation of the Erk pathway is required for TGF-β1-induced EMT in vitro. Neoplasia. 6, 603-610 (2004).
- Bachelder, R. E., et al. Glycogen synthase kinase-3 is an endogenous inhibitor of Snail transcription: implication for the epithelial-mesenchymal transition. Journal of Cell Biology. 168, 29-33 (2005).
- Pon, Y. L. p70 S6 kinase promotes epithelial to mesenchymal transition through Snail induction in ovarian cancer cells. Cancer Research. 68, 6524-6532 (2008).
- Wegner, G. J., et al. Profiling changes in receptor tyrosine kinase phosphorylation using antibody arrays. J. Vis. Exp. , (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved