このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
チップ上でのストレス誘発抗生物質感受性試験
要約
我々は、迅速な抗生物質感受性試験のためのマイクロ流体プラットフォームを開発した。液体はマイクロ流体チャネルの底に固定化された細菌の上に高速で渡される。ストレスと抗生物質の存在下では、細菌の影響を受けやすい株は急速に死ぬ。しかし、耐性菌は、これらのストレスの多い条件を生き残ることができます。
要約
ストレスベースの環境下での抗生物質感受性試験のための迅速な微小流体法を開発しました。液体はマイクロ流体チャネルの底に固定化された細菌の上に高速で渡される。ストレスと抗生物質の存在下では、細菌の影響を受けやすい株は急速に死ぬ。しかし、耐性菌は、これらのストレスの多い条件を生き残ります。この方法の背後にある仮説は新しいです:抗生物質の標的である生化学的経路のストレス活性化は、抗生物質感受性検査を加速することができます。標準的な抗生物質感受性試験方法と比較して、抗生物質の適用中に、速度制限ステップ(細菌増殖)は省略される。この方法の技術的実装は、標準的な手法と革新的なアプローチの組み合わせです。この方法の標準的な部分には、細菌培養プロトコル、ポリジメチルシロキサン(PDMS)におけるマイクロ流体チャネルの定義、蛍光による細胞生存率モニタリング、細菌カウント用のバッチ画像処理が含まれる。この方法の革新的な部分は、機械的ストレスアプリケーションのための培養培地フローの使用、細菌を損傷するが殺さない酵素の使用、細菌の付着のためのマイクロアレイ基質の使用にある。開発されたプラットフォームは、抗生物質および非抗生物質関連の医薬品開発および試験に使用することができます。標準的な細菌懸濁液実験と比較して、薬物の効果は、制御された期間にわたって繰り返しオンとオフを切り上げることができる。同じ実験の過程で同じ細菌集団の反復観察が可能である。
概要
細菌耐性の上昇は、最後の手段の私たちの薬を保護するために、速い表現型ベースの抗生物質感受性テストの必要性を強化します。標準的な感受性テストは、完了するまでに複数の(8-24)時間を要する抗生物質の存在下での細菌増殖阻害に基づいている。我々は、抗生物質の作用を加速するために生合成経路のストレス活性化に依存する微小流体プラットフォーム上で新しい抗生物質感受性試験を開発した。
マイクロ流体スケールでの抗生物質感受性試験は、少数の細菌を必要とするため、効果的なサンプル使用の利点を運びます。さらに、マイクロ流体デバイスは、複数の条件1,2の下で複数のサンプルをテストするために多重化することができます。最近、抗生物質感受性検査のための微小流体法の数が報告されている3-9.これらの方法では、細菌はナノおよびピコリットル液滴3,7の内部で増殖し、マイクロ流体チャネル4〜6、8の全容で、またはチャネル9の底面に電気的に局在する単一細菌として増殖する。これらの検査はマイクロ流体チャネルで行われますが、それらはすべて従来の方法と同様の抗生物質の存在と不在で微生物の成長を監視します。成長の測定は光学密度、pH敏感な色素、または明るい視野/位相のコントラストまたは蛍光のイメージ を介して 取られる。これらの検査のいくつかは従来の方法よりも速いが、それらはそれぞれ受動的に抗生物質耐性を検出する。言い換えれば、これらの方法は、最終的な読み出しとして細菌の増殖を待つ必要があります。
対照的に、我々は、抗生物質感受性生化学的経路10を活性化するためにせん断と酵素ストレスの組み合わせを使用する方法を開発した。これらの抗生物質でストレスを受けた細菌に挑戦することは、より迅速な感受性テストを作成します。抗生物質に耐性のある細菌は、ストレスの多い状態に耐えることができます。一方、影響を受けやすい細菌は、複合ストレスによって急速に殺される。1時間後の細胞死の割合は、蛍光死細胞染色を用いた顕微鏡で測定し、細菌の表現型(耐性対感受性)を定義する。
我々の方法の成功の実現のためには、細菌はマイクロ流体チャネルの底面に固定化されなければならない。このようにして、細菌は様々なストレスを受け、同時に単一の平面で顕微鏡下で画像化することができる。コーティングされた顕微鏡のガラススライドは細菌の固定化のために使用される。スライドは非特異性タンパク質結合のためのエポキシド基を製造業者によって前塗りされる。これらのエポキシドの細菌表面タンパク質への非特異的結合は、共有結合してバクテリアをスライド表面に結合させる。
株は、抗生物質の不在(対照)および存在(実験)において同一の条件(せん断+酵素ストレス)下で試験される。各チャネルの位相コントラストおよび蛍光顕微鏡写真は、1時間毎に2分ごとに自動的に撮影される。次に、実験チャネル内の死んだ細菌の割合を制御チャネルに存在するものと比較することによって、抵抗の指定が行われます。1時間後、細胞死率が1%を超えるサンプルは感受性とみなされ、0.5%未満の死亡は抵抗性を示す。これら 2 つのカットオフの間に含まれる割合は不確定と見なされ、サンプルを再度テストする必要があります。
マイクロ流体チャネルはPDMSで定義されており、これはマイクロ流体デバイス11に適した材料である。PDMSは広範囲の波長で光学的に透明であり、生体適合性、不活性、ガスに対する透過性、および液体への透過性が低い。したがって、これらの実験に適しています。
機械的/せん断応力は、固定化された細菌の上に室温メディアの流れによって作成されます。(注:メディアを37°Cに温めるのは、アッセイの結果に大きな影響を与えならない。自動シリンジポンプは、マイクロ流体チャネル(200 μm x 400 μm)を通してマイクロ流体チャネル(200 μm x 400 μm)を介して培地(死細胞染色+/- 抗生物質を含む)を強制的に、6.25kPaのせん断力または剪断速度6,000秒-1を与える。この速度は、以前に研究した ブドウ球菌のせん断応力と等しいかそれを超えています。
この酵素は、リソスタフィンが、 ブドウ球菌 細胞壁に直接損傷を与えるため、予備実験のために選択された。リソスタフィン(0.7 ng/ml)の濃度は、細菌細胞壁損傷を引き起こすのに十分であったが、実験の時間枠で抗生物質なしで細菌細胞死を引き起こすには十分ではなかった。リソスタフィンは、細菌感受性の正しい指定のために必要とされないが、それは結果を増強し、感受性株における細胞死の増加につながる。対照的に、せん断応力はアッセイ機能にとって重要です。メチシリン感受性 黄色ブドウ球菌 株が流れがない場合にリソスタフィンとオキサシリンで治療すると、実験の過程で細胞死は記録されません。
細胞生存率は、蛍光死細胞染色12で監視される。色素の選択は、損傷した細胞のみを選択的に染色する能力、生きた細胞に対する非毒性、およびバックグラウンドの低い蛍光に基づいており、追加のステップなしで細胞培地に直接添加することができた。0.25μMの蛍光色素濃度の選択は、蛍光励起光への1.6秒の曝露時間中に許容可能なシグナルレベルを達成することであった。
β-ラクタム, オキサシリン, 私たちの予備研究で使用されました。.メチシリン耐性 S.アウレウス (MRSA)種はオキサシリンに耐性があり、実験の時間枠でかなりの細胞死を示さない。50μg/mlの濃度は予備研究で決定した。抗生物質の濃度が低いほど耐性株と感受性株の分離が少なかったが、高濃度は実験的結果に大きな違いを生じなかった。
我々は以前、細菌細胞壁13 に直接影響を及ぼす機械的および酵素的ストレスと、細胞壁生合成を阻害する抗生物質を組み合わせた試験の成功した開発について報告した。これらの原理実証実験は、MRSAおよびメチシリン感受性 S.アウレウス (MSSA)のパネルで行われた。しかし、適切な実験パラメータの選択により、我々の方法は、細菌の複数の種と抗生物質の複数のクラスに適用可能であるべきです。
プロトコル
1. PDMS レイヤを作成する(図1)
- PDMSと硬化剤を10:1比で激しく混合する。気泡を除去するには、真空チャンバー内の粘性混合物を室温で1時間脱気する。
- スケールで、アルミニウムモールドの上にゆっくりとPDMSを注ぎます。中央から注ぎ、金型を平準化してください。ピンを隠したままにしてください。目標重量が達成されたら、注ぎ込み停止します。
当社の金型は、PDMSの4 gと硬化試薬の0.4 gを必要とします。 - オーブン内の金型を平準化し、一晩で37°Cで硬化します。
代替硬化時間は、60°Cで2時間、または90°Cで1時間である。 - 金型の端に沿って硬化したPDMS層を解剖し、一対の鉗子で鋳型表面から慎重に剥がします。70%エタノールとQチップで金型表面を洗浄します。
2. 図2に従ってフローセルを組み立てる
ガラススライド付きPDMSの標準アセンブリは、PDMSと顕微鏡ガラススライド間のリークフリー結合を保証する両方の表面の酸素プラズマ処理によって行われます。提示されたプロトコルでは、プラズマ処理はガラススライド上の化学コーティングを破壊するであろう。そのため、スライドはプラズマ処理ではなく圧力密閉されています。
- フローセルポケットにガラス窓を置きます。
- コーティングされたガラススライドをフローセルのポケットの内側にスライドさせ、その上にチャネルを下に向けて配置します。PDMS スライドを、チャンネル入力が金属板のスルーホールに合うように配置します。層の間から空気をそっと押し出します。
- PDMS がガラス窓に向かるように PDMS/ガラス スライド アセンブリを反転します。PDMS チャンネル入力を金属板のスルーホールと重ね合たします。
- 圧力プレートを上に置き、ネジを締めます。
- 組み立てたフローセルを顕微鏡の下に置きます。顕微鏡の倍率を60倍に設定し、チャンネル位置を事前に調整します。
3. ログフェーズ細菌の準備
- 実験の前日:細菌コロニーを有する2%NaCl(MH2)を含むミューラーヒントンスープの50mlを接種する。37°Cで一晩250rpmで振る。
1つまたは2つの細菌株は、記載されたセットアップのための1つの実験で研究することができる。 - 実験前: MH2培地の50 mlに一晩細菌培養50 μlを混合します。細菌が対数相であることを確認するために、37°Cで3時間250 rpmで振ります。
4. 実験液コンポーネントが必要になる前に少なくとも10分温める
- 蛍光色素(5mMストック)とリソスタフィン(10μg/mlストック)を室温で解凍します。
- オキサシリン粉末を室温まで温めます。
5. 細菌懸濁液の準備とロード
- 3時間のサブカルチャーの終了後:10mlの細菌培養と遠心分離機を1,650 x gで2分間服用します。
- 上清を取り除き、新鮮なMH2培地の1mlで細菌を再懸濁します。
- 1 ml ルアー ロック シリンジに短い長さのチューブを取り付けます。1 ml のメディアでシリンジチューブを洗い流します。細菌の懸濁液に引き込むときに気泡を避けるために、チューブに少しメディアを残します。
- 0.7mlの細菌タイプ1を注射器に浸します。フローセルの2つのチャネルを細菌タイプ1で満たします。 caの後にチャネルの反対側に液体が表示されるのを見てください。150 μl。
チャネルの透明度は、細菌で満たされると変化します。 - 複数の細菌タイプを実験する場合は、細菌タイプ2の負荷手順をフローセルの残りの2つのチャネルに繰り返します。
- 37 °Cで37°Cのフローセルを45分間置き、スライド表面に細菌の沈降と付着を可能にします。
6. 実験ソリューションの準備と読み込み
- 14 μlの蛍光色素ストック(5 mM)と126 μlのMH2メディアを混合して、0.5 mM蛍光色素溶液を140 μl用意します。
- 40mlのMH2培地で10mgのオキサシリンを希釈し、250μg/mlオキサシリンの最終濃度を得る。
- 0.25 μM蛍光色素と0.7 ng/mlのリソスタフィンの最終濃度で130mlの制御溶液を調製します。これを行うには、65 μlの蛍光色素(0.5 mM)、9.12 μlのリソスタフィンストック(10 μg/ml)、130 mlのMH2培地を混合します。
- 0.25 μM蛍光色素、0.7 ng/mlのリソスタフィン、50 μg/ml オキサシリンの最終濃度で130 mlの抗生物質溶液を調製します。これを行うには、65 μlの蛍光色素(0.5 mM)、9.12 μlのリソスタフィンストック(10 μg/ml)、オキサシリン26ml(250μg/ml)、MH2培地104mlを混合します。
- 2つの60 mlシリンジをコントロール溶液で満たし、60ml注射器2個を抗生物質溶液で充填します。試薬の光による劣化を避けるために、溶液をアルミホイルで包み込みます。
チューブのフラッシュによる損失を考慮して、注射器をオーバーフィルします。 - フリックして、シリンジから気泡を取り除く。入力チューブをテストソリューションでチップに取り付けて埋めます。
- ポンプにスポイトを取り付ける。最初に最小ボリュームのシリンジを置き、プランジャーの位置をロックします。残りのシリンジをポンプに取り付け、必要に応じてプランジャーを絞ります。
- ポンプ速度を1 ml/minに、ポンプの体積を60 mlに設定します。すべての注射器から液体の安定した流れが見えるまで、ポンプでフラッシュを行います。
7. 顕微鏡下にフローセルを設置する
- 遠心分離機からフローセルを取り出し、顕微鏡のステージに取り付ける(図3)。
- 各フローセルチャンネル(チャンネルごとに1つの入力/1出力)に入出力チューブを接続します。
出力を 4 つの異なるコンテナーに集めることで、個々のチャンネル出力ボリュームを測定できます。
8. 60分の実験を実行する
- ステップ 2.5 から事前に配置された位置を確認します。顕微鏡の視野がチャネルの中心になっていない場合や、焦点が合っていない場合は、設定を調整して新しい位置を保存します。
負荷の多い細菌の密度が高いため、流動開始前に正確な焦点合わせができない場合があります。 - 位相コントラスト取得時間を10ミリ秒、蛍光集録時間を1,600ミリ秒に設定します。
- フローを開始する前に、各位置の位相コントラストと蛍光画像を取得します。
これは、ロードされた細菌密度の定性的な推定値を与えます。 - 液体の流れを開始し、顕微鏡がチャネルの底部に焦点を合わせているか確認してください。
- フローの最初の1分以内にターゲット領域の位相コントラストと蛍光画像を撮ります。
- フローの60分まで画像の最初のセットの後に2分ごとに画像を取得します。必要に応じて再フォーカスします。
9. フローセルの消毒
- ビーカー(100ml)で10%漂白液を作ります。4 x 20 ml の注射器を 10 ml の混合物で充填します。シリンジをデバブルし、フローセルに取り付けます。
チャネルが細菌を取り除くのに約1〜2分かかります。 - ポンプ速度を1 ml/minに、ポンプの体積を3 mlに設定します。3分間走ります。
- 4 x 60 ml のシリンジに 60 ml の DI 水を入れます。シリンジをデバブルし、フローセルに取り付けます。
- ポンプ速度を1 ml/minに、ポンプの体積を30 mlに設定します。30分間走ります。
- マイクロスコープ下でのチャネルクリーニングを監視します。
- フローセルを分解します。使用したエポキシスライドを破棄します。フローセル成分をDI水に20分間浸漬し、エアドライにします。
10. 画像の分析とデータの生成
- 各画像の細菌数を数えます。
オープンアクセスソフトウェアは、CellProfilerは、バッチ画像処理16を実行するために使用されます。CellProfiler ルーチンの概要を表 1 にまとめて います。位相コントラスト画像(Np)に存在する細菌の数は、総細菌数を示す。蛍光画像(Nf)に見える細菌の数は、死んだ細菌の数を示します。 - 正規化された細菌細胞死率を時間の関数として計算する。
- 個々の画像の Nf および Np をデータ分析ソフトウェアにインポートします。
- t = Tの分数(Nf/N p)で与えられた特定の時点で、各チャネルの死んだ細菌の割合を計算する。
- 実験の最初に存在する死んだ細菌の割合(t = 1分)を、制御と実験チャネルの両方に差し引く。
- 制御チャネルに存在する死んだ細菌の割合を、次の式で各時点の実験チャネルに存在する細菌から差し引きます。
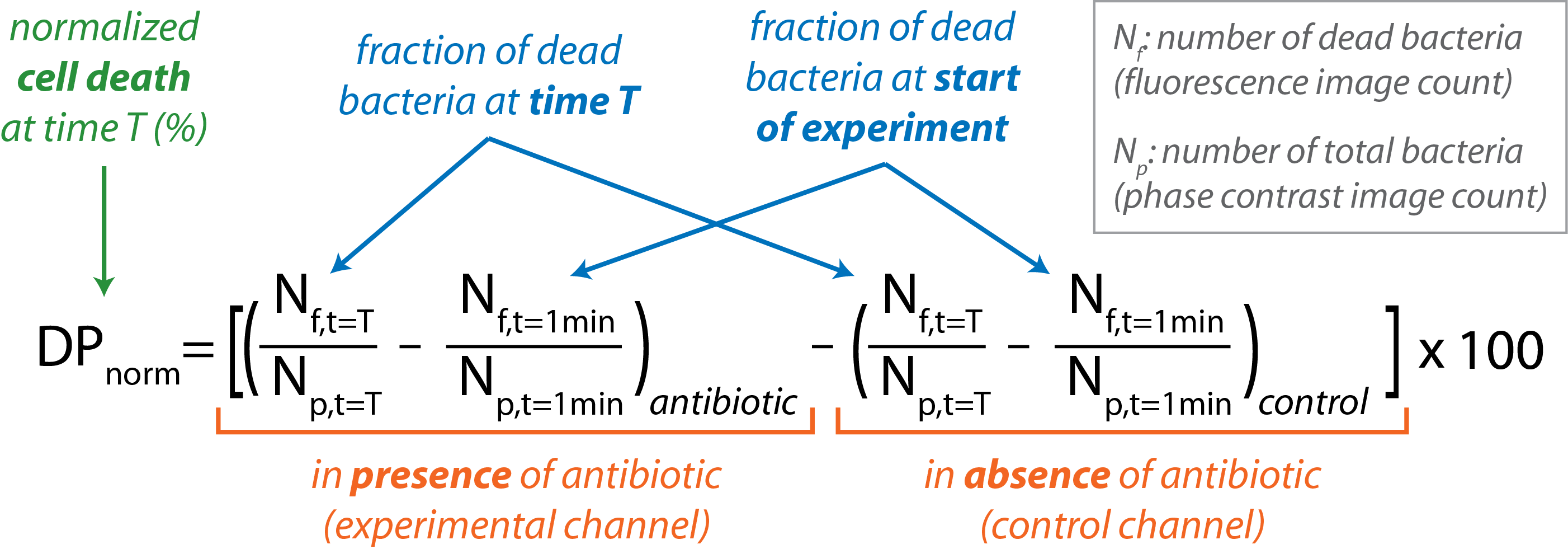
- 実験の過程で DPノルム 対 t をグラフ化します。
細胞死率が1%を超えるサンプルは感受性が高いと見なされ、0.5%未満の死亡は抵抗性を示す。これら 2 つのカットオフの間に含まれる割合は不確定と見なされ、サンプルを再度テストする必要があります。 - スプレッドシートを使用して、さまざまな実験の結果を要約および分析します。
結果
図4に示すデータは、抗生物質含有微小流体チャネルにおける経時の影響を受けやすい黄色ブドウ球菌株の応答を示す。1分および1時間実験の最後に取得した位相コントラスト画像を図4AおよびBに示す。分析された1時間のデータは、赤色で強調表示された細菌(合計5,828)で図4Cに示されています。対応する蛍光画像を図4D
ディスカッション
提示されたプロトコルは、メチシリン感受性およびメチシリン耐性 黄色ブドウ球 菌株10を用いた一連の実験において検証され、最適化された。したがって、このプロトコルは、細菌細胞壁生合成に影響を与える作用のメカニズムを有する S.アウレウス および他の抗生物質の他の株に直接適用されるべきである。 S.アウレウス以外の細菌タイプは、可溶性(酵素)お?...
開示事項
マイクロ流体法は特許出願中です:ザウアー・バッジA、シャロンA、カラシニコフM、ウィルツH、発明者;細菌抗生物質耐性/感受性特許PCT/US10/33523の迅速な検出のための方法および装置。
謝辞
フラウンホーファー製造イノベーションセンターのエンジニアと学生に感謝します。実験システムの設計、加工、自動化を支援するために、アンドレアス・プリンツェン、ホルガー・ヴィルツ、ダグ・フォス、デビッド・チャーギン、そしてスドン・シュー博士に感謝します。ジュリア・クッカーツ、メラニー・ツィンマーマン、ニコ・クレッツマー、ティム・ガンベル、ジョシュ・ビジャヌエバ、清水実、カタジナ・クリガの実験に関する研究に感謝します。私たちは、ハーバード大学ブロード研究所のイメージングプラットフォームのアン・E・カーペンター博士とマーク・アンソニー・ブレイ博士が、CellProfilerの画像分析ルーチンの開発に協力していることを認めます。このプロジェクトは、国立アレルギー・感染症研究所のR21AI079474および1R01AI101446の賞によって部分的に支援されました。コンテンツは著者の責任であり、必ずしも国立アレルギー・感染症研究所または国立衛生研究所の公式見解を表すものではありません。プロジェクトはフラウンホーファーUSAによってもサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
参考文献
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved