Method Article
生分解性高分子粒子のリンパ節内注入
要約
リンパ節は免疫応答を調整する免疫組織であり、ワクチンの重要な標的です。バイオマテリアルは、より良いリンパ節を標的とし、抗原またはアジュバントの送達を制御するために採用されてきた。本論文では、これらのアイデアを組み合わせて、生体適合性ポリマー粒子をリンパ節に注入する技術について述べる。
要約
適応免疫応答の生成は、Tリンパ球およびBリンパ球に対するこれらの外来分子の処理および提示のために、リンパ節への抗原の効率的な排出または密売に依存する。リンパ節は、新しいワクチンや免疫療法の重要な標的となっています。これらの組織を標的とする最近の戦略は、可溶性ワクチン成分の直接リンパ節注射であり、この技術を含む臨床試験が有望であった。また、生体物質ワクチン粒子の最適な排水のために粒子径を調整するなど、リンパ節の標的化を改善するためのいくつかの生体材料戦略も検討されている。本論文では、直接リンパ節注射と、抗原、アジュバント、その他のワクチン成分を含む生分解性ポリマー粒子を組み合わせた新しい方法を紹介する。この方法では、高分子微粒子またはナノ粒子は、脂質安定剤を組み込んだ改変二重エマルジョンプロトコルによって合成される。粒子特性(サイズ、貨物負荷など)は、それぞれレーザー回折と蛍光顕微鏡検査によって確認されます。マウスリンパ節は、標的注射部位の可視化及びリンパ節におけるポリマー粒子の後の沈着を可能にする無毒なトレーサー色素の末梢注入によって同定される。この技術は、リンパ節に送達される生体材料およびワクチン成分の用量および組み合わせを直接制御することを可能にし、新しい生体材料ベースのワクチンの開発に利用することができる。
概要
リンパ節(LN)は免疫系の指令センターである。この免疫学的部位において、抗原提示細胞は、特異的な外来抗原に対して素朴なナイーブリンパ球をプライムし、細胞および体液性免疫応答を活性化する。したがって、LNはワクチンや免疫療法の提供の魅力的な標的となっています。残念ながら、ほとんどのワクチン戦略は、抗原およびアジュバントをリンパ組織1に非効率的で一時的に送達する結果となる。したがって、新しいワクチンの効力と効率に大きな影響を与える可能性があります。
新たな臨床試験に大きな関心を示したLNターゲティングの課題を回避するための1つの戦略は、直接、LN内(i.LN.)注射2-4である。これらの試験は、単純な外来処置としてワクチンをRNに送達するために超音波ガイダンスを採用した。従来の末梢注射経路と比較して、このアプローチは、アレルギーおよび癌を含む治療コンテキストにおける有意な用量節約および改善された有効性をもたらした 2-4.これらの 研究は、 リンパドレナージによって急速にクリアされた可溶性ワクチン(すなわち生体物質フリー)の注射を用いた。したがって、複数の注射または複数の注射のサイクル-これらの印象的な治療効果を達成するために投与された。LNの保持性の向上は、抗原および/またはアジュバントおよび免疫細胞との相互作用を高め、免疫細胞プライミングの効力をさらに向上させる可能性がある。この電位は、抗原の運動学およびアジュバント送達が生成した特異的免疫応答を決定する上で重要な役割を果たしていることを示す最近の研究によって支持される。さらに、薬物およびワクチンの用量を局所化および最小化することは、慢性炎症などの全身的な影響を減少または排除することができる。
バイオマテリアルはワクチンの効力と効率を高めるために広範囲に研究されてきた1,8,9 .生体材料キャリアにカプセル化または吸着することで、貨物を劣化から物理的に保護し、溶解性の制限を克服することができます。ポリマーマイクロまたはナノ粒子などの生体材料キャリアのもう一つの顕著な特徴は、いくつかのクラスの貨物を共存させ、その後、制御された間隔でこれらの貨物を放出する能力である。しかし、 生体内で生体物質ワクチンや免疫療法を妨げ続けている重要な制限は、免疫細胞の非効率的な標的化とリンパ節への限られた人身売買である。例えば、従来の経路を介した生体材料ワクチンの末梢注射(例えば皮内、筋肉内)は、典型的には、不十分なLN標的化を示し、注射部位に残存する注入物質の最大99%を4,10に残す。さらに最近では、生体物質ワクチン担体の大きさは、これらのワクチンの間質流8,10を介してLNへの優遇的人身売買または排水を改善するように調整されている。これらの進歩は、細胞および体液性免疫応答の強化につながり、新しいワクチンのLN環境を標的化し、エンジニアリングすることの重要性を強調している。
本論文は、脂質安定化ポリマー粒子とi.LN.送達を組み合わせて制御放出ワクチンデポ5,11を生成するワクチン接種プロトコルを提示する。i.LNのための外科技術を採用した最近の研究に基づいて構築する.マウス6,7,12,13では、小動物に生体物質ワクチンを注射するための迅速で非外科的な戦略を開発した5。i.LN.送達と生体物質ワクチン担体を組み合わせることで、制御放出ワクチンデポ5の単回注射後7日以内にCD8 T細胞応答が強力に強化された。強い体液性応答(すなわち抗体力剤)も生成された。両方の機能強化は、生体物質担体からの制御放出によって媒介されたリンパ節におけるワクチン成分の保持性の増加に関連していた。興味深いことに、ワクチン粒子の大きさは、これらの物質の運命を一度LNsに変えた:ナノスケール粒子は細胞による直接取り込みの高まりを示し、一方で、より大きな微粒子は細胞外LN環境に残り、LN常駐抗原提示細胞5によって取り込まれた貨物(例えばアジュバント)を放出した。これらのデータは、i.LNに注入された生体材料の大きさを制御することによって、新しいワクチンに利用される可能性のある2つの経路を示唆している。
本稿では生分解性脂質安定化ポリマー粒子(マイクロ及びナノスケール)は、改変二重エマルジョン戦略5,11を用いて合成される。粒子特性は、レーザー回折と顕微鏡検査によって特徴付けられます。これらの粒子は、次いで、一般的な、無毒なトレーサー色素14を用いて非外科的に同定されたインギナルのLNに直接注入される。細胞の細胞の取り込みと滞留を監視するだけでなく、細胞の取り込みや滞留を監視するために、細胞学またはフローサイトメトリーによるLNの射出後分析を使用して、LN環境内の粒子の分布を確認することができます。組織学的処理とフローサイトメトリーを詳述するプロトコルについては、読者は最近のJoVE記事とジャーナルレポート15-22に言及されています。典型的な結果は、強力で効率的な免疫応答を達成したり、標的病原体の免疫を調整するために利用することができるこれらの拠点の局所LNターゲティングを示している。
プロトコル
このプロトコルのすべての動物研究は、連邦、州、および地域のガイドラインに従って完了し、メリーランド大学の制度的動物ケアおよび使用委員会(IACUC)によってレビューされ、承認されたプロトコルを使用して完了しました。
脂質安定化マイクロ粒子およびナノ粒子の合成
- 7 mlガラスバイアルで、DOPC、DSPE-PEG、およびDOTAP脂質を60:20:20モル比で組み合わせて、マスター脂質ミックスを調製します。
- 単一のサンプルを合成するには:2mlガラス血清ピペットを使用して、DOPC、DSPE-PEG、およびDOTAPの242.9 μl、287.4 μl、および71.9 μlをそれぞれバイアルに移します。
- 複数のサンプルを合成するには:上記の各脂質量にサンプル数を掛け、単一のバイアルに組み合わせ、この脂質混合物の等しいアリコートを各サンプルに対応するバイアルに移します。
- 10分間窒素ガスの穏やかな流れの下で乾燥した脂質、または一晩真空オーブンに入れます。
- 1個の空の20mlガラスバイアルで、各粒子サンプルに対して5mlのジクロロメタンに80mgのPLGAを溶解し、16mg/mlポリマーストック溶液を生成する。
- 乾燥した脂質、キャップ、および渦を含むバイアルに5mlのポリマー溶液を30秒間加えます。
- 微粒子を合成するには:
- 超音波処理器を使用して、12 Wの氷上のポリマー、脂質、および他の水不溶性貨物を含む有機相を超音波処理し始めます。
- ピペットを使用して、500 μlの蒸留されたH2O、または1mgのペプチド、タンパク質、または他の水溶性貨物を含むH2Oを加えることで、水溶性(w/o)エマルジョンを作成します。
- 氷上の12 Wで30秒間超音波処理を続け、バイアルを上下に揺らし、ソニケーターの先端を横に横にして完全な乳化を確実にします。
- 150 ml ビーカーで 40 ml の H2O に w/o エマルジョンを注ぎ込み、水中油油(w/o/w)エマルジョンを作成します。
- デジタルホモジナイザーを使用して16,000 rpmで3分間ホモジナイズします。
- 磁気攪拌棒を加え、ビーカーを攪拌プレートに移し、w/o/wエマルジョンを一晩かき混ぜて余分な溶媒を取り除きます。
- ナノ粒子を合成するには:
- 14 Wで氷上のポリマー、脂質、および他の水不溶性貨物を含む有機相の超音波処理を開始します。
- ピペットを使用して、500 μlの蒸留されたH2O、または1mgのペプチド、タンパク質、または他の水溶性貨物を含むH2Oを加えることで、w/oエマルジョンを作成します。
- 氷の上の14 Wで30秒間超音波処理を続けます。
- 150 ml ビーカーで 40 ml の H2O に w/o エマルジョンを注ぎ、氷上 16 W で 5 分間超音波処理を行い、w/o/w エマルジョンを作成します。バイアルを上下に揺らし、ソシエーターチップの周りを左右に揺らし、完全な乳化を確実にします。
- 磁気攪拌棒を加え、フラスコを攪拌プレートに移し、w/o/wエマルジョンを一晩かき混ぜて余分な溶媒を取り除きます。
- 翌朝、粒子を洗浄して収集します。
- 40 μm ナイロンメッシュセルストレーナーを通して50 mlの円錐チューブにエマルジョンを注ぎます。
- 微粒子の場合は5,000 x gで5分間、ナノ粒子の場合は24,000 x gで5分の遠心分離機粒子。
- デカント上清及び洗浄粒子は、1mlのH2O中で再懸濁した。
- 懸濁した粒子を1.5mlマイクロ遠心チューブに移す。
- マイクロ粒子の場合は5,000 x gで5分間、ナノ粒子の場合は24,500 x gで5分の遠心分離機。
- 上清を除去し、1mlH2Oで再懸濁し、ステップ1.6.5のように遠心分離することによって粒子をさらに2倍洗浄する。洗浄後、粒子を1mlH2Oで懸濁させて即時使用し、または凍結乾燥して長期保存する。
2. 合成収率の測定
- 空の20mlガラスバイアルを前もって重量を量る。マイクロピペットでピペットを混ぜた後、前重いバイアルに100μlの粒子懸濁液を加えます。
- 粒子を凍結乾燥させるか、窒素の穏やかな流れの下で乾燥させます。
- 乾燥したポリマーを含むバイアルを秤量する。乾燥粒子を含むバイアルの質量からバイアルの元の重量を差し引くことによって、バイアル中の粒子収率を決定する。
- バイアル内の粒子質量に希釈係数を掛けることで、粒子の全体的な収率を決定します。収率を求めるには、粒子質量を理論上の最大入力質量で除算し、100%を掛けます。
3. 粒度の決定
- 脱イオン水で満たし、綿先端の綿棒で拭くことによって、付属のキュベットスタイルのガラス分画セルをきれいにします。蒸留した10mlのH2Oを洗浄されたファクションセルに移し、磁気マイクロスターバーを追加し、分画セルを粒子サイズ分析装置のセルマウントにロードします。
- 分数セルの完全な混合を達成するために、粒子分析装置の磁気撹拌速度を調整し、コンパートメントドアを閉じます。
- 計測器ソフトウェアインターフェイスを使用して、レーザーを分画セルに合わせます。
- 計測器ソフトウェアインターフェイスを使用して、蒸留されたH2Oのみを含む画分セルを持つベースライン読み取りを記録します。
- ミクロピペットを混ぜて、元の粒子懸濁液を上下にピペットします。
- ピペット10μlの粒子懸濁液(通常約0.5mg)を画分細胞に入る。測定器ソフトウェアインターフェースで示されているように、セルに追加された粒子サンプルの体積が適切な範囲で信号強度を生成するのに十分であることを確認します。実際に必要な粒子の質量は、粒子サンプルの収率と光学特性に依存します。
- 粒子サイズ分析装置のコンパートメントドアを閉じ、PLGAの屈折率1.60を使用して粒子サイズを測定します。
- ソフトウェアインタフェースを使用して、数値基準を使用して粒子径を計算します。
4. 粒子の可視化
- ピペット粒子懸濁液をマイクロピペットで上下に混合する。粒子懸濁液を脱イオン水中1mg/mlに希釈する。
- 3 μlの希釈粒子懸濁液を加え、カバースリップを45°の角度で取り付けて、泡の形成を避けて顕微鏡スライドを準備します。各蛍光貨物に適したフィルターセットを使用して、スライドを顕微鏡ステージと画像に配置します。
5. i.LN 用マウスの調製注射
- トレーサー色素ソリューションを準備します。
- 10mgの色素粉末を10mlの蒸留H2Oで溶解して、トレーサー色素の0.1%(w/v)溶液を調製します。
- 0.2 μmのシリンジフィルターを使用して、色素溶液をガラスバイアルに殺菌します。
- 注射の1日前に、IACUC承認動物プロトコルに従ってイオブルランを使用してマウスを麻酔する。麻酔の深さを評価するには、つま先ピンチ反射試験を行い、呼吸数を監視して、1分間に約100〜140回の呼吸速度を確保します。
- マウスが麻酔されている間、バリカンを使用して尾部と後ろの四分の一の基部で髪を剃ります。動物の腹側から髪を取り除き、後ろ足(股関節)の関節のすぐ上の側側に横向きに。
- トレーサー染料を注入する。
- 各染料注入に対して、マイクロピペットを使用して10μlの色素溶液をマイクロ遠心チューブに移し、10μl全体を1mlシリンジに取り付けた31G針に吸引します。
- 毛髪が切り取られたテールベースの両側に皮下10μlの染料溶液を注入し、注射の間にリローディングします。
- 綿棒を介して軽度の脱毛クリームを塗布することによって残りの髪を除去します。後腿と腹部の間の領域をコーティングしてください。
- 脱毛クリームを皮膚に3分間インキュベートします。インキュベーション後、暖かいH2Oで手を濡らし、脱毛クリームを肌にそっとこすります。
- 手袋をした手を温かいH2Oで濡らし、テールベースと後方をこすり、脱毛クリームをすぐに取り除きます。過剰な脱毛剤が取り除かれるまで繰り返し、刺激を避けるために手を濡らしてください。
- 柔らかい布やペーパータオルを温かいH2Oで濡らし、マウスの下側を拭いて、マウスの下の部分を拭いて、マウスから残留脱毛を取り除きます。摩擦動作を避けて、マウスの摩耗や皮膚の損傷を防ぎます。
- マウスが熱灯の下で回復し、保持に戻ることを許可します。
6. i.LN. パーティクルの注入
- 翌日、IACUC承認動物プロトコルに従ってイオブルランを使用してマウスを麻酔する。
- マウスを調べて、各インジナーリンパ節へのトレーサー染料の排出を確認します。リンパ節は、後腿部と腹部付近の暗い場所として見えるべきである。
- パーティクルインジェクションソリューションを準備する:
- 所望の注入濃度で蒸留されたH2O中の粒子を再懸濁する。各注入に対して、マイクロピペットを使用して10μlの粒子溶液をマイクロ遠心チューブに移します。
- 10μl全体を1mlシリンジに取り付けられた31Gインスリン針に吸引する。
- 粒子線量を注入する:
- LNを視覚化した後、親指、人差し指、中指を使ってLN周辺の皮膚を引き締め、皮膚の挑発を引き出し、注入量の配置を制御できるようにします。
- 針で皮膚に90°の角度でLNに近づき、染色したLNの上に皮膚を1mmの深さに浸透させます。
- ゆっくりとボリューム全体を注入します。注射中、皮膚を通してLNの体積を観察し、目に見えるLN拡大によって注入を確認する。
- マウスが熱灯の下で回復し、保持に戻るか、または追加のテストを行うことを許可します。
関連する分析技術(例えば、細胞学、流量測定)については 、JoVE 論文265、1743、および3054および 免疫学の現在のプロトコル、第5章および第21章15-22を参照してください。
結果
この原稿で提示されるプロトコルの期待される結果は、粒子合成、動物の調製、および粒子注入の3つのカテゴリーに分類することができる。
図1 は、両親媒性脂質によって安定化された生分解性ポリマー粒子の合成および特性を示す。エマルジョン/溶媒蒸発合成プロトコル(図1A)の結果は、生成された最終的なエマルジョンの目視検査によって定性的に評価することができる。粒子バッチは、不透明な外観を持つ均質で安定したエマルジョンでなければなりません。合併症には、しばしば脂質安定剤の不適切な貯蔵によるクリームまたはフロキュレートのエマルションが含まれる。この不安定性を避けるために、脂質は脱水状態で、または窒素でパージされた密封されたバイアルで-80°Cで保存されるべきです。粒子合成の定量的評価は、レーザー回折または動的光散乱を用いてサイズ分布を分析して行うことができる(図1B)。期待される結果は、粒子の均一な集団を示す、緊密に分布した単一モーダル粒子サイズを含む。本稿に記載された合成パラメータは、ナノ粒子と微粒子について、それぞれ約100nmまたは3μmを中心とする数平均分布を生成する。粒子合成の更なる定性評価は、複数のクラスの蛍光貨物を組み込むために上記プロトコルを改変することにより達成することができる。 図1Cにおいて、蛍光ペプチド(FITC,緑色)、親油性色素(DiD,赤色)、およびオーバーレイ画像(黄)を装填した微粒子の顕微鏡画像は、粒子の体積内に所望のサイズ範囲内の粒子の生成およびペプチドの封入を確認する。
図2の最初の2つのパネルは、この論文に記載されているi.LN.注入戦略のための動物の調製の期待される結果を要約する。この方法論は、非毒性トレーサーの末梢注入によってインギナルLNをマーキングし、その後のi.LN.粒子の注入の場所を特定することを含む(図2A)5。前述したように、尾部ベースで皮下注射後のトレーサー染料の排水は、イングイナルLN(図2B)5の可視化を可能にする。承認された脱毛クリームの摂取は、マウスに危険をもたらす可能性があります。したがって、足とマウスの腹側に特に注意を払って、適用されるすべてのクリームを徹底的に除去するように注意する必要があります。脱毛剤は、単一の滑らかな動きで濡れた、柔らかい布や濡れたペーパータオルを使用して除去する必要があります。これは、マウスの露出した皮膚に擦り傷につながる可能性がありますので、クリームを除去するためにこすりを避けます。
インジュナルLNへの配信の局所的な確認は、観察またはヒストロジーを通じて評価することができる。LN ボリュームは、注入の成功の指標として、注入中に視覚的にモニターできます。期待される結果は、隣接する組織や細胞に大きな漏れを伴うことなく、LN構造全体で効率的な貨物の流通を含みます。さらに、注入された流体がLN内のトレーサーを置き換え/希釈するにつれて、染料濃度/着色は注入後にそれほど強くなるべきではありません。組織の観察は、無傷を明らかにする必要がありますが、流体注入によるLNを拡大する。潜在的な課題は、あまりにも急速に注入するか、LNを欠いているが、どちらも周囲の皮下組織への体積の溶出を引き起こす可能性がある。これらの望ましくない結果は、壊死または組織学によって確認され、そこで粒子懸濁物が注射対象のノードから細胞および組織に広がって観察される。これに対して、LN構造内の粒子の封じ込めによる拡大されたインジナルLNの同定が期待される結果となる。切除されたLNの組織学的処理は、 図2C および 2Dに示すように、リンパ組織への貨物の送達を確実に確認することができる。 図2 の粒子には、注入中、組織学的処理および蛍光顕微鏡の間に貨物を可視化するための蛍光貨物が組み込まれています。
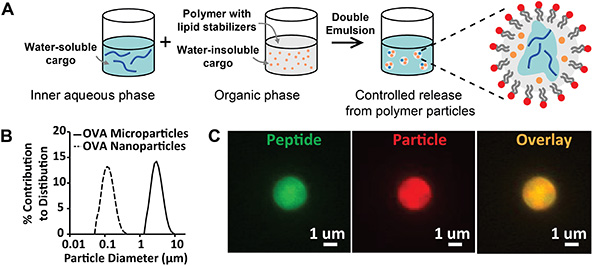
図 1.脂質安定化粒子の合成と特性評価)エマルジョン/溶媒蒸発により調製された脂質安定化粒子の合成を説明した模式図。B)微粒子(実線、直径= 2.8 μm)およびナノ粒子(破線、直径=113nm)のサイズ分布。C)蛍光標識ペプチドと蛍光粒子染料を装填した粒子の蛍光顕微鏡画像。ラベル:ペプチド(緑色)および粒子(赤色)。ここをクリックすると、より大きな画像を表示できます。

図 2.i.LN.LN内の生分解性粒子の注入と分布。) i.LN.注射のための方法論。B)皮膚を介したマウス内のRNの可視化(上画像)および後述する壊死(下像)5。蛍光標識ポリマー微粒子(粒子、緑色)の堆積と分布を確認するLNの組織学的染色;T細胞, 赤;B細胞、青)。D)蛍光標識ナノ粒子(50nm、左画像)および微粒子(6μm、右画像)を、インジェクション後24時間のLNsで行う。ここをクリックすると、より大きな画像を表示できます。
ディスカッション
このプロトコルに記載されている技術は、LNおよびLN居住抗原提示細胞へのワクチンの制御された送達を可能にする。生体材料カプセル化貨物はLN内に局在化することができ、LN微小環境に送達される1種類以上の貨物の線量の操作を可能にする。ポリマー粒子からの局在化および制御放出は、従来のアプローチよりも有意に低用量で強力な細胞および体液性免疫応答を生成することが示されている。また、生体物質キャリアサイズの操作を通じて、細胞処理の一次モードは、より大きな微粒子5からのナノ粒子または細胞外貨物放出の直接取り込み間で変調することができる。これらの結果は、治療ワクチンデリバリーのためのプラットフォームとしての i.LN. 生体材料送達の実現可能性を確立する。
エマルジョン/溶媒蒸発によるPLGA粒子の合成は、薬物送達用途23,24において広く採用されている。したがって、この技術に関連する潜在的な課題は、主にLN標的部位におけるワクチンの同定および堆積の成功に関連する。トレーサー色素の使用は、ターゲットのインジナルLNの可視化を容易にするが、皮膚の下のターゲットサイズと深さは小さい。したがって、著者らは、マウスの調製および注射を練習するための時間とマウスをアロットニングすることを推奨する。動物の調製(すなわち、脱毛剤のシェービングおよび適用)中に、腹部を持つ脚の角度が皮膚をバリカンから傷害しやすくする動物の腹側のマウスを切らないように注意する必要があります。さらに、すべての脱毛剤は、動物が通常のグルーミング動作中にクリームを摂取するのを防ぐために、ぬるま湯で除去する必要があります。LN注射を実践するために、より高いトレーサー色素濃度を投与し、動物を安楽死させ、その後複数回注入することができる。次の注射マウスは、壊死させることができ、注射された動物からのLNのサイズは、未注入制御LNと比較することができる。この技法の制限の 1 つは、LN 構造にロードできる注入ボリュームの物理的限界です。我々のプロトコルは、マウスの10μlの注射量を示唆しているが、他の研究は、少なくとも20μl.13の大きな注射量を報告しているが、i.LNを介したワクチンの直接送達は劇的な用量節約を可能にするので、これらのワクチンの機能は一般的に体積制約によって制限されるべきではない。
前述のように、粒子の物理的性質(すなわちサイズ)を変えることは、LN組織における生体材料および封入された貨物によって誘発される経路または結果を変える有効なメカニズムである。エマルジョン/溶媒蒸発プロトコルは、表面電荷や機能性などの物理的または化学的特性、および生分解/貨物放出速度23,24を容易に変更することができます。例えば、放出動態は、代替ポリマー組成物を介して調整することができ、表面機能は、修飾された脂質組成物またはポリ(ビニルアルコール)を使用して変更することができる。粒子に積まれた貨物は標的病原体のための異なった抗原かアジュバントを含むために容易に操作することができる。このアプローチの利点は、i.LN. の配達とバイオマテリアルからの貨物のローカルで制御された放出の組み合わせによって達成されます。この相乗効果は、微量を使用して、非特異的/全身的な副作用を減らして、効果的に適応免疫応答を生成するために利用できるプラットフォームを確立します。
開示事項
本品の制作費とアクセス料は、HORIBA社が一部後援した。
謝辞
この作品は、PhRMA財団とメリーランド大学カレッジパークの研究学者賞によって部分的に資金提供されました。ダレル・アーバイン教授は、「アジュバント放出ポリマー粒子の非共性注入によるリンパ節微小環境の場でのエンジニアリング」 の完了に関する最初の作業の支援に感謝します。5
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
参考文献
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved