Method Article
における損傷応答のライブイメージングや研究のためのマイクロ流体チップを使用
要約
ショウジョウバエの幼虫は、その半透明のキューティクルと強力な遺伝学へのライブイメージングのための魅力的なモデル系である。このプロトコルは、単層のPDMSデバイスを活用する方法について説明し、 第3齢ショウジョウバエの幼虫の神経細胞内で細胞過程のライブイメージングのための「幼虫チップ」と呼ばれる。
要約
ライブイメージングは、しかし、これは生きている動物に挑戦することができ、細胞生物学的プロセスを研究するための重要な技術である。 ショウジョウバエの幼虫の半透明のキューティクルは、ライブイメージング研究のための魅力的なモデル生物になります。しかし、ライブイメージング技術のための重要な課題は、非侵襲的に固定化し、顕微鏡で動物を配置することである。このプロトコルは、我々は'幼虫チップ」と呼ぶポリジメチルシロキサン(PDMS)マイクロ流体デバイス上でショウジョウバエの幼虫を固定化し、画像化するためのメソッドを使用するシンプルで簡単に説明します。幼虫チップは注射器を介して真空を印加すると、動物を固定化し、このような神経索、分節神経、ボディなどの腹側の構造をもたらし、薄いカバーガラスに取り付けられぴったりフィットのPDMSマイクロチャンバーで構成されているカバーガラスのすぐ近く内の壁の筋肉、。これは、高分解能イメージングを可能にし、重要なことには、オクタンの使用を回避する生理学的プロセスの広い範囲の研究を促進するstheticsや化学物質、。幼虫が固定化から容易に回復するので、それらは容易に複数の撮像セッションを行うことができる。これは時間から日の範囲の時間経過にわたる長期的な研究が可能になります。このプロトコルは、ステップバイステップのチップとどのように第3齢幼虫における神経イベントのライブイメージングのためのチップを利用するに準備する方法について説明します。これらのイベントは、軸索、傷害に対するカルシウム応答、および長い距離と時間スケールでの光転換タンパク質の人身売買の経時的研究における細胞小器官の迅速な輸送が含まれています。チップの別のアプリケーションは、再生および軸索損傷の変性反応を研究することであるので、このプロトコルの第2の部分は、分節神経挫滅による末梢神経内で軸索が負傷のための新しい、簡単な手順を説明します。
概要
ショウジョウバエ、 キイロショウジョウバエは 、100年以上のモデル生物として利用されており、基本的なシグナリングおよび無脊椎動物からヒトに保存されている発生経路を定義することに尽力証明されている。特定の細胞型で、蛍光タグ付けされたタンパク質を発現させるために利用できる多くの遺伝的なツールがあり、特に以来、ライブイメージングは、細胞のメカニズムを研究する重要なアプローチであり、シンプルなボディープランとショウジョウバエの幼虫の半透明のキューティクルは、ライブイメージングのための魅力的なシステムになります。
ライブイメージング技術のための重要な課題は、非侵襲的に固定化し、顕微鏡検査のために動物を配置することである。従来の固定化アプローチは、動物を殺すどちらの切開1,2またはクロロホルムの使用を含む。麻酔エーテル4およびイソフルラン5-8も使用されている。麻酔薬は、多くの利点を提供するが、彼らはまた、それゆえに研究プロセスに影響を与えると動物へのストレスを作成することができ、神経活動と(ハートビートを含む)の重要な生理学9月11日を阻害する。エーテルおよびイソフルランを操作するための人間の安全上の懸念もあります。
私たちは「幼虫チップ」12を呼び出して、単層のPDMSマイクロ流体デバイス、 ショウジョウバエの幼虫を固定化する薬物のない方法を開発した。このプロトコルは、取得したり、幼虫チップを作る方法を説明し、早期段階第3齢幼虫にライブイメージングのためにそれを利用する方法。チップがシリンジを介して真空を印加すると、その、ジャストフィットマイクロチャンバーから構成され、穏やかな機械的な力を介して動物に固定する。固定化方法は、ガラスカバースリップに近接内の神経索分節の神経及び体壁の筋肉のような腹側構造をもたらす。これは、高い開口アパーチャを有するような構造体の高分解能イメージングを可能にするTURE(高倍率)目的。
(I)幼虫チップの使用は、無麻酔動物のin vivoイメージングを可能にする、化学物質の使用を置き換えます。他の従来技術に比べて幼虫チップの利点は、次のものがあります。 (II)幼虫は、すぐに(イソフルラン8,13のための2時間の回復期とは対照的に)チップから放出された後に回復。これはミリ秒から数分に、時間や日に至るまで、幅広い時間スケールにわたって画像化を可能にします。 (ⅲ)ガス透過性材料であるPDMSの使用は、幼虫の体内への環境からの酸素/空気を連続的に拡散を可能にします。 (iv)のチップを使用するのは簡単かつ安全である、及び(v)それは再利用可能であり、最小限のコストで製造することができる。
幼虫チップを使用するための指示に加えて、このプロトコルは、 第3齢幼虫におけるニューロンのイベントを研究するためのその使用のいくつかの例を提供する。これらはaxonaのライブイメージングを含むL輸送、傷害に対するカルシウム応答、および長い距離と時間スケールでの光転換タンパク質の人身売買の経時的研究。
チップの別のアプリケーションは、軸索損傷に対するニューロンの応答を研究することである。このために、追加の手順は分節神経挫滅による末梢神経内で軸索が負傷のために(第3部)に記載されている。この単純なアッセイは、同時に処理されるべき多くの動物を可能にする標準的な解剖実体顕微鏡下の両方の迅速かつ再現可能に行うことができる。傷害に対する細胞応答は、幼虫チップでのライブイメージングによって研究することができる。
プロトコル
1。 PDMSチップを作る
SU-8鋳型からPDMSチップを作るために、手順1.1から1.7に従ってください。チップが手元ですが、使用のために組み立てする必要がある場合は、1.8に進みます。
- PDMSベースの45グラムと小型使い捨てのプラスチック容器に、PDMSキットからエージェント(10:1比率)を硬化の4.5グラムを混合し、徹底的にプラスチック製攪拌棒を使用してそれらをミックス。
- 任意の気泡を除去するために10分間の真空容器( 例えば 、デシケーター)内の容器を置きます。
- 直径のプラスチック皿の中の150ミリメートルの下部にあるSU-8型を置き、ゆっくりと鋳型にPDMSの混合物を注ぐ。 PDMSを注いでいる間に気泡を発生しないように注意してください。
- 4時間650℃のオーブン中でPDMS(またはインキュベーター)を硬化させる。
- オーブンから硬化したPDMS/SU-8モールドを取り外して、数分間冷ます。
- カミソリの刃を使用して、SU-8鋳型の縁に沿って硬化したPDMSをカットして、SU-8鋳型から取り外し。
- PDMSスラブを分割カミソリの刃を使用して、個々のPDMSチップに。
- 21 Gの分注針を用いて、PDMSチップの( 図1Aに示されている)真空ポートの穴を突く。
- 23のGペンシングニードルを取り、針がロックハブから切断先端破るために、そのベースから何度か針の先端をねじる。
- チューブは、針の少なくともミリメートルを覆うようにポリエチレンチューブの小片に23Gの針の先端を挿入します。その後、離れて針から余分なチューブをカットするカミソリの刃を使用しています。これは、真空吸入口に挿入されたときにシールを作成する針の一方の端部の周りにプラスチックリングを作成する。
- 真空ポートの穴に23 G針先端を挿入し、 倒立顕微鏡( 図1Bおよび図2A-B)で使用する。 正立顕微鏡( 図1Cおよび2C-D)で使用するために:21のGの塗料で、PDMSチップ側の第2の穴を突く針をnsing、この穴は、側面から最初の穴へのアクセスを提供します。そして、サイドの穴にチューブリング23のG針の先端を挿入します。上の穴( 図1C)をシールするために、PDMSチップの上に両面テープの一部を配置します。
- 長さ約20cmでポリエチレンチューブの部分を取る。真空ポートに挿入された針の先端にチューブの一方の側を接続する。
- (材料のリストに「3方コックを参照)3方弁のポートにチューブの反対側を接続する
- 残りの2つのポートのいずれかに20ミリリットルの注射器を取り付けます。最後のポートは、環境に開放されています。
2。ライブイメージングのための幼虫チップを使用して
- 透明粘着テープでPDMSチップを清掃してください。チップの底にテープ片を取り付けます。テープが全体のPDMS表面に接触されていることを確認した後、テープを剥がし。
- そこを確認するために、上記のステップ2〜3倍を繰り返しPDMSチップの表面には粒子または(以前の実験から保持)のオイルはありません。 PDMSチップは再利用可能であるので、それはガラスにPDMSの接着に影響を及ぼし、不十分なシールをもたらすことができるように、オイル残留物を除去することが非常に重要である。
- 水を入れたペトリ皿に初期(IE採餌) 第3齢幼虫を転送します。 (採餌第3齢幼虫ではなく培養バイアルの側面よりも、食品にあります)。培養液を除去するために水に幼虫を浸し。
- 清浄なガラスカバースリップを取ると、その中心にハロカーボン700油の小滴を配置します。
- 鉗子を使用して、優しくクリーンを拾う、(幼虫は長さ〜3.5〜4ミリメートルであるべき)水からの第3齢幼虫を早期上演した。余分な水を除去した後、油滴の上に置き、軽量拭きや紙タオルの上に簡単に動物を配置します。降下が十分に小さい幼虫の気管が被覆されていないようなものであるべきである。幼虫のSTAを聞かせて10秒間、油滴上のY。
- 油滴から幼虫を外し、きれいなガラスカバースリップの上に置きます。
- 別のきれいなカバーガラスに幼虫を移します。このステップは、余分な油を除去します。
- 幼虫の向きに注意してください。神経コードと分節神経を画像化するための、幼虫の腹側はカバースリップの上に座る必要があります。 2縦気管チューブが特徴の背側には、上方を向くようにします。注:これは、幼虫が自然好む向きです。
- そっと幼虫の上にPDMSチップを配置します。幼虫は真空ポートを志向尻尾と、マイクロチャンバーの中央を中央に配置する必要があります。幼虫は、チャンバの縁に接触しないように注意してください。これは前部と後部気管端末では特に重要です。注記:この手順は、最高の実体顕微鏡下で行われている。
- 良好なシールを達成するためのカバーガラスに対して、PDMSチップを押し込みます。幼虫が完全であることを確認してくださいPDMSチップはカバーガラスに触れているマイクロチャンバーで囲まれた。
- 注射器は、真空を作成する(チューブを通して)PDMSマイクロチャンバーから空気を引き出すことができるように三方弁を切り替える。
- 片手でしっかりとPDMSチップ/カバーガラスを保持します。シリンジプランジャを引くもう一方の手を使用してください。抵抗は、真空を作成するために、注射器のハンドルに感じられるまで、空気の2〜2.5ミリリットルを引き出す。真空は、PDMSチップ、油、およびカバーガラスのインターフェース間の緊密なシールを生成し、幼虫の移動性を制限しています。
- PDMSチップは注射器から、環境から隔離されるように、バルブのスイッチを切る。その結果、比較的安定した真空レベルは、シリンジプランジャを保持する必要なしにマイクロチャンバーに保持される。
- 全体動物の体はマイクロチャンバの内部に配置されていることを確認するためにステレオスコープの下で幼虫を確認し、動物が不動であること。気管を表示する必要がある。残りのPDMSチップは、カバーガラスで接触していなければならない。注:正しくチップに固定化された動物の例については、図2Eと2Fを参照してください。いくつかの誤った向きは、 図2G及び2Hに示されている。
- 顕微鏡で幼虫チップ(PDMSチップ+カバーガラス)を配置します。幼虫チップ、チューブと注射器はカバーガラスからのPDMSチップの剥離を避けるために、慎重に処理する必要があります。正立顕微鏡のために、両面テープ( 図1C)を顕微鏡ステージにチップの「上部」側に固定してください。
- 興味のある動物の構造(複数可)を検索し、撮影を行うために、高倍率の対物レンズ(油浸、40-63Xを推奨)を使用します。いくつかの場合において、より低い倍率を高倍率に切り替える前に、撮像のための所望の領域を同定するために必要とされてもよい。
- 撮像が完了すると、位置にバルブを切り替えることにより、真空を解放するそれは、環境に開放されています。
- カバーガラスからのPDMSチップを取り外します。幼虫は、すぐに運動性である必要があります。
- マイクロチャンバーから幼虫を削除して、ゆっくりと回復のためのブドウジュース寒天プレートに幼虫を配置する鉗子を使用してください。
3。幼虫分節の神経に神経挫滅傷害を誘発する
- 隔離するために、上記のステップ2.3に従って早期希望の遺伝子型の第3齢幼虫を上演した。ステップ2.3で説明したように食物を除去するために水に幼虫を浸し。
- CO 2パッドで、標準的なフライのCO 2麻酔ステーションを使用して幼虫を征服するために、解剖実体顕微鏡下に保持。幼虫は1〜2分間のCO 2パッドの上に配置した後に不動になる必 要があります。
- 今実体顕微鏡下でブドウジュース寒天プレート上に単一の麻酔をかけた幼虫を置く。腹側神経索を視覚化し、(キューティクルを通して神経を分節するように動物腹側を回し図3)。幼虫が完全に不動であることを確認してください。
- Dumostar番号 - 5鉗子を使用して、しっかりと5月10日秒クチクラを通して分節神経をつまむ。これが正しく行われると、キューティクルが無傷のままであり、体壁を貫通されていない。注:傷害は、前後体軸に沿って異なる位置で行うことができるのであれば、腹側神経索、唾液腺、および腸のような損傷を受けない。 図3Dに示すように、最も効果的な傷害の場所は、第3 の腹部セグメントの終点に向かっている。この場所の損害賠償最も神経の傷害とは、動物を殺すことなく再現することが最も簡単です。
- 損傷後、ブドウの板の上に動物のように、その腹側を下に向ける。それは、そのヘッドを移動して食べることができるはずです。怪我が成功した場合には、幼虫の後半分が麻痺します。
- 25でグレープジュース寒天プレート上で負傷した動物を飼う°、Cの実験目的に応じて所望の時間。運動ニューロンのために、近位断端が負傷14の8から10時間以内に発芽し始め、遠位断端が6-8時間15以内に退化し始めます。クラスIV DA感覚ニューロンでは、近位断端は4-6時間以内に発芽し始め、遠位断端は損傷後3〜4時間以内に退化し始める。注:適切なGal4のドライバと蛍光リポーターで、発芽および変性(例えば、 図6を参照)幼虫チップに観察することができる。
結果
幼虫チップは、その設計図1の回路図に概説されている単層PDMSブロック(PDMSチップ)で構成されている。 (また、独自の金型を設計するための補助的なDXFファイルを参照してください)。幼虫のマイクロチャンバー、真空ポート、および周辺部チャネル( 図1A)は 、PDMSチップ内の140ミクロンの窪みである。チップの上に配置されている初期の油( 図1BおよびC 1)でカバースリップの上に載っている第3齢幼虫を上演した。カバーガラスとPDMSチップとの間のオイルガラス界面は、穏やかな真空の適用時に作成されるためのシールが可能になります。このシールは、チャンバ内で幼虫をトラップし、早期段階以来、3 回目の幼虫は、チャンバーには、いくつかの物理的な動物でのくびれ、効果的に固定化し、その動きを制限を作成し、シール、チャンバーよりわずかに厚い。この固定化された状態では、一定の腹側このような腹神経索およびセグメントなどのボディ構造は、カバースリップの近くにプッシュされます。固定化された状態で、これらの構造は40Xと63X対物レンズの作動距離内にあることができるので、これは、イメージングのために有利である。真空を解除した後、幼虫を容易に追加の実験を行うことができるように、マイクロチャンバから除去することができる。この純粋に機械的な固定化アプローチは、最大1時間12の連続固定化期間の後に生きている幼虫の90%を維持することができます。
真空が故にユニット全体がチャンバー内の位置決めがライブイメージングが行われ、共焦点または落射蛍光顕微鏡に、行われ実体顕微鏡から輸送が容易であり、簡単な20ミリリットルの注射器によって作成されます。ステップ1.6から1.14に記載されたシリンジは、(削除ロックハブ付き)ポリエチレン管および23Gの分注針を介して真空ポートに接続されている。倒立顕微鏡、チューブ用およびシリンジチップ(図1B、2A、及び2B)の頂部を介して接続されている。直立顕微鏡、それらはチップの側のポート(図1C、2C、および2D)を介して接続されている。倒立顕微鏡用の設定は使いいくらか容易である。シリンジを捕捉し、チャンバ内の幼虫を固定し、カバーガラスとPDMS装置との間の緊密なシールを形成するオイルガラス-PDMS界面に結合する穏やかな真空(約10 psiの)を作成するために引っ張られる。
マイクロチャンバーへの幼虫の配置は、(プロトコル2.7から2.10ステップ)効果的な固定化および生存率( 図2E-H)のために重要である。動物は( 図2G)、室内には大きすぎる、またはその頭や気管になった場合、チャンバの端とカバーの間に挟まれた場合リップ( 図1H)に 、それは手順を生き延びる可能性は低い。
以下は、神経細胞内の様々な細胞応答(図4-7、映画、S1と動画S2)を研究する幼虫のチップを使用することのいくつかの例である。
速い軸索輸送のイメージング:幼虫チップは各周辺軸索内のシナプス小胞のキネシン媒介トランスポート(図4と動画S1)映像に使用された順行(〜1.0ミクロン/秒)と逆行(〜0.8ミクロン/秒。これらの小胞の)移動が容易に回転ディスク共焦点顕微鏡で収集したムービーを研究することができる。
レーザー顕微ために動物を配置。感覚ニューロンの樹状突起( 図5と動画S2)パルスUV色素レーザーを使用して離断したTを使用するためのプロトコルマイクロサージェリーのための彼の方法は、他の場所で16,17見つけることができます。効率的な固定化技術( 図5)を検出および測定するために、(遺伝的にコードされたCa 2 +指示薬GCamp3.0 18により検出された)細胞内カルシウムの変化のような損傷したニューロンにおける速いタイムスケールの変更を可能にする。
傷害に対する再生および変性反応の研究:動物が撮像セッション間休ませている場合は、幼虫のチップは、時間スケールの広い範囲にわたって発生する細胞事象を研究するために使用される。例えば、「回生」および15時間の時間尺度で起こる軸索損傷、変性に対する応答の両方は、幼虫チップ( 図6)で画像化することができる。この例では、オクトパミン運動ニューロンの軸索は、プロトコルの一部3に記載された分節神経挫滅( 図3)を介して負傷した。近位の軸索切り株、新たな発芽を起こし、静脈瘤を形成し、次いで、ウォーラー変性のプロセスを介して断片化さ遠位軸索は、損傷後に画像化し、異なる時間間隔で研究することができる。
インビボで経時的にphotoconvertible蛍光タンパク質を追跡:蛍光UV光への暴露時に不可逆的に変化させるphotoconvertible蛍光タンパク質)の開発は、一方が特異的に細胞内のタンパク質のサブセットを標識し、19時間かけて標識されたタンパク質の運命を追跡することができ、20。この技術は、最も一般的には、細胞培養中で行われるが、幼虫、ワンチップは、 生体内で定義された細胞内の遺伝的にコードされたタンパク質photoconvertibleを追跡することができる。一例として、我々は、 図7A(クラスIVダ感覚ニューロンにおいて発現Denda2-α-チューブリン融合タンパク質は、細胞体でphotoconvertedすることができることを示し、 7 のB)。 photoconvertedタンパク質の輸送は、その後時間をかけて追跡することができます。2日以内に、我々は細胞体( 図には離れて元の場所から約1mmにある感覚ニューロンの軸索末端、内photoconverted有意な量のタンパク質を検出できる7Aおよび7℃)。
説明した例( 図4-7及び作品S1とS2)はすべて、ニポーCSU10スキャナとC9100-50 EMCCDカメラからなる、回転するディスク共焦点システムを使用して画像化し、63X(1.5 NA)とアクシオオブザーバーに搭載されたオイル対物し、Volocity取得ソフトウェアを使用して駆動される。
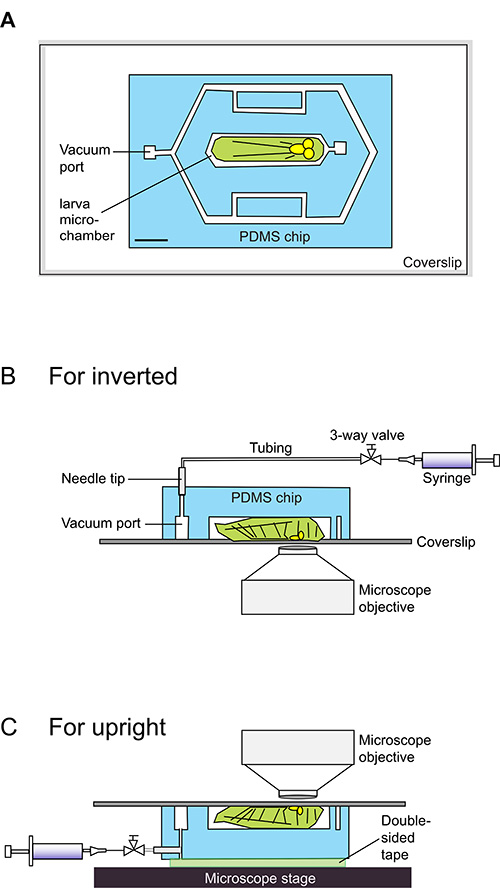
図1。 幼虫チップを使用するための強力な> 回路図漫画。
(A)幼虫チップをカバーガラスに付着した水色で示されているPDMSチップから構成されている。チップは白で表示さ140μmの厚さのマイクロ流体チャネルが含まれています。中央マイクロチャンバーは、ぴったりと早い(ライトグリーンにcartooned) 第3齢ショウジョウバエの幼虫を上演フィットするように設計されています。金型を設計するために使用することができる正確な寸法を含むDXFファイルは、補足データとして提供される。スケールバー= 1.5ミリメートル。幼虫チップに幼虫をロードするための回路図の(BC)サイドの景色。幼虫はカバーガラス上で腹側を下に座って、その本体は、140ミクロンの深さマイクロチャンバー内にある。の20ml注射器は、真空吸気ポートに接続され、穏やかな真空を誘導するために使用される。ハロカーボン油PDMS-ガラス界面がマイクロチャンバー内の幼虫を制限気密シールの中に真空に拘束されている。このシールは、容易に可逆的である注射器からの圧力を解放することによって、その後、動物はすぐに運動性を取り戻す。直立顕微鏡(B)については、シリンジ真空がチップの上面から-50ポリエチレンチューブを介して接続されている。チップの「上」が両面テープを介して顕微鏡のステージに取り付けられている間に倒立顕微鏡(C)では、これらの接続は、チップの側面から作られる。
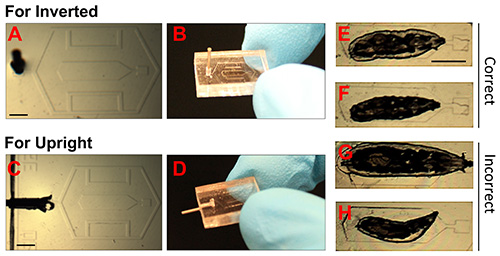
図2。PDMSチップの画像と幼虫の正確な位置決め。
(AD)。倒立直立顕微鏡用のPDMSチップを示す写真。 23 G分注針の先端は、真空(シリンジ)へ配管を介して接続を可能にする、真空ポートに挿入されている。スケールバー= 1.5ミリメートル。(EH)。 ショウジョウバエの幼虫のtrong>明視野像。正しく固定化された動物のEとFの例を示している。長い時間スケール(> 12時間)にわたって複数の画像を行われる場合にFが小さい動物が好ましい。Gが大きすぎる動物を示し、Hが誤って配置されている小動物を示している。スケールバー= 1.5ミリメートル。 拡大画像を表示するにはここをクリックしてください。
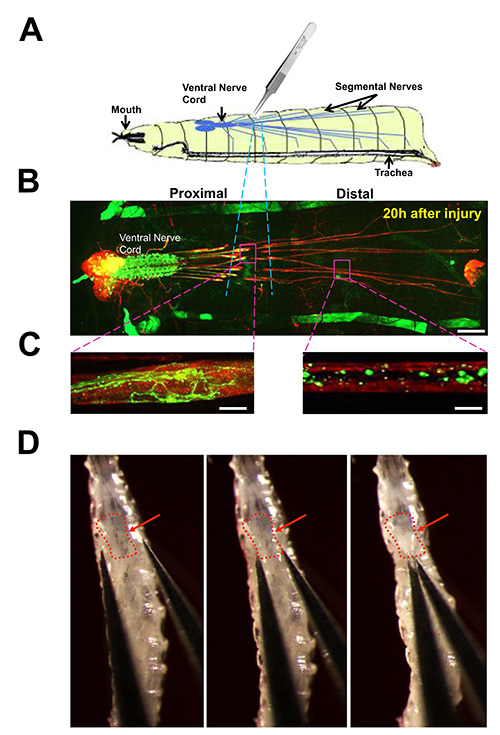
図3。 ショウジョウバエの幼虫分節神経の神経挫滅損傷。
(A)神経挫滅アッセイの漫画。 3 回目の中分節神経齢幼虫まで数5ピンセットで腹部キューティクルをつまんで押しつぶされています。動物由来の幼虫神経系(B)の表示が神経挫滅後の20時間後に解剖した。抗HRP抗体(赤)で神経細胞膜の免疫染色すると、脳の葉、腹側神経索、および運動ニューロンおよび感覚神経軸索が含まれている長い分節神経を強調しています。個々の運動ニューロンのサブセットは、M12-GAL4ドライバとUAS-mCD8-GFP(緑色)の発現を駆動することによって、ラベルが付いています。その軸索は分節神経を経由して、体壁の筋肉に投射しながら、これらのニューロンからの細胞体と樹状突起は、腹側神経索にある。 (このドライバはまた、一緒に動物の両側に前後縞として見ることができる、それぞれの幼虫hemisegmentための筋肉12でのGFPの発現を駆動)。クラッシュによる損傷領域は青色の点線でハイライト表示されます。 =70μmのスケールバー。(C)は、20時間、損傷後、損傷した軸索のビューを閉じます。左:近位軸索が発芽し、新たな成長遂げている。右:遠位軸索は、少しGFPが残っていると、ウォーラー変性や破片の除去による断片化されている。スケールバー=初期の第3齢幼虫における神経破砕の10以下である。(D)画像。腹側神経索に赤い矢印を指しています。テキストプロトコル(プロトコル3)に記載のようにクラッシュの位置は、第3のセグメントの底部に向かってである。 D中の画像は元々 Jに掲載されましたセル·バイオロジー191、211-223、DOI:10.1083(2010) 拡大表示を見るにはここをクリックしてください。
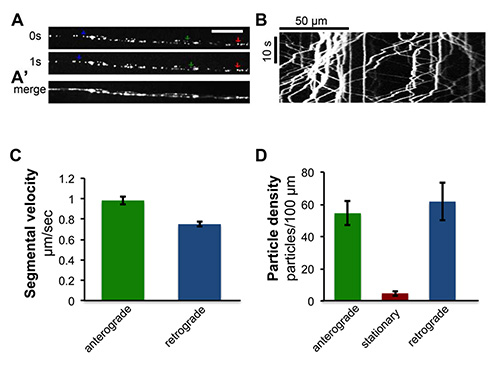
図4。ペプチド作動性シナプス小胞の軸索輸送のタイムラプスイメージング。ANF は、GFP、UAS-ANF-GFP 21でタグ付けされたラット心房性ナトリウム利尿ペプチドは、EVE-RRA-GAL4ドライバー22を使用して、特定の運動ニューロン内で発現させた。分節神経のライブイメージングは、軸索におけるANF-GFPラベルされたペプチド性小胞の迅速な輸送を明らかにしている。また、 ムービー、S1を参照してください。 (A)ライブタイムラプスイメージングから運動ニューロンの軸索のシングルフレーム。緑、赤と青の矢印はそれぞれ順行の例として、静止し逆行小胞を、示している。スケールバー=5μmである。(A ')映画から個々のタイムフレームはImageJのを使用して統合された。(B)ANF-GFP輸送のタイムラプスイメージングから生成カイモグラフは、1分間にまたがる単一のフレームの集まりから生成されました撮影時間はImageJ 23 'は複数カイモグラフ」プラグインを使用して。kymographsにセグメント化されたトレースの傾きから算出した平均を分節速度、(C)の定量化。緑色のバーPRESENTS順行分節速度(N = 543)、青色のバーは10 kymographsから小胞の逆行分節速度(N = 548)。粒子密度の(D)の定量化を提供します。粒子密度は、(緑色のバーで示されている)順行の数、10 kymographsから軸索の長さ100μmあたりの固定(赤いバーで示されている)と(青いバーで示されている)逆行性粒子を用いて測定した。この図のデータもら Ghannad-Rezaieで以前に出版された、PLoSのワン7(1)、e29869、DOI:0.1371/journal.pone.0029869(2012)。
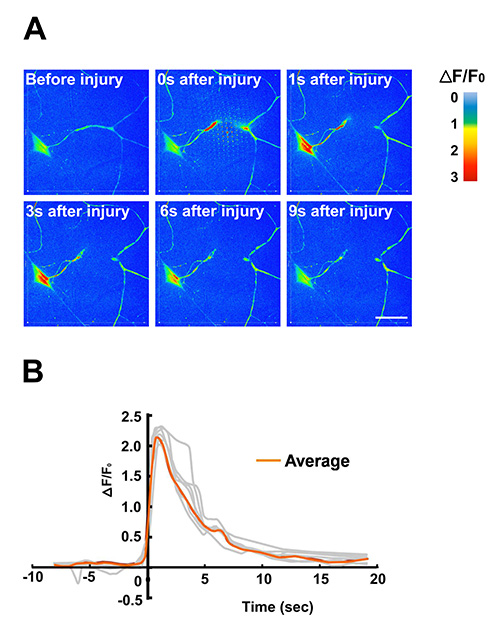
図5。レーザー顕微やカルシウムイメージングのための幼虫チップを使用すること。
クラスIV感覚ニューロンからの樹状突起は、パルスUV色素レーザーからの高出力レーザーパルスを用いによって離断さ。マイクロサージェリーのためのこの方法を使用するためのプロトコルは、他の場所で16見つけることができます。幼虫チップ内の効果的な固定化は、ライブイメージングによって研究される細胞内カルシウムレベルの急速な変化を可能にします。この例では、遺伝的にコード化されたカルシウム指示薬GCaMP3.0はPPK-GAL4ドライバを使用してクラスIV樹状樹枝状分岐(C4da)感覚ニューロンに発現させた。GCaMP3.0強度の(A)のタイムラプス画像を色に応じて色の偽だった経時的に強度の変化を示す輝度スケール。個々のフレームは5フレーム/秒で回転するディスク共焦点顕微鏡上に結像タイムラプスムービー( 動画S2)から抽出した。カルシウム動態の(B)の定量レーザー顕微に応じて。個々のニューロンの細胞体GCaMP3.0蛍光強度(ΔF/F0)の正規化された倍数変化ー(n = 7、灰色で示される)を時間に対してプロットした。平均しΔF/F0はオレンジ色で表現された。 GCaMP3.0強度のピーク上昇は、損傷後1〜2秒の間で観察された。バックグラウンドは、生G-CaMP3.0蛍光強度から差し引いた。この図のデータはまたGhannad-Rezaie ら、以前に公開された、(2012)PLoSのOne 7(1):e29869。 DOI:10.1371/journal.pone.0029869 12。
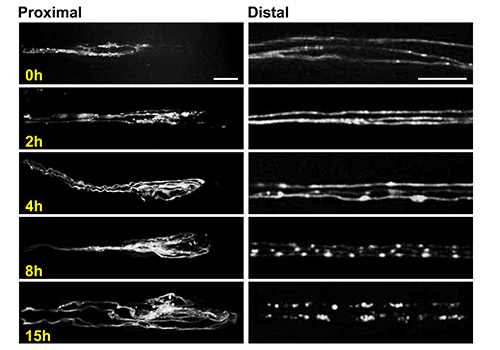
図6。幼虫チップを用いた撮像軸索発芽および変性。近位断端の代表的な共焦点画像(左)と遠位断端(右)オクトパミン運動ニューロン軸索の異なる時点での神経挫滅後。 図3Cに示すように、画像は、同様の場所で撮影した。これらのニューロンは、TDCを使用してUAS-mCD8-RFP導入遺伝子の発現を駆動することによって標識される2-GAL4ドライバー24,25。これらのニューロンの細胞体は、腹側神経索24にある。 3つの個々の軸索は、単一の神経分節内に見ることができ、容易に互いから解決される。これは、これらのニューロンのために15時間以内に完了した軸索を変性の断片化、などの個々の細胞事象の研究のための理想的な状況である。画像は、回転ディスク共焦点顕微鏡で63Xの倍率で幼虫チップを用いて生きた動物から得た。スケールバー=左パネル(近位切り株)のための10ミクロンと右のパネル(遠位断端)のための20ミクロンは。 拡大画像を表示するにはここをクリックしてください。
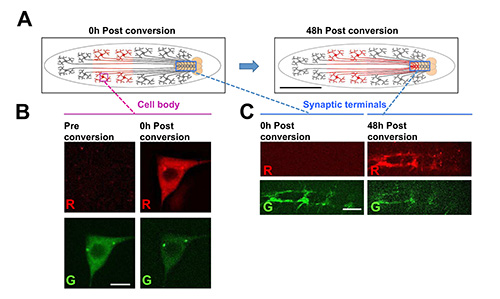
図7。幼虫を使用した生きた動物で、長い時間と距離でphotoconverted蛍光タンパク質を追跡するためのチップ。
この例では、photoconvertible蛍光タンパク質Dendra2 19の融合タンパク質は、チューブリンをαに融合、PPK-GAL4ドライバを使用して、クラスIV樹状樹枝状(C4da)感覚ニューロンにおけるUAS-Dendra2-α-チューブリントランス遺伝子から発現される光変換実験のための26。(A)の回路図。 C4daニューロンの細胞体は、周辺部にあると神経索内のシナプス末端を形成するために、分節神経を通して軸索を伸ばす。動物の後半における細胞体のサブセット内Dendra2-α-チューブリンは、水銀ランプ(左漫画)標準DAPIフィルターを使用して6秒間UV照射により光変換が施される。時間の後、photoconverted Dendra2-α-チューブリンは、腹側神経索におけるシナプス末端で検出することができる。これは、チューブリンタンパク質は固くがされたことを示し(約1〜2程度の)長い距離にわたって遊ばした。光変換前後のクラスIV感覚神経細胞体におけるDendra2-α-チューブリンの= 1ミリメートル(B)の例画像スケールバー。スケールバー=5μmである。(C)細胞体の光変換後0時間、または48時間のいずれかでクラスIV感覚ニューロンのシナプス端末の画像例。時間の後にシナプス終末でphotoconverted Dendra2-α-チューブリンの特定の外観は、タンパク質が軸索末端に細胞体から移動していることを意味します。全ての時点では、光変換および撮像幼虫チップで実施した。スケールバー=15μmである。 拡大画像を表示するにはここをクリックしてください。
映画のS1。レーザー顕微とC4daニューロンのカルシウムイメージング。パルスUVレーザをプリムを横断するために使用された進の樹枝状の枝。レーザ離断は、損傷部位で始まり、細胞体へ旅行GCaMP強度の急激な増加を誘導した。 UAS-GCaMP3.0 18は C4da特定PPK-GAL4ドライバー26を用いて発現させた。映画はGCaMP3.0の相対強度レベルを示すために、偽着色し。タイムラプスイメージングは5フレーム/秒で回転するディスク共焦点顕微鏡を用いて行った。
映画のS2の運動ニューロンにおけるANF-GFPの高速軸索輸送。
ANF はGFPでタグ付けされたラット心房性ナトリウム利尿ペプチド、UAS-ANF-GFP 21は 、EVE-RRA-GAL4ドライバー22を使用して、特定の運動ニューロン内で発現させた。幼虫分節神経内でこれらのペプチド性小胞の輸送は、回転ディスク共焦点顕微鏡を用いて300ミリ秒/コマで幼虫チップに画像化した。
補足Figure1(DXFファイル)
シリコンモールド製造のためのDXFファイル。ファイルは、4インチのシリコンウェーハ上にネガ型フォトレジスト·マスク(SU-8暗視野マスク)用に設計されている。二行目は、このプロトコルで使用される幼虫チップを作るための5の金型が含まれています。これらのチップ(行2)の各々は、初期段階第3齢幼虫に適合するように設計〜5.4ミリメートル×1.5ミリメートルチャンバを含む。 3行目(行3)はより小さな室(〜4.4ミリメートルX 1.5ミリメートル)が含まれていながら、最初の行(行1)は、より大きなチャンバー(〜5.4ミリメートル×2 mm)を含んでいます。これらは、それぞれ大小の大きさの幼虫を利用することができる。 = 2ミリメートルスケールバー。
ディスカッション
作ったり、幼虫チップを得た。
幼虫チップは、カバーガラスに付着したPDMSブロック( 'PDMSチップ」と呼ばれる)で構成されています。ステップ1のプロトコルは、SU-8鋳型が使用可能であると仮定すると、幼虫チップの製造および使用のための手順を説明します。 SU-8鋳型は、フォトリソグラフィ(詳細はGhannad-Rezaie ら 12を参照)、シリコンウエハ上に140μmの厚さのSU-8フォトレジスト層をパターニングすることによって微細加工される。 SU-8鋳型の微細加工が特殊な装置へのアクセスを必要とするように、我々は微細加工施設から、それを注文するお勧めします( 例 。ミシガン州14大学のLNF施設)、またはそれらに提供されているチップ設計を送信することにより、鋳物工場から補足ファイルとして。一つはPDMSチップ(異なるサイズの幼虫で使用するための、例えば )の設計を変更したい場合は、DXFファイル( 例えば AutoCADの)を扱うCADソフトウェアを使用することができる。 SU-8金型もMondalの説明に従って、社内で行うことができら。27多くの読者はそれが便利なだけで、自分のチップを製造する前に、テクニックを試すために、サンプルのPDMSチップを得かもしれません。これは、要求に応じて、自由に利用可能になります。
ライブイメージングのためのマイクロ流体 '幼虫チップ」を使用する:
幼虫チップ内の固定化方法は、動物の動きを制限するために、真空の適用を介して、麻酔薬の使用を避け、その代わりに圧力を伴う。動物は、複数の時間12用チップに固定化を生き残ることができますが、短い固定期間(5月15日分)をお勧めします。これは、細胞内カルシウムの変化、または高速軸索輸送など、関心のある多くの細胞事象を、画像化するための十分な時間である。これはまた、このようなレーザベースマイクロサージェリー、光退色、およびphotoconverなどの生きた動物で目的の操作のための十分な時間であるシオン。
単一の動物においてより長い期間にわたって長手方向にイベントを研究するために、動物は、チップ内に配置し、複数回撮像され、休止期間によって分離することができる。彼らは簡単な食料源と湿度を提供するようにグレープジュース寒天プレートは、イメージングセッション間で休憩に最適です。各セッションは(下記、トラブルでパート2を参照)が、動物にダメージを与えるためのいくつかのリスクがあるため、複数のイメージングセッションは、程度に幼虫の生存率に影響します。動物は、日常的に50%を超える生存率で二日間にわたって> 5回撮像することができる。動物を麻酔していないので、彼らはすぐに、チップ内の真空度のリリース後に健康で、運動性である。そこ撮像セッション間の回復時間のための必要性が存在しないため、セッションの間の時間間隔はフレキシブルであり、実験の目的に合わせることができる。
トラブルシューティング:
最も一般的な技術である幼虫チップおよび推奨する解決方法は以下の通りと訴える。
(1) 動物があまり移動している。あまりにも多くの移動度は、撮像シーンを妨害する可能性がある。幼虫チップで、このための最も一般的な理由はa)の動物は、チップには小さすぎる、またはb)固定化工程の間に適用される真空圧が危険にさらされている。このプロトコルで説明幼虫チップは早期第3齢幼虫を上演するために設計されています。動物のための最適なサイズは、(前後軸に沿って)、長さ3.5〜4ミリメートルである。抵抗がハンドルに感じられるまで真空圧が十分であることを確実にするために、注射器2〜2.5ミリリットルを引っ張ったり、。真空が作動していることOne指示が周囲チャネル内の小さな気泡が真空源に向かってゆっくりと移動して見ることができることである。別の指標は、チップが(上から持ち上げたときカバーガラスは常にチップと一緒に旅行べきことであり、これは、チャンバを輸送するための方法をお勧めします幼虫は配置され、真空)にしたら。チューブに亀裂がある場合には真空が損なわれる可能性がある、または油は、チューブ内に存在する場合。これにより、容易に針の先端と(ステップ1.6から1.14まで)、ポリエチレン-50チューブを分配G 23置換することによって対処することができる。
(2)動物は、チップ内の画像形成後に死亡した。 手順は、動物の際に最小限のストレスを引き起こすためのものであり、野生型の遺伝子型の動物であっても、チップ12上の固定化の時間の後、> 90%の生存率を有している。いくつかの遺伝子型は、チップのストレスが少なく弾力される可能性があるので、最初に野生型動物(たとえば、 カントンS)の固定化技術を生き残ることを確認してください。 A)致死のための最も一般的な原因は、幼虫の不正確な位置決め( 図2G-H参照 )である。クチクラ、頭部または気管の部分が完全にチャンバ内にない場合、それらは固定化の際に損傷を受けることがあり、そしてaチップ(> 4mm)を大きすぎる幼虫が生存する可能性は低い。 B)致死はあまり一般的な原因は、過剰な圧力や真空チップのロードを使用することである。適切チップに配置されると、真空によって発生した圧力は十分に許容される。しかし真空から、または動物を配置する初期のいずれかの過剰な圧力は、問題となることがあります。それは、正しいサイズの野生型幼虫を試験によって経験的に必要とされる圧力の程度を学習することをお勧めします。あまりにも多くのハロカーボンオイルは、動物の気管をカバーしていた場合はC)動物は、潜在的に長期生存の問題を持つことができる。油は、チップのいくつかの重要な役割を果たしている:それは、結像光学系の間に真空を作成するために重要であり、チップ内の乾燥を妨げる。しかし、過剰な油は避けるべきである。 (これはまた、真空を損なう、チューブ、シリンジ内の油につながることができます)。そして提案されたプロトコルのコートオイルと幼虫のちょうど腹側、Rイメージングのための最終的なカバーガラスに転送する前に、きれいなカバースリップ上の幼虫の配置によって余分な油をemoves。 D)光毒性は、撮像セッションから体験することができます。任意のライブイメージング·アプリケーションと同様に、最高の高感度カメラまたは検出器を用いて達成される低強度のレーザ光で短い露光時間を使用することが理想的である。水銀光源によって作成された広域スペクトル光を含む、UV光での照射を最小化しようとする。
他の問題と今後の方向性:
この方法は麻酔薬を使用しないので、動物の心が打ち続けています。これは、より多くの他よりもいくつかの場所で画像化に影響を与えるいくつかの避けられない機動性を作成します。ここでの例は、腹側神経索分節の神経及び体壁を容易に心拍からの干渉なしに撮像することができることを実証している。ハートビートは、撮像に影響を与える場合において、定期的な運動は、時々で補正することができる解析ソフトウェア(たとえば、ImageJのための手ブレ補正プラグイン)。個々のオブジェクトは、高速時間スケールで(高速軸索輸送については、例えば約1ミクロン/秒)または非常に遅い時間スケールで(数分から数時間)を移動している場合に適しています。しかし、ときにオブジェクト(S)の速度と方向の範囲に関心が移動するのではなく、ハートビート誘起動きを補正するために困難になることができます。
もう一つの問題は、動物から動物へ、あるいはチップ内の同じ動物の複数の撮像セッション間の光学系のわずかな変動である。深い関心のある物体が動物内で、より大きなこの変化はなります。分節性神経および腹側神経索は、次いで、通常は定期的な顕微鏡内に結像される動物深すぎる。しかし幼虫チップで経験穏やかな圧力は非常に近く、キューティクルやカバーガラスにこれらの構造をプッシュします。カバーガラスからのこれらの構造の正確な距離は、TRから小さな変化を持つことになります裁判にIAL。オブジェクトのための変化が、このような感覚ニューロンの細胞体として、キューティクルを閉じて、小さい。これは、光学系の変動を考慮するため、動物および独立した試験の大多数を利用すること、特に強度の測定を行うため、重要である。
ここに示す例は、神経細胞内のプロセスに焦点を当てているが、アプローチは、顕微鏡対物レンズの焦点深度内にもたらすことができる動物で任意の構造を画像化するために従順でなければならない。これは、キューティクル、体壁の筋肉、およびそれらのNMJを含む。動物の腹側に気管、潜在的に消化管のどの部分にも画像化されることがあります。動物はまた、背側表面近傍の構造の短期イメージングのためのカバーガラスに向かってその背側に配置することができる。動物内の深い画像構造化する能力を用いる顕微鏡対物レンズの作動距離によって制限される。このようなIMなどの構造aginalディスクは、高倍率( 例えば 40倍)の目標にはアクセスできません。
このプロトコルで説明幼虫チップは(3.5〜4ミリメートルの大きさの範囲の)早期の第3齢段階で幼虫のために設計されています。しかし、多くの興味深い質問が異なる幼虫の段階で画像化を必要とする。後期第3齢に対応するために2 回目の幼虫、以上のチップを収容するための小さなチップを容易に同じ原理を用いて設計することができる。 (補足図1は、変更された室のサイズのシリコン金型を作るための容易に変更可能なDXFファイルが含まれています)。可逆的シールの単純な原理であっても、Cなどの他の生物に適用することができる主な変種はチャンバサイズであることと虫やゼブラフィッシュ、。有用な将来の方向は、スクリーニング目的に使用する、一度に多くの動物を固定化することができ、チップを設計することである。しかし、このために、設計が大幅に異なる必要があるであろうチップ内に動物を配置する問題は独立して各動物のために対処する必要がある現在のデバイスから。
幼虫末梢神経傷害応答を研究するための神経挫滅アッセイ:
幼虫分節神経のため、ここで説明した神経挫滅アッセイは、 ショウジョウバエの末梢軸索の損傷を導入するための簡単な方法です。この方法の利点は、a)それは、ショウジョウバエの研究室(実体顕微鏡用のCO 2源と鉗子)に見られる標準のツールで行うことが簡単であること、b)には、多くの動物のために迅速に行うことができ、損傷後の神経コードの生化学的解析を行っ14実現可能なこと、c)この傷害に対する分子や細胞応答は、14,15,28高い再現性であり、脊椎動物の神経細胞29,30にも重要なプロセスを発見するために使用することができます。
神経細胞を損傷するための代替方法がfocuことですSA高出力レーザー、例えばレーザー顕微17,31-33を経由して軸索を切断するため、パルスUVまたはフェムト秒レーザー、。幼虫のチップは、マイクロサージェリーのために動物を配置するための理想的な方法です。しかし、前述の試験で、間の光学における小さな差異に、レーザーベースの方法は、特に幼虫分節神経において、幼虫に再現することがより困難になることができます。また、レーザベースの軸索損傷は、(多数の動物を有する)を大規模に行うことはより困難であるため、各動物を位置決めするために多くの時間を必要とする。
トラブルシューティング:
神経挫滅から最も一般的に発生する技術的な問題は、内臓の損傷による死亡である。クラッシュを実施するときには、腹側神経索、唾液腺、または腸を挟まないようにすることが重要である。これは、キューティクルを穿刺しないことも重要です。これらの問題は、最高のキューティクルsurfacに45°の角度でピンセットを持って来ることによって回避される電子( 図3参照)。
鉗子の品質は、その後クラッシュと生存の有効性に大きな影響を与えます。我々はDumostar数5鉗子をお勧めします。その切れ味を保持するには、鉗子は、注意して取り扱う他の目的に使用されていない、と彼らは鈍いか、曲がっになったら交換する必要があります。
動物の大きさはまた、クラッシュの有効性に影響を与えることができる。 (長さ3ミリメートル未満)の小さな動物ははるかに少ない傷害を生き残る可能性が高い。大型動物では、( 第3齢を徘徊)、それは神経を見つけ、大きな唾液腺および腸への損傷を回避することがより困難であり、蛹化前に損傷応答を研究するための短い時間がある。神経挫滅を最 も効果的に(前後軸に沿った長さが〜3〜4.5ミリメートルである)初期の第3齢幼虫で行われる。
動物が上に上昇する食料源が影響する可能性クラッシュ後のキューティクルと生存の強さ。これは、標準的な酵母 - グルコースのレシピから作られた食品中の動物を調達することをお勧めします。
効果的にクラッシュを行う方法を学習するための最良の方法は、最初にプライマリ生存を達成するという目標(とは蛹化)クラッシュ後の24時間で、多くの動物をで練習することです。初心者は、通常、低い生存率( 例えば 、10%)を有するが、技術が学習されると、生存率は約90%に達することができる。
他の問題と今後の方向性:
クラッシュアッセイは、損傷部位と軸索と損傷部位より遠位シナプスの変性に軸索の近位の発芽を研究するための強力な方法を提供する。変性の速度が異なるニューロンタイプ間で異なりますが、それらは傷害アッセイの再現性を証明するものを提供し、特定の神経細胞タイプの中で、高度に再現可能である。
対照的に、「回生」は出芽近位の軸索で観察された応答は、研究により困難である。分節神経のすべての軸索は(例えば、 図6と図3を参照)損傷部位に近い発芽広範な開始。しかし発芽の程度はニューロンからニューロンへの変化し、定量化することは困難であることができます。出芽における類似度変動性はUVパルス化色素レーザーを用いて導入分節神経の単一運動ニューロンのより局所性病変後に観察することができる。私たちは、発芽のnondiscriminate方向性が分節神経の指導の手がかりがないことによるものであることを解釈する。これとは対照的に、近くに自分の細胞体へのレーザにより負傷した感覚ニューロンの軸索は、失われた軸索34と同じ方向に新たな軸索 成長を受ける。動物のこの領域における軸索は、おそらく再生軸索の指導のためのより具体的な位置情報にさらされている。分節神経内の環境はずっとresemblanを持っていることはほとんどありませんもともと胚におけるそれらの誘導中にナビゲートする軸索は、従って再生軸索を案内する情報を有することが期待されていないことを環境にCE。
分節神経挫滅アッセイを使用して再生を研究するための他の制限は、動物が受ける前に負傷した感覚と運動神経軸索はまだ彼らの目標を達成するために(0.25〜1ミリメートル)を覆うようにかなりの距離があり、限られた時間枠(<3日間)ということです蛹化。最近の研究では、 第3齢幼虫35の長さをトリプルprothoraciotropicホルモン受容体の遺伝子操作を同定した。この操作は9ではなく3日間に、大幅に損傷後の神経細胞の回復と変性を研究するための時間枠を拡張します。これは損傷がシナプスエンディングに近い誘導される場合は特に、そのシナプス後の目標とそのような傷ついた軸索の再接続などの新しいイベントを、観察するのに十分な長さがあります。
開示事項
著者らは、競合する経済的利益を宣言していません。
謝辞
この作品は、(CACへによってR00MH080599、ノースカロライナ州にR 21 NS062313、およびNS069844)国立科学財団、(認可番号CACへのIOS-0842701)、および国立衛生研究所によってサポートされていました。私たちは、技術サポート、フライラインのブルーミントンストックセンターのジェームズ·シャッツ、エミリーハン、とレニチュオンを承認したいと思います。すべてのチップは、ミシガン大学でルーリーナノファブリケーション施設で製造された。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 mm Polyethylene tubing | Fisher Scientific | 14-170-11B | Polyethylene tubing, I.D. = 0.023 in O.D. = 0.038 in |
| 1 mm Polyurethane tubing | Fisher Scientific | BB521-63 | Polyurethane tubing, I.D. = 0.063 in O.D. = 0.125 in |
| Barb to barb connector | Bio Rad | 732-8300 | 0.8 mm barb to barb connector |
| 3-way Stopcock valve | Bio Rad | 732-8104 | Screw on valve for the syringe |
| Syringe (20 ml) | Fisher Scientific | 14-817-33 | Screw on 20 ml syringe for generating vacuum |
| Dispensing needles, 23 G (0.4 mm I.D., 0.6 mm O.D.) | McMaster-Carr | 75165A684 | Needle for outlet connection |
| Dispensing needles, 21 G, (0.6 mm I.D., 0.8 mm O.D.) | McMaster-Carr | 75165A679 | Needle for outlet connection |
| Halocarbon oil | Sigma | H8898 | Halocarbon oil 700 |
| Dumostar Number 5 Forceps | Roboz | RS-498 | For nerve crush |
| PDMS Kit (Base and curing agent) | Ellsworth | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard 184 Silicone Encapsulant 0.5 kg Kit Clear |
| Glass Coverslips | Fisher Scientific | 12-544-C | 24 mm x 40 mm (thickness according to recommendation for your microscope objective) |
| Disposable Plastic Cup (9 oz) | |||
| Plastic coffee stirrer stick | |||
| Razor Blade | |||
| Grape juice agar plates | See http://cshprotocols.cshlp.org/content/2007/4/pdb.rec10925 for recipe |
参考文献
- Pilling, A. D., Horiuchi, D., Lively, C. M., Saxton, W. M. Kinesin-1 and Dynein are the primary motors for fast transport of mitochondria in Drosophila motor axons. Mol. Biol. Cell. 17, 2057-2068 (2006).
- Gunawardena, S., et al. Disruption of axonal transport by loss of huntingtin or expression of pathogenic polyQ proteins in Drosophila. Neuron. 40, 25-40 (2003).
- Miller, K. E., et al. Direct observation demonstrates that Liprin-alpha is required for trafficking of synaptic vesicles. Curr. Biol. 15, 684-689 (2005).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat. Protoc. 2, 3285-3298 (2007).
- Schmid, A., et al. Activity-dependent site-specific changes of glutamate receptor composition in vivo. Nat. Neurosci. 11, 659-666 (2008).
- Fuentes-Medel, Y., et al. Glia and muscle sculpt neuromuscular arbors by engulfing destabilized synaptic boutons and shed presynaptic debris. PLoS Biol. 7, (2009).
- Andlauer, T. F., Sigrist, S. J. . Building an imaging chamber for in vivo imaging of Drosophila larvae. , 476-480 (2012).
- Sandstrom, D. J. Isoflurane reduces excitability of Drosophila larval motoneurons by activating a hyperpolarizing leak conductance. Anesthesiology. 108, 434-446 (2008).
- Sandstrom, D. J. Isoflurane depresses glutamate release by reducing neuronal excitability at the Drosophila neuromuscular junction. J. Physiol. 558, 489-502 (2004).
- Mondal, S., Ahlawat, S., Rau, K., Venkataraman, V., Koushika, S. P. Imaging in vivo neuronal transport in genetic model organisms using microfluidic devices. Traffic. 12, 372-385 (2011).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic chips for in vivo imaging of cellular responses to neural injury in Drosophila larvae. PloS one. 7, (2012).
- Schmid, A., Sigrist, S. J. Analysis of neuromuscular junctions: histology and in vivo imaging. Methods Mol. Biol. 420, 239-251 (2008).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J Cell Biol. 191, 211-223 (2010).
- Xiong, X., Collins, C. A. A conditioning lesion protects axons from degeneration via the Wallenda/DLK MAP kinase signaling cascade. J. Neurosci. 32, 610-615 (2012).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), (2011).
- Williams, W., Nix, P., Bastiani, M. Constructing a Low-budget Laser Axotomy System to Study Axon Regeneration in C. elegans. J. Vis. Exp. (57), (2011).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Chudakov, D. M., Lukyanov, S., Lukyanov, K. A. Tracking intracellular protein movements using photoswitchable fluorescent proteins PS-CFP2. 2, 2024-2032 (2007).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat. Biotechnol. 24, 461-465 (2006).
- Rao, S., Lang, C., Levitan, E. S., Deitcher, D. L. Visualization of neuropeptide expression, transport, and exocytosis in Drosophila melanogaster. J. Neurobiol. 49, 159-172 (2001).
- Fujioka, M., et al. Even-skipped, acting as a repressor, regulates axonal projections in Drosophila. Development. 130, 5385-5400 (2003).
- Rietdorf, J., Steitz, A., Heidelberg, E. Linear unmixing macro for ImageJ. European Advanced Light Microscopy Network. , (2004).
- Koon, A. C., et al. Autoregulatory and paracrine control of synaptic and behavioral plasticity by octopaminergic signaling. Nat. Neurosci. 14, 190-199 (2011).
- Yarali, A., Gerber, B. A Neurogenetic Dissociation between Punishment-, Reward-, and Relief-Learning in Drosophila. Front. Behav. Neurosci. 4, (2010).
- Kuo, C. T., Jan, L. Y., Jan, Y. N. Dendrite-specific remodeling of Drosophila sensory neurons requires matrix metalloproteases, ubiquitin-proteasome, and ecdysone signaling. Proc. Natl. Acad. Sci. U.S.A. 102, 15230-15235 (2005).
- Mondal, S., Ahlawat, S., Koushika, S. P. Simple Microfluidic Devices for in vivo Imaging of C. elegans, Drosophila. J. Vis. Exp. (67), (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biol. 10, (2012).
- Shin, J. E., et al. Dual leucine zipper kinase is required for retrograde injury signaling and axonal regeneration. Neuron. 74, 1015-1022 (2012).
- Watkins, T. A., et al. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury. Proc. Natl. Acad. Sci. U.S.A. 110, 4039-4044 (2013).
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nat. Methods. 5, 531-533 (2008).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J. Vis. Exp. (24), (2009).
- Stone, M. C., Nguyen, M. M., Tao, J., Allender, D. L., Rolls, M. M. Global up-regulation of microtubule dynamics and polarity reversal during regeneration of an axon from a dendrite. Mol. Biol. Cell. 21, 767-777 (2010).
- Miller, D. L., Ballard, S. L., Ganetzky, B. Analysis of synaptic growth and function in Drosophila with an extended larval stage. J. Neurosci. 32, 13776-13786 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved