このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ミラー·ユーリーの実験を行う
要約
ミラー·ユーリーの実験は、生命の起源への可能な関連性有機化合物の非生物的合成に関する先駆的な研究であった。単純なガスがガラス装置に導入し、原始地球の大気海洋システムにおける落雷の影響をシミュレートし、放電を行った。実験はそれから採取した試料は生命の化学的ビルディングブロックについて分析し、この後、一週間行った。
要約
1953年、スタンリー·ミラーは、原始地球の大気·海洋のシステムをシミュレートするために構成された装置を使用して、簡単なガス状の出発物質からの生体分子の生産を報告した。水が同時にあったミラーは、その週の放電に、還流下で、この混合物を施した、装置内に水200ミリリットル、H 2を 100 mmHgで、CH 4の200 mmHgの、およびNH 3の200 mmHgのを導入しました加熱された。本稿の目的は、単純化された3Lの反応フラスコを使用して、ミラー·ユーリー型火花放電実験を行うために使用することができる一般的な実験プロトコルを読者に提供することである。実験は、高電圧放電への可燃性ガスを暴露含まれているため、爆発の危険性を軽減する重要なステップを強調する価値がある。この研究に記載された一般的な手順は、放電実験のさまざまな設計および実施するために外挿することができる原始惑星の環境をシミュレートすることだ。
概要
地球上の生命の起源の性質が最も不可解な科学的問題の一つである。 1920年代にロシアの生物学者アレクサンダー·オパーリンと英国の進化生物学者と遺伝学者ジョン·ホールデンは、化学進化を促進した可能性の有機化合物を含む原始地上海を記述する、「原始スープ」 の1,2の概念を提案した。化学者は、有機分子が初期地球上で簡単な出発物質から合成されている可能性がどのように理解することを目的と意図的な実験室での研究を実施し始めたが、それは1950年代までではなかった。この目的を達成するために最初の報告の一つは、1951年3水溶液のCO 2ソリューションの照射からのギ酸を合成した。
1952年、シカゴ大学、その後の大学院生スタンレー·ミラーは、可能性を評価するための実験をすることについてハロルド·ユーリーに近づいた、有機化合物生命の起源のための重要なものは、初期地球上abiologically形成されている可能性があります。実験は、プリミティブ地球をシミュレートするように設計特注のガラス製装置( 図1A)を用いて行った。ミラーの実験は、初期の海を表す、液体の水溜めの存在下で、初期の雰囲気を表わすガスの混合物に、放電の作用によって雷を模倣。装置はまた、それぞれ、加熱マントルおよび凝縮器の使用を介して蒸発、沈殿をシミュレートした。ミラーが使用された装置についての具体的な詳細は他の場所で4見つけることができます。スパークの週間後、フラスコ内の内容物を視覚的に形質転換した。水が濁った、赤みを帯びた色5と電極4上に蓄積黄褐色の物質に変化した。この画期的な作品は、シミュレートされた原始地球環境下での生体分子の最初の意図的な、効率的な合成であると考えられている。
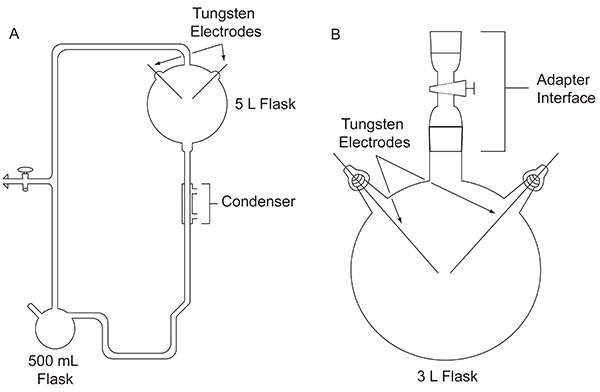
図1。このホワイトペーパーで説明の装置の2つのタイプとの比較。オリジナルのミラー·ユーリーの実験(A)と、ここで概説したプロトコル(B)に使用される単純化された装置に用いられる古典的な装置。 拡大画像を表示するには、ここをクリックしてください 。
ミラーの古典的な実験で、火花放電実験の多数の変形、他のガス混合物を用いて、例えば、可能な初期地球の様々な条件の下で生活のための重要な有機化合物を産生する妥当性を探求するために実施した結果から1953年発行後。例えば、CH 4 6を検出しなかったが> / H 2 O / NH 3 / H 2 Sガス混合物は、符号化された硫黄含有α-アミノ酸を生産する能力について試験した。放電に付しCH 4 / NH 3混合物のガスクロマトグラフィー-質量分析(GC-MS)分析は、酸前駆体7アミノ酸れているα-アミノニトリルの合成を示した。 1972年に、最初のORO 8( 図1B)によって導入簡単な装置を用いて、ミラーらは、これまでにマーチソン隕石で確認されたコード化されたα-アミノ酸9および非タンパク質のアミノ酸10の全ての合成を実証放電にCH 4、N 2、NH 3を少量施すことにより。以降では、この簡略化された同一の実験設計を用いて、H 2 Oを含むガス混合物は、N 2、CH 4、CO 2、またはCOを学生に引き起こした大気中の11種の酸化状態の関数として、シアン化水素、ホルムアルデヒド、及びアミノ酸の収率dyは。
年間の代替実験計画の探査に加えて、重要な分析の進歩はミラーがアクセス権を持っていた技術によって促進されていたであろうよりも、最近になってミラーによってアーカイブ放電実験サンプルのよりプロービング調査を支援ミラーの古典的な実験で、以降に発生した1950年代。ミラーの火山初めて1955 4に報告された実験12、および1958年のH 2 S含有実験13は、多種多様を形成していることが示され、大きな存在量、古典的な実験よりも、多数のアミノ酸およびアミンの、そのその多く含むた以前に火花放電実験において同定されていなかった。
このホワイトペーパーに記載した実験を用いて行うことができるガス混合物の様々な。典型的には、少なくとも、そのような実験は、C-担持ガス、N含有ガス、及び水を含有する。いくつかの計画で、ガスのほぼ任意の混合物を探索することができ、しかし、それはシステムのいくつかの化学的な側面を考慮することが重要である。例えば、水相のpHは、そこに14を発生する化学に大きな影響を持つことができます。
ここで説明する方法は、ミラー1972の刊行物9,10に記載のように、単純化された3リットルの反応容器を用いてミラー·ユーリーの実験に似て火花放電実験を実施する方法を研究者に指示するように調整されている。この実験は、可燃性ガスに作用する高電圧電気アークを伴うので、それは、例えば、メタンまたは一酸化炭素のような還元炭素含有ガスの燃焼時に発生する可能性があり、爆発の危険性を排除する反応フラスコからO 2を除去することが重要であるまたは反応oを酸素とのF、H 2。
ここで説明する実験を行う準備をする際に留意すべきである追加の詳細があります。第一のガラス真空ラインと加圧ガスを扱うときはいつでも、両方の爆縮の固有の危険性が存在すると、過加圧しているため、保護メガネを常に着用しなければならない。第二 に、実験は、通常、大気圧未満で行われる。これは、マニホールドと反応フラスコに圧力を過剰の危険性を最小にする。ガラス製品は、しかし、1気圧以上の圧力が推奨されていない、大気圧下で以上定格することができる。水不溶性のH 2が (例えば、CH 4およびNH 3など)に減少ガスから解放されるような圧力は、これらの実験で増加する可能性があります。過加することにより、爆発をもたらす燃焼を誘発すること、大気中のO 2を反応フラスコを入力できるようにすることができ、シールの漏洩につながる可能性がある。第三に、それは実験のバリエーションを実施するこのプロトコルの変更は、安全でない状況が作成されないように、慎重な計画が必要であることを心に留めておくべきである。第四に、それは非常に有望な実験者が丁寧に何回か前に彼または彼女は潜在的な落とし穴に精通しており、必要なすべてのハードウェアが利用可能で、場所にことを確認するために、この実験を試みるプロトコル全体を通読することをお勧めします。最後に、可燃性ガスを含む実施した実験では、実験者のホスト機関の環境·健康·安全部門のガイドラインへの準拠を必要とする。いずれの実験を進める前に、これらの推奨事項を遵守してください。ここプロトコルで説明するすべての手順では、著者のホスト機関の環境·健康·安全に関するガイドラインに準拠している。
プロトコル
1。マニホールド/真空システムのセットアップ
- 反応フラスコにガスを導入するために、ガラスマニホールドを使用する。このマニホールドは、購入または構築ガラス吹き込み設備により、しかし真空システム、ガスシリンダー、真空計、および反応容器に接続することができる真空気密ポートを含まなければならないことができる。
- マニホールドバルブがすりガラスのジョイントとガラスプラグを使用。プラグ上のすべてのOリングが必要なシールを作ることが可能であることを確認してください。ガラスジョイントを使用する場合、必要に応じて、真空グリース十分な量の、シールを作るために適用することができる。シリコン真空グリースは、潜在的な有機汚染を回避するために使用することができる。
- マニホールドにガラス栓を使用してください。シールを作るために必要な真空グリースの最小量を適用する。
- マニホールド体積を測定。このボリュームは、3 Lの反応フラスコ中の最終のガス圧に関連する計算に使用され、可能な限り正確に知られるべきである。
- マニホールドは、同時にすべてのガスボンベを収容するのに十分な接続を持っていない限り、マニホールドに一度に1シリンダーに接続します。この接続は、マニホールドは、周囲の雰囲気から単離することを可能にするタップ挙げられる。
- 適切なクリーンな不活性、および化学物質を使用し、マニホールドにガスボンベを接続する抵抗性チューブとultratorr真空用継手を漏らす。 Ultratorr継手は、使用される場合には、指で締めなければならない。
- マニホールド、<1 20mmHgの真空を確立することができる真空ポンプに接続します。真空ポンプ排気はヒュームフード内に配置され、又は他の手段によって適切に通気されるべきである。
- 真空の迅速な達成を確実にするために、ポンプを保護するために、マニホールドと真空ポンプの間にトラップを挿入します。それがポンプに入るの例えばNH 3、CO 2およびH 2 Oのような揮発性物質を防ぐことができますように、液体窒素フィンガートラップが推奨されます。ケアはワシントンの際、トラップされた揮発性物質として、注意が必要ですrming、マニホールドを過圧とガラスの破裂の原因となります。
- マニホールド、1 mmHgの解像度以上が可能な圧力計や他の真空計に接続します。様々な装置を用いることができるが、水銀はかなり非反応性であるように、水銀血圧計、又はマクラウドゲージが好ましい。
- 測定し、適切な温度計を用いて周囲温度を記録します。
2。反応フラスコの調製
- 有機汚染物質を除去するために、使用前に空気中で少なくとも3時間、500℃ですべてのガラス器具を加熱する。
- 優しくきれいな実験室でのワイプおよびメタノールで洗浄し、空気中で乾燥させることによりタングステン電極を清掃してください。
- 3 Lの反応フラスコに超純水200ml(18.2MΩcmで、<5ppb以下のTOC)を注ぐ。
- EX中に水溶性のガスや反応物の混合の迅速な溶解を確保する前洗浄、滅菌、電磁撹拌棒を導入periment。
- フラスコ内の約1cmで区切られたヒントを、真空グリース最小限の量を使用した3リットルの反応フラスコにタングステン電極を取り付けます。クリップで固定します。
- 3リットルの反応フラスコの首に内蔵のコックをアダプタを挿入し、クリップで固定します。
- アダプタを介してガスマニホールドに3リットルの反応フラスコに取り付けます。フラスコの安全を守るため、クリップやクランプを使用してください。
- 軽く良好な真空シールを確保するためにすべての接続をグリース。
- バルブ6とコック1( 図4)を除いて、多様体上のすべての弁やコックを開き、マニホールドを排気する真空ポンプの電源をオンにします。 1 mmHgの<の安定した真空測定値が達成された後、開閉弁1とマニホールド、真空漏れがないかチェックするために〜のために15分を座ってすることができます。何も検出されなかった場合、2.8に進む。漏れが特定され、固定されるまで、それ以外の場合は様々な接続のトラブルシューティングを行います。
- A反応容器に、磁気撹拌をpply。開放バルブ1及び止めコック1圧力は<1mmHgまでに達するまで、3 Lの反応フラスコのヘッドスペースを排気する( 図4)。
- ( 図4)バルブ1を閉め、3リットルの反応フラスコ内の圧力を監視します。測定された圧力は、水の蒸気圧を増やす必要があります。漏れがないことを確実にするために、この段階では〜5分待ってください。バルブ1は、このステップの間、閉鎖されている間の圧力(圧力計で読むように)が増加する場合は、コック1のリークや、様々な反応フラスコの接続を確認してください。リークが検出されない場合は、次のステップに進みます。
3。 NH 3ガスの導入
- NH 3の200 mmHgの反応フラスコ中に導入されるようマニホールドに導入するガス状NH 3のに必要な圧力を計算する。これを行う方法の詳細については、ディスカッションセクションで提供されています。
- 開閉弁マニホールドに任意のガスを導入する前に、1〜6、及び止めコック1( 図4)。他のバルブとストップコックを開いたままにしておきます。
- 小さ な圧力(約10 mmHgの)まで、マニホールドに、NH 3を導入達し、その後バルブ1( 図4)を開くことにより、<1 20mmHgの圧力にマニホールドを避難されています。 3回繰り返します。
- ステップ3.1で決定された圧力に達するようにマニホールドに、NH 3を導入。
- 3 Lの反応フラスコにNH 3が200mmHgを導入するための開いた止めコック1( 図4)。 NH 3を反応フラスコ中の水に溶解すると、圧力が徐々に低下する。
- 圧力が落下、近くコック1( 図4)を停止し、圧力計で読み取る圧力を記録する。この値は、フラスコ内部の圧力を表し、それ以降のマニホールドに導入される他のガスの圧力を計算するために使用される。
- 開放弁1( 図4)<1 20mmHgの圧力にマニホールドを排気する。
- ( 図4)バルブ2を閉じ、マニホールドから、NH 3ガスシリンダーを外します。
4。 CH 4の導入
- CH 4の200 mmHgの3 Lの反応フラスコ中に導入されるように、マニホールドに導入されるCH 4の必要な圧力を計算する。例の計算は、ディスカッションのセクションに示されています。
- マニホールドに、CH 4ガスシリンダーを接続します。
- バルブ6とコック1( 図4)を除いて、すべてのバルブとストップコックを開き、<1 20mmHgの圧力にマニホールドを避難。
- 開閉弁1マニホールド( 図4)避難された後。
- 小さ な圧力(約10 mmHgで)が得られるまでマニホールドにCH 4を導入する。これは、任意の汚染ガスがFRのラインをパージOMのステップの前にある。 <1 mmHgのマニホールドを排気するバルブ1( 図4)を開きます。 2Xよりを繰り返します。
- ステップ4.1で算出した圧力に到達するまでマニホールドにCH 4を導入する。
- 3 Lの反応フラスコにCH 4が200mmHgを導入するための開いた止めコック1( 図4)。
- CH 4の意図された圧力一旦閉じるコック1は、3 Lの反応フラスコ( 図4)に導入し、圧力計によって測定された圧力を記録されている。
- <1 mmHgのマニホールドを排気するバルブ1(図4)を開きます。
- ( 図4)バルブ2を閉じ、マニホールドからのCH 4気筒を外します。
5。さらにガス( 例えば N 2)の導入
- この時点で、追加のガスを導入する必要がない。しかし、必要に応じて、それは、N 2の100 mmHgのを追加することをお勧めします。この場合、N 2の100mmHgの3 Lの反応フラスコ中に導入されるように、マニホールドに導入されるN 2に必要な圧力を計算する。例の計算は、ディスカッションのセクションに示されています。
- マニホールドにN 2ガ スシリンダーを接続します。
- バルブ6とコック1( 図4)を除いて、すべてのバルブとストップコックを開き、<1 20mmHgの圧力にマニホールドを避難。
- 開閉弁1マニホールド( 図4)避難された後。
- 小さ な圧力(約10 mmHgで)が得られるまでマニホールドにN 2を導入する。 <1 mmHgのマニホールドを排気するバルブ1( 図4)を開きます。 2Xよりを繰り返します。
- ステップ5.1で算出した圧力に達するまでマニホールドにN 2を導入する。
- 反応フラスコにN 2を100 mmHgのを導入するための開いた止めコック1( 図4)。
- N 2の意図された圧力一旦閉じるコック1は、反応フラスコに導入した( 図4)および圧力計を使用して圧力を記録されている。
- <1 mmHgのマニホールドを排気するバルブ1( 図4)を開きます。
- ( 図4)バルブ2を閉じ、マニホールドからのN 2シリンダーを外します。
6。実験を開始
- 周囲空気はマニホールドに入り、周囲圧力までマニホールドをもたらすことができるように( 図4)コック1とバルブ1を閉じることによってマニホールドから反応フラスコを取り外す一度全てのガスは、反応フラスコ中に導入されている。
- 慎重にマニホールドから反応フラスコを外した後、どこか( 例えば 、空のヒュームフードの内側に)邪魔されることはありませんフラスコを設定します。
- 真空ポンプを取り外し、慎重にコールドトラップを取り外して、完全に内部の通気を許可運用ヒュームフード。
- 高周波スパーク発生器に接続されているテスラコイルを固定します。
- 両電極間のギャップを横切る電流の効率的な通過を可能にするために、電気的接地に反対タングステン電極を接続する。
- 製造業者から入手可能な文書によって詳述され、約30,000 Vのスパーク発生器の出力電圧を設定。
- 火花を開始する前に、装置と実験者間の安全シールドとして機能するように、ヒュームフードのサッシを閉じます。実験を開始するためにテスラコイルをオンにし、スパークが発生したオン/オフサイクルで1時間で2週間(または他の所望の期間)継続することができます。
7。実験終了
- テスラコイルをオフにすることによって、実験を停止します。
- オープンストップコック1をゆっくりと反応フラスコに外気を導入し、アダプターの除去およびタングステン電極を容易にする( 図4)saのようmplesを収集することができる。所望であれば、真空が有害反応ガスの反応フラスコを排気するために使用することができる。
8。液体試料を収集する
- 熱分解されたガラスピペットを用いて、反応フラスコから液体サンプルを除去し、例えば真空グリースまたは他の非無菌面にピペットをタッチすることにより導入され得るものなど、汚染物質への暴露を最小限に抑えるように注意しながら。
- 滅菌プラスチックまたはガラスの容器にサンプルを転送します。プラスチック容器はガラス製の容器に比べて、凍結時に割れや破損の可能性も低くなります。
- の-20℃以下であり、温度に到達することができる冷凍庫でシールサンプル容器や店舗不溶性生成物を0℃で凍結から試料溶液を防ぐ可能性がある
9。装置のクリーニング
- きれいな実験室を使用し丁寧に装置の首から真空グリースを除去するためのワイプ、適応小胞体及びストップコック、およびタングステン電極を取り囲むガラス。
- 徹底的に完全にガラス製品から有機真空グリースを除去してトルエンでステップ9.1で説明したのと同じ表面を洗浄。シリコングリスを使用する場合は、高真空グリースは、ディスカッションのセクションで説明するように、将来の問題を作成し、熱分解した後、ガラス製品に残る場合があります。
- 徹底的に順番にブラシと以下の溶媒で反応フラスコをきれい:5%洗浄洗剤を超純水(18.2MΩセンチ、<5 PPBのTOC)、超純水(18.2MΩセンチ、<5 PPBのTOC)、メタノール、トルエン、メタノール、5%の洗浄洗剤を超純水(18.2MΩセンチ、<5 PPBのTOC)、最後に超純水(18.2MΩセンチ、<5 ppbの目次)。
- アルミ箔で反応フラスコの開いているすべての開口部をカバーし、アルミホイルでアダプタとそのコンポーネントをラップします。
- すべてのガラス製品は、アルミ箔に包まれたされた後では、少なくとも3時間、熱分解500℃の空気
- 優しくきれいなメタノールと電極と空気が乾燥してみましょう。
10。試料分析
注:分析用の試料を調製する場合、例えば、酸加水分解プロトコルの使用が他の場所15について詳細に説明したが、それ以上のアミノ酸を得るために有用である。回収されたサンプルの一部を加水分解すると遊離アミノ酸ならびに非生物的条件下で合成され、それらの酸に不安定な前駆体の両方を分析する機会を提供する。
- アミノ酸分析については、(例えば、液体クロマトグラフィーおよび質量分析ベースの方法として、または他の適切なアプローチ)の適切な技術を用いる。そのような分析技術は、蛍光検出(HPLC-FD)14と、飛行時間型ポジティブエレクトロスプレーイオン化質量分析(UHPLと並列に蛍光検出を有する超高性能液体クロマトグラフィー、高性能液体クロマトグラフィーを含むC-FD/ToF-MS)12,13。本稿では、質量分析を用いて分析を記載するHPLC-FDと一緒に三連四重極質量分析計(QQQ-MS)によって解析する。
結果
放電実験で合成された生成物は、非常に複雑であることができ、それらを研究するために使用することができる多数の分析的アプローチが存在する。アミノ酸を分析するための文献では、より一般的に使用される技術のいくつかは、ここで議論されている。クロマトグラフィーおよび質量分析法は、ミラー·ユーリー型火花放電実験によって生成され、複雑な化学的混合物を分析するための?...
ディスカッション
ここに記載されているプロトコルにおける多くの工程を安全に正しくミラー·ユーリー型実験を行うために重要である。まず、反応フラスコまたは試料と接触するすべてのガラス器具およびサンプル処理ツールは、滅菌される必要がある。殺菌前に少なくとも3時間、空気中500℃で熱分解し、徹底的に超純水(18.2MΩセンチ、<5 PPBのTOC)で、問題の項目を洗浄した後、アルミ箔でそれらをラッ...
開示事項
著者らは、競合する経済的利益を宣言していません。
謝辞
この作品は、共同で化学進化、CHE-1004570、および宇宙生物学のためのゴダードセンターのNSFセンターの下に、NSFと、NASA宇宙生物学プログラムによってサポートされていました。 ETPは、米航空宇宙局(NASA)惑星生物学インターンシッププログラムによって提供される追加資金調達を承認したいと思います。著者はまた、最初の実験施設をセットアップする非常に貴重な助けを博士ゴルフアシリGalhenaに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
参考文献
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved