このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
のリグニンダウンレギュレーション
要約
二本鎖RNA干渉(dsRNAi)技術は、より低い植物リグニン含量にトウモロコシシンナモイル補酵素Aレダクターゼ(ZmCCR1)遺伝子をダウンレギュレートするために採用される。細胞壁からのリグニンのダウンレギュレーションは、顕微鏡分析によって可視化しクラソン法により定量される。ヘミセルロースおよび結晶セルロース中の組成変化を分析する。
要約
代替的なバイオエネルギー資源としてのリグノセルロース系バイオマスの使用を容易にするために、生物学的変換プロセス中、前処理工程は、細胞壁炭水化物のアクセシビリティを増大させる、植物細胞壁の構造を開くために必要とされる。リグニンは、多くの細胞壁中に存在するポリフェノールの種類の材料は、アクセス酵素ために重要な障害となることが知られている。植物の構造的完全性と防御システムと干渉しないレベルまでリグニン含量の減少は、バイオエタノール生産のコストを削減するための貴重なステップとなる可能性があります。本研究では、遺伝的に二本鎖RNA干渉法を介してリグニン生合成関連遺伝子の一つ、シンナモイル-CoAレダクターゼ(ZmCCR1)をダウンレギュレートしている。 ZmCCR1_RNAi構築物は、粒子ボンバードメント法を用いてトウモロコシゲノムに組み込まれた。トランスジェニックトウモロコシ植物ではない野生型対照植物と比較して正常に生育トランスジェニック植物の葉の中間リブに褐色着色の表示を除いて、バイオマス成長又は防御機構でterfering殻、茎。顕微鏡分析は、組織学的アッセイと組み合わせて、リーフ厚壁繊維が間引かれたが、他の主要な血管系部品の構造及びサイズは変化しなかったことを明らかにした。トランスジェニックトウモロコシにおけるリグニン含量が7から8.7パーセント減少した、結晶セルロース、リグニン含量を減少に応じて増加し、ヘミセルロースは不変のままであった。分析は、炭素の流れは、セルロース生合成にリグニン生合成からシフトされているかもしれないことを示すことができる。この記事では、RNAi技術を介してトウモロコシのリグニン含量をダウンレギュレートするために使用される手順の輪郭を描く、および細胞壁の組成は、細胞壁の構造上の修飾の効果を検証するために使用される分析。
概要
リグノセルロース系バイオマスからのバイオ燃料の生産は、米国の1年に現在の豊かさに、農業と林業残渣の持続可能な収穫、食品や動物飼料の生産のために使用される耕地に直接競合しない能力の場合には非常に望ましい。しかし、現在、米国で発生したバイオ燃料の主な情報源であるトウモロコシの穀物とは異なり、リグノセルロース材料が大幅に分解するより複雑で困難である。長鎖炭水化物、セルロースおよびヘミセルロース、リグノセルロース材料の発酵中の糖の主な供給源であり、植物細胞壁の多種類のリグニンを含有し、病原体の攻撃に対する強度、防御を提供するフェニルプロパノイドポリマー、および疎水性に加えて、細胞壁である。植物の成長と生存に必要な一方で、リグニンはまた、セルロースとhemicelluの成功酵素変換に大きな障害を提示可溶性糖に負け。高リグニン含量を有する材料は、一般に、以下(生物学的変換経路を介して)、バイオ燃料および加工特性および製品の品質に負の影響に起因する紙パルプ産業の両方にとって望ましい材料である。したがって、作物構造強度および防衛システムと干渉しないレベルでのリグニンの削減のための植物材料の遺伝子操作は、リグノセルロースバイオ燃料や紙パルプ産業の両方の製造コストの削減のために重要である可能性があります。
メイズ( トウモロコシ )において、リグニンは共有結合フェルラ酸及びdiferulateブリッジ2を介して一次細胞壁中のヘミセルロースに架橋されている。リグニン - ヘミセルロース複合体は、二次細胞壁の完全性および強度を付与する複合マトリックスを形成する、水素結合を介してセルロースミクロフィブリルに結合する。植物細胞壁の機械的強度は、主にリチウムのタイプによって決定されるgninサブユニット3-5。これまでの研究では、リグニンサブユニットの割合を変更すると、酵素消化率6月11日には明確な傾向を示さなかった。しかしながら、リグニン含量の減少は、一般的にコンバージョン12,13の改善を示し、エンドセルラーゼ、セロビオヒドロラーゼ及びβ-グルコシダーゼ14を含む加水分解酵素により植物材料の消化率を増加させるための鍵であってもよい。
転写産物の発現レベルを調節する遺伝子操作は、広範囲の作物の形質を改善するために行われている。アンチセンス15および16共抑制技術など高度な技術が、ダウンレギュレーション標的遺伝子の効果的な可能にする。完全な遺伝子ノックアウトはまた、ヘアピン構造17を有するイントロンスプライシングRNAをコードする遺伝子構築物を用いて達成された。さらに、二本鎖RNA干渉(dsRNAi)技術、 すなわち 、強力で効果的な遺伝子発現メディア標的転写産物の分解または翻訳抑制のいずれかによって動作する器は、標的mRNAの18抑制効果の広範囲を誘導する強力な手段を提供する。遺伝子サイレンシング技術はいくつかの限界を示している。これらの技術は、正確に転写レベルを調節していない、それは他の相同な遺伝子上の予想外の消音効果を引き起こす可能性があります。
この方法では、dsRNAiトウモロコシゲノムに構築物を運ぶために粒子ボンバードメントを用いた。今日まで、植物種の広大な配列が正常に粒子ボンバードメント、 アグロバクテリウム媒介形質転換、エレクトロポレーション、およびマイクロインジェクション法を用いて形質転換されている。それが最も効率的であるため、トウモロコシの遺伝的形質転換では、パーティクルボンバードメント法は、すべての他の方法よりも有利である。粒子衝突は、細菌に依存しないので、この方法は、このような遺伝子の遺伝子、種の大きさやなどの生物学的制約のないゲンテン、または植物の遺伝子型。物理的な導入遺伝子送達系は、高い形質転換効率が19で葉緑体への植物のゲノムに、ある場合に導入される高分子量のDNAおよび複数の遺伝子を可能にする。葉の中間リブの血管系におけるリグニンの減少は、サンプルの地形や組成を調べるために有益である走査電子顕微鏡(SEM)を介して可視化することができる。
トウモロコシ植物では、シンナモイル-CoA還元酵素の2(ZmCCR1:X98083とZmCCR2:Y15069)の遺伝子はトウモロコシゲノム20で発見された。シンナモイル-CoA還元酵素は、シンナミルアルデヒドにヒドロキシシン-CoAエステルへの変換を触媒する。我々は、遺伝子がすべての木質化組織で発現されるので、この酵素をダウンレギュレートするZmCCR1遺伝子を選んだ。配列があるように見えたので、ZmCCR1遺伝子の3 '末端の523ヌクレオチドはdsRNAi構築物のために選択したZmCCR2のものと比較してより多様。このように、dsRNAi構築物は、正確に21サイレンオフターゲット回避のみZmCCR1に結合する。 ZmCCR1_RNAi構築物は、緑色組織特異的プロモーター、リブロース1,5 -ビスリ ン酸カルボキシラーゼオキシゲナーゼ(ルビスコ)を含む細胞質発現系ImpactVector1.1タグ(IV 1.1)中に操作した。
dsRNAiがトランスジェニック植物に構築物の効果を研究するために、リグニン含量を定量した。クラソン(酸不溶性)リグニン測定は、リグニン22の一部を可溶化酸性デタージェントリグニン定量法と比較して、より正確であることが知られている。そのため、クラソンリグニンは、トランスジェニックトウモロコシの茎で測定した。この手順では、水溶性の単糖類への23のポリマー炭水化物を変換する二段階の酸加水分解からなる。加水分解されたバイオマスは、酸可溶性および不溶性materiに分画したALSと酸不溶性リグニンはこれまでの研究23,24に従って測定した。理想的には、リグニン分析の結果に干渉する可能性可溶性物質を除去するため、およびリグニン残渣後の加水分解燃焼残留物中に存在する任意の灰分を考慮するために、従来の加水分解工程に水及びエタノールで抽出を含むべきである。これらのステップがなければ、サンプルのリグニン含量を人為的に膨張させることができた。フル方法は、しかし、我々の実験のために我々が原因でテストに利用可能な材料の少量にこれらのステップの両方を実行することができませんでした、ここで提示されている
二つの他の細胞壁成分、セルロース及びヘミセルロースはリグニンのダウンレギュレートトランスジェニックトウモロコシ系統において分析した。 CoAリガーゼ(4CL)26、又はシンナミルaは:これは、トランスジェニック植物は、それらのいずれかのフェニルアラニンアンモニアリアーゼ(PAL)25と 、4 -クマレートにおいてダウンレギュレートされていることが報告されているlcoholデヒドロゲナーゼ(CAD)27、他の細胞壁の構造成分の増加を示す。我々の研究における最初のステップとして、結晶セルロースをアップダグラフ法28を用いて測定した。この方法は、もともとセルロース分解細菌および真菌の多数のセルロースの決定のために考案された。ヘミセルロース、リグニン、およびxylosansを取り除くために簡単に説明すると、粉砕されたトウモロコシストックをアップダグラフ試薬(水:硝酸酢酸)で処理した。結晶セルロースを完全にH 2 SO 4を添加することによりSaeman加水分解を介してグルコースに加水分解した。結晶セルロースは、その後、比色アンスロン法29を用いてアッセイした。ヘミセルロースの内容が変更されたかどうかを確認するために、粉砕された茎から単糖抽出物は、トリフルオロ酢酸を用いて加水分解アルジトールアセテート法を用いて誘導体化した後、ガスクロマトグラフィー(GC)によって分析した30。結晶セル画のための詳細な手順luloseコンテンツやマトリックス多糖組成分析はフォスターらに記載されている。(2010)31。
ここでは、バイオ燃料の発酵性糖にトウモロコシリグノセルロース系バイオマスの加速解体のためのRNAi技術、粒子衝撃の変換、およびリグニン分析によってトウモロコシにおけるダウンレギュレーションリグニンのために使用される手順について説明します。
プロトコル
1。ZmCCR1のダウンレギュレーションに使用dsRNAi構築物の調製
- dsRNAiノックアウトするZmCCR1遺伝子を構築するために必要な制限酵素部位を含む設計遺伝子特異的プライマー。二つのプライマーセットは、ZmCCR1 cDNAの2フラグメントセグメントを増幅するために設計されました。1271ヌクレオチド748から523塩基対の断片、および1271ヌクレオチド986から285塩基対の断片ZmCCR1 cDNAはアリゾナゲノム研究所(AGI)から提供された。詳細については、 図1に記載されている。
- ZmCCR1_748F_BglIIプライマー(5'-AGATCTACATCCTCAAGTACCTGGAC-3 ')およびZmCCR1_1271R_NcoI(5'-CCATGGTTTACACAGCAGGGGAAGGT-3')を用いてZmCCR1 cDNA鋳型からのポリメラーゼ連鎖反応(PCR)によって大断片を増幅する。プライマーZmCCR1_986F_BglII(5'-AGATCTGGAAGCAGCCGTACAAGTTC-3 ')およびZmCCR1_1271R_SacI(5Rを使用してより小さな断片(285塩基対)を増幅17;-GAGCTCTTTACACAGCAGGGGAAGGT-3 ')。
- 個別に製造者の指示に従って、pGEM-T Easyにフラグメントを連結する。
- 個々の形質転換体からミニプレッププラスミドDNAの単離を行うこと、をpGEM-Tを含む各々は、市販のミニプレッププラスミドキットを用いて構築する。
- 両方のダイジェストをBglII及びNcoIの両方とをpGEM-T :: ZmCCR1(523 BP)とImpactVector(IV)-1.1(細胞質発現ベクター)。
- 消化ゲル精製IV-1.1に大型の消化ゲル精製ZmCCR1断片 (523塩基対)を連結する。
- IV-1.1 :: ZmCCR1(523 bp)の中に小断片を挿入するためにBglII及びSacIで両方とをpGEM-T :: ZmCCR1(285 BP)およびIV-1.1 :: ZmCCR1(523塩基対)のダイジェスト。
- 消化ゲル精製IV-1.1に小さな消化されたゲル精製ZmCCR1断片 (285塩基対)を連結する:: ZmCCR1(523 BP)。
- 523 bpおよび285 bpのフラグメンテーションの両方のクローンを作成する逆方向反復断片の途中で238 bpのスペーサー( 図1を参照)で285 bpの逆方向反復配列を有するZmCCR1 RNAi構築物にするのIV-1.1へのTS、。
- これは、 大腸菌(E.coli)中に構築し、それらを成長させ、トウモロコシ形質転換のための十分なプラスミドDNAを得るために、ミディプレッププラスミドDNAのサイズ分離を行う移す。
2。遺伝子形質転換トウモロコシ
- タングステン粒子の調製
- 1.5mlチューブにタングステンビーズ60mgの(M10)を配置し、2分間ボルテックスすることにより、70%エタノール1mlで洗浄する。 23℃で10分間インキュベートした後、2分間18894×gで遠心分離し、上澄みを捨てる。
- 100%エタノール1mlで3回洗浄、2分間遠心し、上清を捨てる。 60 mg / mlのに微粒子濃度をもたらすために、無菌の50%グリセロールの1ミリリットルを追加します。
- 砲撃のためのDNAの調製
- PL1.5mlチューブに50%グリセロールで調製したタングステンビーズを50μlの(3 mg)をエース。 IV-1.1の5μL(1μgの):: ZmCCR1 RNAiのプラスミドDNAを、2.5 M 塩化カルシウムを50μl、および0.1Mスペルミジンの20を添加する。上で簡単に試薬を添加するたび渦。
- ボルテックス30秒18894×gで、タングステンビーズ-DNA混合簡単に遠心分離。上清を捨て、70%エタノール140μlにペレットを懸濁します。液体を除去し、廃棄します。 100%エタノールを140μLを加える。液体を除去し、廃棄します。
- 100%エタノールの48を添加する。すぐに使用したり、衝撃に先立って、最大4時間氷上で保存する。
- 衝撃
- 32(osmotiumなど)は、少なくとも4時間前に衝撃をN6OSMメディアを含む100ミリメートルペトリ皿の中央に(アイオワ州立大学のトウモロコシ形質転換のセンターから提供された)3-5センチ、直径のHi-II胚形成トウモロコシカルスを置きます。
- た準備メーカーの指示33に従ってE PSD-1000/He粒子送達デバイス。
- 70%エタノールでチャンバ壁を殺菌。無菌保持キャップに無菌650 PSIのラプチャーディスクをロードします。マクロキャリアーの表面にM10-DNA溶液5-6μLを広げ、乾燥簡潔に。ロード·マクロキャリアーおよびマイクロキャリア発射アセンブリに画面を停止する。
- 停止画面(L2 = 6 CM)と近いドアから選択された距離でチャンバ内のマイクロキャリア打ち上げアセンブリおよびトウモロコシカルスを置きます。ワイヤメッシュスクリーンに対して27 psiを真空中で加速する。
- 破裂板が破裂し、ヘリウム圧力計がゼロになるまで、発射ボタンを押してください。発射ボタンを離します。
- 27℃の暗所での16時間N6OSM(浸透培地)32を含むペトリ皿に砲撃カルスをインキュベート私は約10個にカルスを解除し、ペトリ皿にN6E(カルス誘導培地)32に転送し、5日間インキュベートN 27°Cで暗い。
- 選択
- N6E上の5日後、N6S培地(選択培地)32上にカルスを移す。サブカルチャー選択培地上のすべてのカルスカルス構造を乱すことなく、8〜12週ごとに30日間。
- 約8〜10週間後、白の急成長しているセクターは非増殖し、部分的に壊死した母カルスから成長します。白い急成長している組織を切除し、新鮮な選択培地(N6S)32にそれらを継代培養し、上記のようにインキュベートし続けています。
- 再生
- 再生培地32に白と急速に成長し、胚カルスを移し、1週間、上記のようにインキュベートする。 25〜27℃で16時間の昼光と8時間の暗黒の時代に再生胚形成カルスを切り替える
- 3〜4週間後にガラス試験管内発根培地32に再生芽を転送、上記のようにインキュベートし続けています。かなりの時ROOT開発は土壌と4 "ポットに苗木を移植して、水道の蛇口の下に慎重に根を洗い、表示されます。しっとり保つためにビニール袋に鉢をカバーしています。 2日後には小さな穴ビニール袋を作る。 5-6日後にビニール袋を取り外します。他の5〜6日間、上記のようにインキュベートし続けています。
- 温室
- 土を18 "ポットに苗を移し、完全な夏の日差しや温室光の中で維持する。最初のシードがT 1世代に属しながら、初期再生された植物は、T 0と呼ばれます。
3。組織学的アッセイ
- 10%中性緩衝ホルマリン5mlにトウモロコシの葉半ば肋骨を修正します。
- プロセスは、真空は、組織のプロセッサを使用して、組織プロセッサのパラフィンで浸潤する。
- HistoCentre III埋め込みステーションを使用してパラフィンに組織を埋め込む。
- エッジから余分なパラフィンを除去一度圏ksとが冷却される。
- ミクロトームを用いてミクロトームで4-5ミクロンの切片サンプル。
- 2月24日時間56℃のインキュベーター内で顕微鏡スライドとドライにセクションを配置。のセクションが完全にスライドに接着されていることを確認します。
- 23℃で5分間のキシレン2変化脱パラフィン切片
- 水和物は、2分間の100%エタノールを2回交換し、23℃で2分間、95%エタノールの2つの変更を介してスライドする
- 2分間水道水の流水中でのセクションを洗浄します。
- 1〜2分間、0.05%トルイジンブルーOで染色し、蒸留H 2 Oを用いて簡単にすすぐ
- 光学顕微鏡とイマージョンオイルと可視化した試料にカバーガラスを配置します。
- 電子顕微鏡(SEM)を走査
- 4%グルタルアルデヒド中で断面したトウモロコシの葉の中間リブを修正し、1〜2時間4℃で0.1 Mリン酸ナトリウム緩衝液(pH7.4)。
- 簡単に説明すると、バッファ内のサンプルをすすぎ、それらが中で脱水10分間、3回ごとの階調と100%エタノールで10〜15分間、エタノール系列(25%、50%、75%、95%)。
- 過渡的な流体として液体二酸化炭素を使用して、臨界点乾燥機中で脱水断面にトウモロコシの葉の中間リブを乾燥させる。
- 高真空炭素タブを使用してアルミニウムのスタブ上で乾燥させた試料をマウントする
- コートトウモロコシの葉の中間リブはアルゴンガスでパージしたスパッターコーター中に金(約20nm厚)とアルミニウムスタブ上に取り付けられている。
- JEOL JSM-6400V(六ホウ化ランタン型電子エミッタ)、走査型電子顕微鏡でのコーティングサンプルを調べます。
- デジタル画像は、分析Proソフトウェア(バージョン3.2)を使用して描かれた。
4。クラソンリグニン測定
- 2ミリメートルスクリーンを通して粉砕機サンプル。
- 各サンプルの水分含有量を決定し、値を記録する水分計を使用する。
- 〜各サンプルの1.5グラムを秤量し、質量を記録する。 E自動化された溶剤抽出(抽出あたり3サイクル、サイクルあたり〜14分)、またはソックスレー装置(抽出あたり8時間)のいずれかを使用して第二の抽出のためにエタノールが続く最初の抽出のために水を使用したサンプルXTRACT。 (注:このステップでは、見かけのクラソンリグニン含有量を増加させる、酸加水分解中に凝縮し、正確なリグニン測定を妨害することができます抽出物を除去します。)
- 彼らはデシケーター中で冷却し、再度比較検討することができ、その後、45℃で一晩抽出した試料を乾燥させる。
- 30℃にインキュベーターを設定(サンプルあたり三連を推奨)スクリュートップ高圧チューブにそれぞれ乾燥、抽出されたサンプルの0.3グラムを測定し、最も近い0.1 mgの重量を記録します。各圧力チューブに72%のH 2の3ミリリットルのSO 4を追加します。
- ガラスやテフロン攪拌棒を使用してサンプルを混ぜる。水はインキュベーション後に追加されるまで、チューブ内の撹拌棒のままにしておきます。
- インキュベーター内でバイアルを置きSE30°Cまでtおよび60分間150 rpmで。 1時間後に4%に酸濃度を希釈し、攪拌棒で混合するの脱イオン水84ミリリットルを追加します。喫水線上のバイアルの側面にサンプルを大量に残してしないように注意してください。
- しっかりとすべてのバイアルに栓をシールし、メタルラックや大きなビーカーに入れます。 1時間の液体滅菌サイクルを用いて121℃でオートクレーブ。彼らが開く前に室温まで冷却することができます。
- 少なくとも4時間、575℃で炉内でフィルタリングるつぼをあらかじめ灰。るつぼは、少なくとも1時間デシケーター中で冷却してください。
- 真空は、るつぼを確保するためにゴム製のアダプタを使用して、別個の坩堝を介して各チューブから溶液を濾過する。チューブから残りの粒子を洗浄し、脱イオン水を使用しています。
- 4時間の最小、105℃でリグニン残基を乾燥させます。ドライるつぼと残留物の重量を記録する。
- 575°Cを使用した場合は、事前に火災ブンゼンバーナーの上のサンプルがそこには煙や灰がなく、その後24時間、炉内に配置するか、プログラム可能な炉を用いた場合、灰をPREおよび次のプログラムを使用していないまで。
- 105℃の室温から上昇し、12分間保持する。
- 10℃/分で250℃まで上昇し、30分間保持する。
- 20℃/分で575℃まで上昇し、少なくとも180分間保持する。
- 炉からるつぼを取り出して、デシケーター中で冷却する。るつぼと灰を重量を量る。
- 以下の式を用いて、酸不溶性残留物を計算
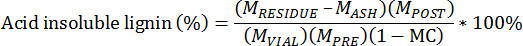
あらかじめ抽出されたバイオマスのM PRE =ミサ
ポスト抽出バイオマスのM POST =ミサ
バイアルに加え、抽出バイオマスのM VIAL =ミサ
るつぼとリグニンの残油のM 残基が =ミサUE
るつぼと灰のM ASH =ミサ
抽出される前のバイオマスのMC =含水率、総重量ベース
5。炭水化物分析
- 細胞壁炭水化物フォスターらに基づいて分析しています。(2010)プロトコル31を実行します。簡単に説明すると、凍結乾燥した植物材料からアルコール不溶性残留物を準備します。その後、トリフルオロ酢酸で材料を加水分解し、それらに対応するアルジトールアセテートに可溶化された単糖誘導体と一致する。四重極質量分析計に接続されたガスクロマトグラフィー(GC)により、これらの揮発性誘導体を分析する。
結果
我々は、RNAiを介したトウモロコシ植物におけるリグニン含量の減少を示した。粒子衝撃形質転換法は、約30%のtrnasformation効率が得られた。 ZmCCR1の遺伝子サイレンシングは、一貫してT0-T2世代で観察された。リグニン減少トランスジェニックは、リーフ半ばリブ、殻、茎に褐色の表示を除いて野生型トウモロコシ植物と同じように成長した。組織学的なアッセイは、突然変異系統は、?...
ディスカッション
細胞壁多糖類を植える微生物セルラーゼのアクセス可能性は、それらがフェノール系ポリマー23と関連している度合いに大きく依存する。糖を発酵するためのリグノセルロース系バイオマスの転化率は負secondadry植物細胞壁に堆積リグニン含量と相関している。この相関は、このような疎水性24、化学異質性と通常の加水分解性体間の連携25の欠如などのリグニンの物理...
開示事項
利害の対立が宣言されていません。
謝辞
顕微鏡イメージングは、高度な顕微鏡のためのミシガン州立大学センターのサービスを介して行われました。トウモロコシカルスはアイオワ州立大学のトウモロコシ形質転換のセンターから購入した。著者らは、炭水化物分析の彼の技術的な支援のためのMSU植物研究所のジェフリー·R·ウェザーに感謝したいと思います。この研究は、寛大にミシガン州のトウモロコシマーケティングプログラム(CMPM)と植物バイオテクノロジー研究コンソーシアム(CPBR)によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
参考文献
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved