Method Article
準備、イメージング、および細菌表面運動性アッセイの定量化
要約
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
要約
細菌表面の運動性は、例えば、群がるように、一般的に特定の寒天濃度および増殖培地中の特定栄養素の時々を含めることを必要とするプレートアッセイを用いて実験室で検査される。そのような明示的なメディアや表面成長条件の調製は、細菌の増殖が、薄い液膜内のこれらの表面上の細菌の協調運動を可能にするだけでなく、有利な条件を提供するのに役立つ。群れプレートと他の表面運動性プレートアッセイの再現性は、主要な挑戦することができます。特に、より「温帯swarmers」のみ0.4%-0.8%の寒天の範囲内でその展示の運動性(重量/容量)のために、プロトコルまたは実験室環境での軽微な変更が大幅に群れアッセイの結果に影響を与えることができる。 「湿潤性」、またはこれらのプレートアッセイの液体 - 固体 - 空気界面における水の含有量は、しばしば、制御されるべき重要な変数である。スウォーミングを評価する上で追加の課題は、Oを定量化する方法です任意の二つ(またはそれ以上)実験間の相違をbserved。ここでは詳細群れアッセイを準備し、イメージに多用途の2フェーズ·プロトコル。当社は、一般的に、これらのアッセイからのデータの群れのアッセイ培地の準備と定量化に伴う課題を回避するためのガイドラインが含まれています。我々は、具体的にタイムラプス光学イメージングを可能にするために、蛍光または緑色蛍光タンパク質(GFP)、ルシフェラーゼ( ルクスオペロン )、または携帯シミのような生物発光遺伝子の記者を表現する細菌を使用して私たちの方法を実証する。我々はさらに、同じ実験で競争群がっ種を追跡する手法の能力を実証する。
概要
多くの細菌は、自己推進の様々な手段を使用して表面に移動する。いくつかの運動性の表現型は、半固体プレートアッセイ組成物に関連する液体環境に影響されるプレートアッセイを用いて研究室で調査することができる。有用な表面運動プレートアッセイのサブセットは、さらに気相、典型的には、室内空気を伴う。ローカル環境固体表面、液体環境、ガス環境プロパティ:したがって、任意の特定の表面運動アッセイの結果は、三相界面の注意深い制御を必要とする。
このような三相アッセイにおいて最も一般的に研究運動モードが群がっとして知られている。運動性を群がっては、表面1上に薄い液膜を通して、鞭毛によって推進された細菌細胞の協調グループの動きである。これは、典型的には、1寒天(wt / vol)の0.4%-0.8%を含有する半固体のプレートアッセイを用いて実験室で研究されている。の配列人間の病原体は、ヒト宿主を探索し、コロニーを形成する。この運動の動作を利用する。例えば、 プロテウス·ミラビリスは、膀胱や腎臓2 に達し、コロニー、尿道を上に移動する運動性を群がって使用します。群がって運動性は一般に、バイオフィルム形成、多くのヒトの病原体3における病因の主な原因に前駆ステップと考えられている。
群がっ表現型は、細菌種間で高度に変化させた。実験の成功と再現性が強く、他の3-5の中で、そのような栄養組成物、寒天の種類や組成、殺菌プロトコル( 例えば 、オートクレーブ滅菌)などの要因、半固形培地硬化、及び周囲の湿気( 例えば 、季節変化)に依存している。表面の運動性応答の変動がこれらの研究と重要な影響メディアと発揮できる環境で遭遇する課題を強調している。 シュードモナスのようないくつかの群がっ種、群がっ名言のために観察された表現型とそれに付随する群れの拡大率は大幅に3異なりますが、ilityは、培地組成物の様々な発生する可能性があります。組み合わせることで、これらの要因は、表面の運動性の研究は非常に困難なことができます。ラボ内の季節変動は、これらの3つの相アッセイに影響を与えることができる:アッセイは、冬の乾燥空気中での夏の湿った空気中で良くも悪くも機能することができる。ここでは、表面運動性プレート研究を行う際に最も注目すべき課題のいくつかを回避する一般的なガイドラインを提示する。
いくつかの表面の運動性研究のために、特定の表現型の開発が非常に重要である。ほとんどの、すべてではないが、公表された研究は、Pのスウォーミングを調べるために、 緑膿菌は、巻きひげまたは接種センター3-9から放射状にフラクタルの形成を示しています。 P.の違い緑膿菌株は5,8文書化されているが、巻きひげの存在または不在のほとんどは納入仕様に起因することができこれらの群れの運動性プレートアッセイに使用されるC媒体及びプロトコル。ここでは、Pの巻きひげ形成群れを促進する方法の詳細が含まれる緑膿菌 。 P.ので、 緑膿菌はちょうど1多く群がって細菌のである、我々はまた、 枯草菌とミクソコッカスザンサスの滑空のスウォーミングを検討する私たちの方法の詳細が含まれています。 P.のよう緑膿菌、Bの現在の研究菌およびM.研究者は胞子形成、運動性、ストレス応答、および移行行動1,10の側面を識別するために働いているようにザンザスは話題の配列にまたがる。群がっグループにこれらの細胞に特異的な動作(複数可)のパターンと動力学を定量化する必要がある。
表面の運動データ取得、分析、および解釈は煩雑かつ定性的であってもよい。私たちは、ゾーンの形態とsを群れに加えて提供して細菌の群れの詳細な巨視的分析のためのプロトコルを開発した群発膨張率及び細菌又はバイオプロダクト密度分布7に関しては( 例えば 、直径)は、定量的な動的情報をIZE。さらに、この方法は、群れの中( 例えば 、 緑膿菌は 7,8ラムノリピド)細菌の相互作用8の包括的なビューを取得するために使用可能な蛍光タンパク質、発光および色素を利用することができ、ならびにバイオ製品の合成を追跡する。
プロトコル
1.スウォームアッセイ培地調製および接種4,5,7,8,11
- メディアの準備
注:以下に示す培地組成は、P。にも適用可能である緑膿菌巻きひげ形成の研究。 P.については、表1のメディアの仕様を参照してください緑膿菌、B.枯草菌およびM.ザンザス表面運動性アッセイ。- 磁気攪拌棒で攪拌FABマイナス200mlの(NH 4)2 SO 4群れ媒体(材料表)、ノーブル寒天0.9gの、およびカザミノ酸( 表1)を0.2gを混合する。実験間の一貫性を向上させるために小容量(100〜300ミリリットル)を使用します。
- 22分、121.1℃での暴露温度、および高速ベントオプションの露光時間を用いた200mlの寒天/培地混合物をオートクレーブ。オートクレーブの設定は適切な滅菌および寒天に溶融させたが、寒天カラメル化を防ぐことができます。
注:ノーブル寒天は、キャラメルの傾向があるization。細菌の運動性は、カラメル寒天に変更されている。 - 滅菌サイクルが確定した直後に、蒸発による水の損失を防ぐために、培地ボトルの蓋を閉じる。しかし、タイトなキャッピング、ボトルにライクな効果を「真空シール」を引き起こす可能性があることに注意してください。
- 室温(RT)で撹拌しながら50℃に媒体を冷却し、無菌の1.2 Mグルコース2 mlを加える。別の方法として、(最大15時間後)使用するまで60℃のインキュベーターや水水浴中でメディアを配置し、し、指示に従って進んでください。培地中の気泡の形成を防止するために、磁気攪拌棒を使用して完全に混合する。寒天の表面に気泡が群がってさえ防ぐことができます。
注:示すように、他のアッセイのために、このステップでは、必要に応じて、このような追加の栄養素や染料としてオートクレーブ処理することができない熱に敏感なコンポーネントを追加する( 例えば 、100ミリリットルあたり8μLインビトロジェンSYTO 63色素の添加は、画像にM.ザンザスを寒天を溶かしRepresentatiで下記の結果、)VEの。いくつかの色素の添加は、非染色コントロールに対してチェックされるべきベース群がるの動作に影響を及ぼし得る。 - 実験室フード内で、直径60mmのポリスチレンペトリ皿当たり無菌培地のアリコート7.5ミリリットルと(積層されていない)は、単層でプレートを維持する。大きな群がる表面、アリコート直径100mmのペトリ皿当たりメディア25mlのため。それも、水平面上に皿を充填することが重要である。表面が平坦化するかどうかをチェックするために雄牛の目の高さを使用してください。
注:Pのプレートごとに特定のメディアボリュームを使用して緑膿菌のアッセイは、一貫性と再現性が向上します。 Bについて菌およびM.特定のボリュームのアリコートに匹敵ザンサスアッセイ 、手注ぐ利回り結果。
- プレート硬化
- 小さ なプレート(60ミリメートル)の場合は、溶融した寒天培地を30分間(蓋なしすなわち 、)フード発見で(半固体およびドライ過剰な液体に設定の両方)を硬化することができます。より大きいプレート(100ミリメートル)は、より長い硬化時間を必要とする(説明を参照)。
注:あるいは、いくつかのアッセイは、カバーされ、ベンチトップで一晩(20〜24時間)( すなわち 、蓋上の)は、単層である( 表1)に硬化させるためにプレートが必要な場合があります。群がっては、両方の過剰と不十分な湿気に敏感である。湿度、気流、および任意の研究室の温度は、あなたの細菌の最適なスウォーミングを促進するための硬化メッキするために変化を必要とするかもしれない。 - 乾燥期間が終わった直後に、プレートを接種する。さらに使用するためにプレートを保管しないでください。
- 0.50%の10μlの混合物(体積/体積)ヒギンズ防水ブラックインドインクおよび細菌の接種材料11で試験板をスポットすることにより「インク広がりテスト」を実行します。インク/接種混合物がメディアの表面に( すなわち滴状を保持しません)容易に広がっている場合は、メディアが乾燥する追加の時間が必要になります。
注:湿度に特に敏感である種のために(例えば、P。緑膿菌 ) は 、プレートは十分に乾燥しているかどうかを決定するために迅速に「インク拡散試験」11を行う。
- 0.50%の10μlの混合物(体積/体積)ヒギンズ防水ブラックインドインクおよび細菌の接種材料11で試験板をスポットすることにより「インク広がりテスト」を実行します。インク/接種混合物がメディアの表面に( すなわち滴状を保持しません)容易に広がっている場合は、メディアが乾燥する追加の時間が必要になります。
- 小さ なプレート(60ミリメートル)の場合は、溶融した寒天培地を30分間(蓋なしすなわち 、)フード発見で(半固体およびドライ過剰な液体に設定の両方)を硬化することができます。より大きいプレート(100ミリメートル)は、より長い硬化時間を必要とする(説明を参照)。
- スウォームアッセイ接種
- 新鮮な(<室温で放置した場合に5日齢)溶原性ブロス(LB)プレート培養から単離されたコロニーをブロス培地(詳細については表1を参照) を 6mlの接種。水平に振とう(240 rpm)しながら30℃または37℃で一晩ブロス培養(≤18時間)インキュベートする。
- 一晩ブロス培養の1-5μlのスポッティングによって、または無菌の歯との寒天が選ぶ「突っつい」またはワイヤー接種針で群れプレートを接種する。
注:それは接種物を飛散の可能性を減少させ、群れの表面積に追加の水分を加える防ぐので、我々は後者の方法を好む。
- スウォームアッセイインキュベーション
- 一般的なアッセイのために、30℃で群れアッセイプレートをインキュベートCまたは37°C( 枯草菌のため、さらには42℃; 表1) -これは、細菌固有のものです。余分な水分が蓋ではなく、寒天上に凝縮するようインキュベーション中、プレートを反転。
注:温度が表現型ならびに動力学に影響を与えることができる。 Pの緑膿菌の群れは、37℃でのインキュベーションを30℃でのインキュベーションよりも速く成長し、群れの拡大につながる。しかし、これらの群れの形態は、多くの場合、温度の変化によって異なります。 - タイムラプスイメージングは、イメージングステーション(詳細は表1を参照)に移す前に適切な温度で群れプレートをインキュベート。
注:このプレイメージングインキュベーションは群れが自分の開発を開始し、または運動性を群がっために最適であってもなくてもよい新しい環境に移動される前に定着してことができます。
- 一般的なアッセイのために、30℃で群れアッセイプレートをインキュベートCまたは37°C( 枯草菌のため、さらには42℃; 表1) -これは、細菌固有のものです。余分な水分が蓋ではなく、寒天上に凝縮するようインキュベーション中、プレートを反転。
表面運動性アッセイ7,8の2巨視的イメージング
- タイムラプスイメージングのために、商業in vivoイメージングステーション内部の明確なイメージングプレート上のプレイメージング潜伏期間プレース群れアッセイプレートの後。画像6個までの、直径60mmまたは4時間で直径100mmのプレート。カメラの撮像面の下から画像を取得するので、光路8を妨げないように、プレートを反転させる。あるいは、実験期間中、30℃または37℃( 表1)でインキュベートし、設定された時間間隔でインキュベーターから撮像されるプレートを取り外す。
- 接種されたメディアを保持しているプレート相手の上に直立ペトリ皿の蓋を置きます。撮像中に過度の乾燥を防ぐために水でペトリ皿の蓋を入力し、実験を通して湿度を維持するために別の明確なトレイを使用して設定全体を囲みます。
- 分子イメージング(MI)ソフトウェア12を使用して、筋肉を使用して、室温でアッセイ(単数または複数)を実行する表2に記載されている設定エージング。タイムラプスイメージングのために、必要な手順と仕様のプロトコルを設定します。
3.データ処理と解釈7,8
- 画像処理
- エクスポートおよびエクスポートの場所にファイル]> [エクスポート]または[エクスポート複数選択>ファイル(複数可):16ビットTIFFファイルとして一括エクスポートする画像にMIソフトウェアを使用。
- 単一の画像を開いたり、タイムラプスシリーズをインポートするImageJのを使用します。
- [ファイル]> [開く]:単一の画像を開いて
- インポートタイムラプス画像シーケンス:[ファイル]> [インポート順序、および「数値的にソート名」を選択します。
- 大きなタイムラプスファイルの場合、適切なカテゴリ( すなわち 、GFP、RFP など )にエクスポート画像を積み重ねて「インポートシーケンス」ウィンドウの「仮想スタックを使用する」を選択します。
- 必要であれば、8ビットのファイルに16ビットファイルから画像を変更する:画像>タイプ> 8ビット
注:一部のImageJのツールは、8ビット画像を必要とする。 - 画像やタイムラプスシーケンスの強度信号を反転する必要があるかどうかを確認します。画像内の明るいスポット( 例えば 、蛍光標識した成長)にカーソルを置き、ImageJのツールバーから信号強度"値"を注意してください。その後、プレート領域外の暗い場所にカーソルを置き、信号強度の点に注意してください。ダークスポットの信号強度が輝点についての強度よりも大きい場合は、画像信号強度は、(サブステップ以下1-2に従う)を反転する必要がある。
- 強度信号を反転:編集>反転
- 画像>ルックアップテーブル>反転LUT:ルックアップテーブルを反転
- 背景を減算>プロセス、1つの画像寸法( 例えば 、2000 X 2000 pの1000画素の半分であるピクセル半径と「ローリングボール半径」を使用します。背景を引くixel画像)。
- 人工的に画像やタイムラプスシーケンスカラー:画像>ルックアップテーブルを、そしてリストのオプションから適切な色を選択します。
- 2つ以上のチャネルとのムービーでは、前のムービー(画像処理、ステップ8)として保存するに色をマージしてバランスをとる。 ImageJの中のすべての画像スタックオープン、一緒に画像をマージするには、[選択]画像>カラー>チャンネルをマージし、カラーチャンネルに各スタックを割り当てます。
- [ファイル]> [名前を付けて保存し、目的の形式と仕様を選択:AVIまたはQuickTimeムービーとしてタイムラプスシーケンスを保存します。
- データ分析
- 膨張率を定量化する細菌表面成長分野の取得
- ImageJの中で開いている画像(複数可)
- から「ストレート」ツールでアッセイプレートのセンター全体のラインを引くとその長さを測定する、ピクセル単位でのプレートの直径を計算するには、次の分析>測定
- ImageJの中のデフォルトの測定単位はπであるXEL。前のステップで得られた画素の長さでアッセイプレート( 例えば 、60 mmのプレート60)の直径で除して変換係数を得る。
- mmの画素からの測定単位を変更します。画像>プロパティ
- 前のステップで計算された変換係数に「MM」から「長さの単位」、および「ピクセル幅」、「ピクセルの高さ」、そして「ボクセルの深さ」に変更します。複数の画像間で、この変換係数を維持するために、「グローバル」ボックスを選択します。
注:ImageJのを閉じて再度開く、または画像の視野が変更されている場合( つまり 、一つの画像が他のよりも拡大表示され)、換算係数を再計算する必要があります。代わりに、すべてのピクセル単位で分析し、ミリメートルに変換を実行。
- 前のステップで計算された変換係数に「MM」から「長さの単位」、および「ピクセル幅」、「ピクセルの高さ」、そして「ボクセルの深さ」に変更します。複数の画像間で、この変換係数を維持するために、「グローバル」ボックスを選択します。
- フレームごとに、トレースし、OUをトレースするツールバーの「フリーハンド選択」ツールを使用して、群れの面積を測定群れのTLINEと使用して面積を測定:分析>測定。 [ファイル]> [名前を付けて保存:これは、は、Microsoft Excelまたは同様のプログラムのさらなる分析のために保存できるログの測定値を生成します
- 表面成長率を定量化する細菌表面成長強度を取得
- 背景が(画像処理、ステップ5)が減算されると、群れ(データ解析、ステップ1)の最大面積を決定するために、シーケンスの最後のフレームを使用しています。
- 細菌の表面成長の周りにボックスを描画するには、ツールバーから「オーバル」選択ツールを使用してください。
- 使用してボックス内の画素の平均強度測定を設定します。> SET計測を分析し、「グレー値を平均」を選択します。
- 分析>測定:シーケンスの最初のフレーム上に行くしながら、タイムラプスシーケンスで各フレームの強度信号の測定値を取得するには。これはミシガン州さらなる分析のために保存することができます測定のログを生成しますcrosoft Excelや同様のプログラム:[ファイル]> [名前を付けて保存
- 前のセクション(データ解析、ステップ2)の代替。セットアップにImageJのマクロプラグインを使用するとマクロ表面成長強度測定スクリプトを実行します。
- セットアップ複数のフレームを同時に分析するための自動測定スクリプト:プラグイン]> [新規]> [マクロ、およびボックスに提供されたスクリプトを(下)貼り付け、ImageJのマクロをテキストファイルとして保存します。ファイル]> [保存、および「下のImageJのアプリケーションフォルダに保存マクロの "。
numberOfFrames = N
{(;;私はnumberOfFramesを実行( '測定');
実行します(「次のスライス[>] ');
}
注:ここでは、変数「N」は、フレームの未定義の数のためである。 - 事前のスクリプトを実行する画像シーケンスのフレーム数を反映するために、各実験用のマクロプラグインの「numberOfFrames」を編集します。使用方法:プラグイン>マクロ>編集、およびタイプシーケンス内のフレームの正しい数で保存(ファイル>保存)。
- データ解析 - ステップ2でサブステップを1-3に従ってください、とシーケンスの最初のフレームにしながら、マクロプラグインを実行します。プラグイン>マクロ>をファイル名を指定して実行。 [ファイル]> [名前を付けて保存:これは、は、Microsoft Excelまたは同様のプログラムのさらなる分析のために保存できるログの測定値を生成します
- セットアップ複数のフレームを同時に分析するための自動測定スクリプト:プラグイン]> [新規]> [マクロ、およびボックスに提供されたスクリプトを(下)貼り付け、ImageJのマクロをテキストファイルとして保存します。ファイル]> [保存、および「下のImageJのアプリケーションフォルダに保存マクロの "。
- 膨張率を定量化する細菌表面成長分野の取得
結果
プレートの準備の変動は非常に運動性を群がって影響を与えることができます。溶融した寒天培地の注入後に硬化または乾燥時間は、表面運動性アッセイおよび時間の経過とともに細菌の運動性に存在する薄い液膜に影響を与えます。栄養組成の変化は、いくつかの細菌群れに影響を与える。 図1Aは、インドのインクの広がりおよび枯草菌 11の初期接種材料の広がり時に乾燥時間の短期間の効果を示す。 図1Bは、乾燥時間の影響を示し、 図1Cショー P.を群がっによるその後の巻きひげの現像時に、硫酸アンモニウムの効果[(NH 4)2 SO 4] 緑膿菌 5。
定量化データは、複数の画像化戦略を使用して、表面の運動の終点画像から得ることができる。 図2は、のための代表的な表面成長の結果を示す P。緑膿菌のスウォーミングおよびそれに関連するGFP蛍光画像; B.群がっ菌およびそれに関連する生物発光画像。とミクソコッカスのザンサスの表面成長とSYTO 64染色細胞の関連する赤の蛍光画像。
エンドポイントの結果を単に検査及びイメージングを超えてデータ収集の拡大が表面で増殖する細菌のための動的な挙動(単数または複数)の研究を可能にする。 図3~7 は、Pの一例を示す図(GFP発現細胞のために結像)群がっ緑膿菌及び(ナイルレッド脂質染色を用いて画像化され)、その関連ラムノリピド生産これらの画像からのデータの-the定量化はまた、P.の膨張率を示すように表示されている緑膿菌群がっ。 ビデオ1は、Bのタイムラプスを示しています群がっ枯草菌株を発現性ルクスの発光を用いて画像化。 ビデオ2 8が Pのタイムラプスを示しています緑膿菌 (緑発現GFP)及びサルモネラ·エンテリカ血清型Typhimuriumの(赤発現ルクス )。
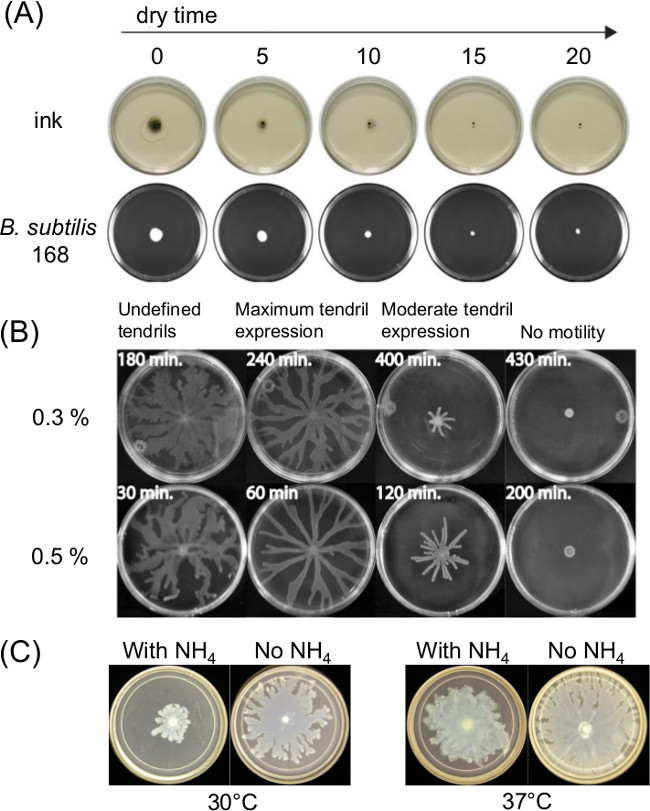
図1:分析結果に影響を与える表面運動アッセイ調製物中の因子の例(A)寒天乾燥時間の影響寒天表面水分に及びBの接種材料の広がり。 P.上サブチリス (文献8)、(B)乾燥時間寒天群がっ緑膿菌 (許可を得て参考文献5から転載)、およびP上の硫酸アンモニウムの(C)の存在下または非存在下緑膿菌群がると巻きひげの形成。
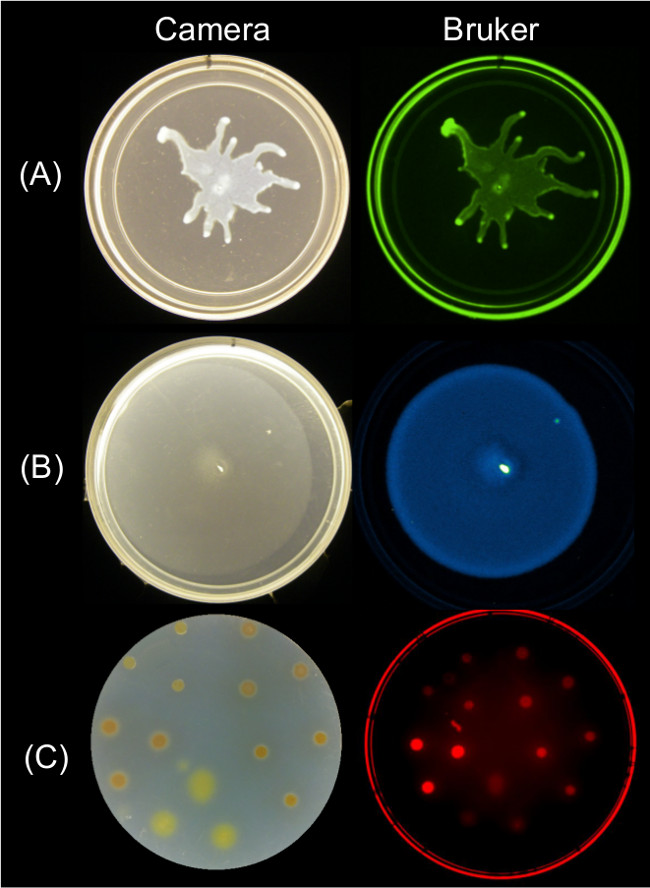
図2:Alternatiブルカーイメージングステーションを用いて細菌の撮像面の成長および運動性のためのアプローチをVEのカメラの側面の画像(左)とブルカー画像によって横(右)(A)P.を示すGFP-撮像さ緑色蛍光設定を使用して、(B)Bを発現する緑膿菌発光の設定を使用してルクスの生物発光レポーター-画像化、およびSYTO 64に結像赤色蛍光IIの設定を使用してで染色した(C) のM.ザンザスを表現する枯草菌 。設定内容については、表2を参照してください。
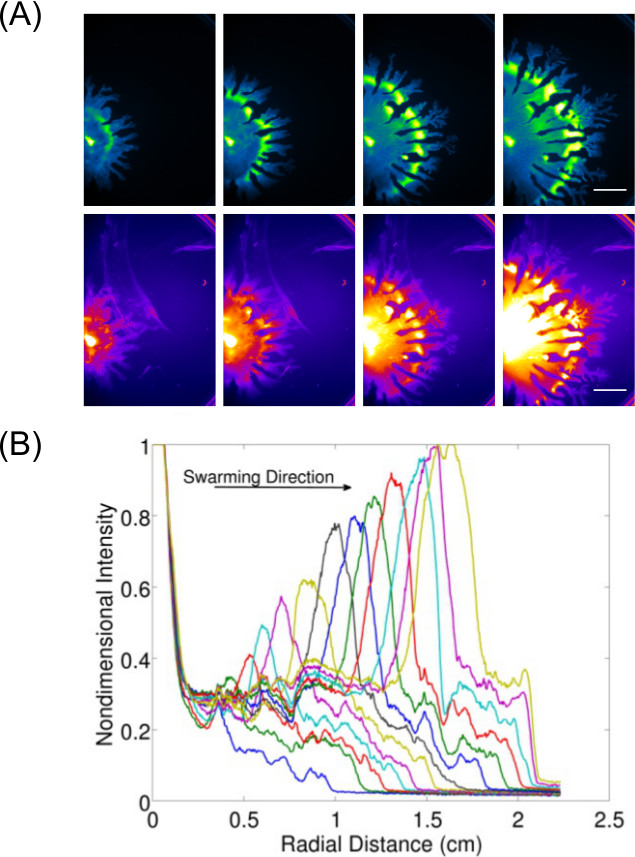
図3:表面の運動アッセイの定性及び定量分析細胞密度分布(A)タイムラプス分析は、ラムノリピド生(ナイルレッド脂質染色は赤色蛍光を用いて画像化私の設定。 P.の細胞密度分布画像から膨張率のスケールバー= 15 mm)であり、(B)定量緑膿菌の群れ。 (許可を得て参考文献6から転載。)
ビデオ1。 Bのタイムラプスイメージング枯草菌群れ。B. ルクスと発光の設定を用いて記録を発現枯草 。設定内容については、表2を参照してください。
ビデオ2。タイムラプスイメージングにより可視化種間競争。P.の群れ緑膿菌 (緑; GFPを発現し、緑色蛍光設定を使用して記録された)およびS.エンテリカ血清型 Typhimuriumの(赤、EXPRESルクスを歌うと)発光の設定を使用して記録した。設定内容については、表2を参照してください。 (参考文献7からの許可を得て転載。)
| 緑膿菌 | 緑膿菌巻きひげ形成の研究 | 枯草菌 | M.ザンザス | |
| 一晩ブロス培地 | FABプラス30 mMのグルコース | FABプラス30 mMのグルコース | ポンド | CTT |
| 一晩ブロス培養インキュベーション温度 | 37°C | 37°C | 37°C | 30℃で30時間 |
| スウォームメディア | FAB | FABマイナス(NH 4)2 SO 4 | 2%(wt / vol)のLB | CTT |
| スウォームメディア:追加コンポーネント | 12 mMのグルコースA | 10%(重量/容量)CAA、12 mMのグルコースA | N / A | SYTO(登 録商標)64 A |
| 寒天タイプ | 寒天、ノーブル | 寒天、ノーブル | グラニュー寒天 | 寒天、ノーブルアフィメトリクス |
| 寒天濃度(重量/容量) | 0.45% | 0.45% | 0.60% | 1.50パーセント |
| スウォームプレートサイズ | 60ミリメートル | 60ミリメートル | 100ミリメートル | 150ミリメートル |
| プレート当たりメディアボリューム | 7.5ミリリットル | 7.5ミリリットル | ハンド注ぎ | ハンド注ぎ |
| スウォームメディアの設定/乾燥法 | フード。発見プレート | フード。発見プレート | ベンチトップ。プレートにカバー | ベンチトップ。プレートにカバー |
| スウォームメディア設定/乾燥時間 | 30分 | 30分 | 一晩(20 -24時間) | 一晩(20 -24時間) |
| スウォームアッセイインキュベーション温度 | 30または37°C | 30°C | 37°C | 30°C |
| タイムラプスイメージングのためのインキュベーション | 少なくとも4時間、30°C | 少なくとも4時間、30°C | 2時間37℃で | 12時間RT |
| タイムラプスキャプチャ長さ | 24時間 | 24時間 | 10時間 | 66時間 |
| タイムラプス設定 | 1フレーム/ 10分 | 1フレーム/ 10分 | 1フレーム/ 6分 | 1フレーム/ 10分 |
| オートクレーブ滅菌した後に追加されました。 | ||||
表1:表面運動性アッセイの準備のための仕様は、表面を含むPの運動アッセイの準備仕様緑膿菌、B.枯草菌およびM.ザンザス 。
| 信号 | 緑色蛍光 | 赤色蛍光I | 赤色蛍光II | ルミネッセンス |
| タンパク質または染料 | 緑色蛍光タンパク質(GFP) | mCherryをタンパク質またはナイルレッドラムノリピド染色 | SYTO(登録商標)64 | ルクスオペロンからのルシフェラーゼ |
| 励起波長(nm) | 480±10 | 540±10 | 590±10 | オフ |
| 発光波長(nm) | 535±17.5 | 600±17.5 | 670±17.5 | フィルタなし |
| 露出時間(秒) | 30 | 60 | 60 | 240 |
| F-ストップ | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV(MM) | 190 | 190 | 140 | 120 |
| 焦点面(mm)の | 27.5 | 27.5 | 12.2 | 4 |
| (画素)ビニング | なし | 2×2 | なし | 8×8 |
表2:赤と緑の蛍光についてイメージング仕様ブルカー画像形成ステーションの仕様、および細菌表面成長の発光イメージング。
ディスカッション
群れアッセイは、湿度および利用可能な栄養素などの環境要因、に非常に敏感であるので、実験室で再現可能なスウォーミングを達成することは、挑戦することができます。表面運動プレートアッセイの最も重要な側面は、寒天表面の水分である。接種前に、群れメディアは表面の液体を泳いで渡っから細菌細胞を防ぐのに十分に乾燥でなければならないが、運動性5を群がっ阻害するように乾燥していない。インキュベーションは、十分に湿度の高い環境で行われるべきである:あまりにも多くの水分が人工的または人為表面拡散につながることができながら、あまりにも少ない水分が、インキュベーション中のアッセイ乾燥外になることができます。湿度制御インキュベーターが手元にある場合を除き、インキュベーターと研究室の湿度が劇的に変化することができる。その結果、培養器内に追加の水の貯水池、加湿器、除湿機はrelatを維持しながら、乾燥や余分な水分の蓄積の上に防止するために必要になる場合があります80パーセント近くのIVE湿度。季節の湿度変化が著しい場合は、この理想的な湿度を維持することは困難なことを証明することができる。このような場合は、群れアッセイプロトコルは、湿度の季節変化を考慮するためにいくつかの調整が必要になります。私たちは、群れメディア乾燥時間を変更しても、季節の湿度変化を調整するための最も簡単な方法であることを見出した。一定の湿度監視、両方の内側とインキュベータの外側に、推奨されます。さらには、研究者がこれらのアッセイの再現性に影響を与える可能性が彼らの楽器、インキュベーターなどスケール、温度、ボリュームのような軽微なエラーまたはメディア成分の量を校正および検証することをお勧めします。
また、アッセイにおいて使用されるプレートのタイプとサイズは、プレートの水分に影響を及ぼし、したがって、スウォーミングができることに留意されたい。気密プレートは、このように水泳運動を奨励し、過剰な水分を排出しないでください。これとは対照的に、開放面プレートはあまりにも多くの水分を逃がす。シャーレそれが液体の蓄積を防止するのに十分な過剰な水分を通気孔が、乾燥からメディアを防止するのに十分な水分を保持しているため、理想的な環境を提供します。この方法は、高品質の画像を可能にする表面の運動性アッセイプロトコールの詳細。イメージングのために明確な寒天を維持するために直径60mmの皿の寒天培地7.5mlの充填されている。詳述撮像が必要ない場合は、20ミリリットルまでのボリュームも、再現性のある結果を提供することができる。
群がって運動性は寒天濃度の広い配列で達成することができますが、スウォーミングに必要な寒天の最適な範囲は、種に依存します。全体的に、より高い寒天濃度が運動性、及び画像対応群発増加を生成するのに必要な、結果として時間が群がっ抑制する。P.緑膿菌は、一般的にしかし、我々は、最適なスウォーミングがはるかに狭い範囲(0.4から0.5パーセント)で発生することがわかり、0.4から0.7パーセント1間の寒天濃度に群れ。例えばB.などその他、 菌およびS.腸溶性の1.5%寒天10で0.6%寒天、および腸炎ビブリオで群れ。必要寒天濃度も寒天の種類とブランドによって決定される。より高純度の寒天は、ノーブル寒天のように、強くPに群がっ強化緑膿菌とは、造粒寒天13,14よりも好ましい。しかし、寒天のこれらの精製されたバージョンもオートクレーブ滅菌サイクル中にカラメル化になりやすいです。楽器によっては、短縮/修正された滅菌シーケンス(おそらく長時間の熱暴露を防止するために、排気サイクルを変更するには)ノーブル寒天を使用した群れのメディアを準備するために必要な場合があります。
培地組成物も観察群れ表現型3において役割を果たしている。P.緑膿菌群がって運動性の研究は、通常、最小限の栄養培地を使用して実行される。私たちは、そのようなM9、LB、またはわずかな変化など、他のメディアは、これらの共通のメディアにFAB培地4,8-( 材料表)を好むが、首尾よく9,15,16使用されている。巻きひげ形成が最高の炭素源とカザミノ酸(CAA)などのグルコースを補充したFAB最少培地上で達成されるが、付加的な窒素源( すなわち 、(NH 4)2 SO 4)、6,13- なし。巻きひげ形成または形態が研究の主な焦点ではない場合、FAB最少培地( 材料表; 表1)特定の炭素源および/ または追加の栄養素の効果を詳細に検討することができるようにCAAを欠くが推奨される。例えばB.などの他の種、 枯草菌 (ここで紹介する)は、LBと粒状の寒天上に群がっが可能な汎用性swarmers、である。これらの種は、完全な群れを開発するためにのみ〜10時間を必要とし、容易に群れ。この高速群がっレートは、群れの進行は、潜在的に困難以下になりますが、私たちのプロトコルは、追跡が非常に実現可能になります。群れタイムラプスイメージングを実行する能力はsubstanを提供していますTiAlのは、特にそのような熱心なswarmersから、群れのデータ収集の容易さ。
私たちは、実行および細菌表面の運動性研究の再現性を高めることを目的とした堅牢な、包括的な、2フェーズ·プロトコルとガイドラインを紹介し、主に鞭毛媒介スウォーミングを調べることが重要な側面を強調してきた。この群れアッセイプロトコールは、研究グループ内との間で一貫性と再現性を提供するために、培地組成と表面運動性板の取り扱いの重要な側面について詳しく説明します。これは、別の調査研究の中で比較の基準を改善する。また、提示アプローチおよびプロトコル( 例えば 、寒天でどのように小さな変化が4,5群がっ影響を及ぼすような要因が自分の仕事に影響を与え、可能な解決策を提供することを、研究者が意識させることにより、環境の変化に群がると表面運動性の研究が影響を受けにくくするための手段を提供する)。さらに、プロトコルは、に提供以前に計測不能であった細菌表面の成長の多くの属性を測定する機会を提供し、群がるの巨視的局面を定量化する。
私たちは、このプロトコルの開発にすべての表面運動性細菌を検討していない。このように、それは、プロトコルの変更がここに提示されていない種に必要とされることが予想される。このプロトコルの効率は、使用する装置や材料の固有の限界によって制限されている。温度制御装置の特徴ではないので、例えば、温度に関連する研究は、まだブルカーの画像形成ステーションでは不可能である。また、(ラムノリピドを染色するようナイルレッドなど)染料の使用は、反応速度と濃度の制限8を有することができる。この技術は、強く、デジタル画像の処理および分析に依存している。データ分析の改善された自動化( 例えば 、追加のマクロImageJのスクリプト機能を使用して)、分析に必要な時間を減少させるとデータの有用性を拡大する。最後に、撮影プロトコルの堅牢性のために、将来のアプリケーションは、環境や病原性細菌によってコロニーの表面に、より関連性が少ない均一な成長面を調べるために、この手法の拡大を目指すべきである。
開示事項
この記事の発行手数料は、部分的にブルカー社が主催した。
謝辞
(; MA及びJDSへR01GM100470と1R01GM095959-01A1)とNIHの助成金#UL1 TR000006によって部分的に資金を供給インディアナ臨床およびトランスレーショナル科学研究所の中核施設の助成金(;この仕事のための部分的なサポートは、国立衛生研究所から提供されたにJDS)。
資料
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
参考文献
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved