Method Article
液体および固形腫瘍由来の癌細胞のプロテオームの定量的質量分析プロファイリング
要約
In-depth analyses of cancer cell proteomes facilitate identification of novel drug targets and diagnostic biomarkers. We describe an experimental workflow for quantitative analysis of (phospho-)proteomes in cancer cell subpopulations derived from liquid and solid tumors. This is achieved by combining cellular enrichment strategies with quantitative Super-SILAC-based mass spectrometry.
要約
綿密癌細胞プロテオームの解析は、発癌性発症機序を解明するため、ならびに潜在的な薬物標的および診断マーカーを同定するために必要とされる。しかしながら、患者由来の腫瘍、特にそれらの細胞集団の定量的プロテオミクス特性評価のための方法は、主に欠けている。ここでは、液体または固体のいずれかの腫瘍由来の癌細胞集団のプロテオームの定量的解析を可能にする実験装置を記載している。これは、バイオインフォマティクスデータ解析に続く定量的超SILACベース質量分析と携帯濃縮戦略を組み合わせることによって達成される。 FACS選別に続いてフローサイトメトリー特異的な細胞のサブセットを豊かにするために、液体の腫瘍は最初のフローによって免疫表現されます。固形腫瘍のために、レーザーキャプチャーマイクロダイセクションは、特定の細胞の亜集団を精製するために使用される。第二段階では、タンパク質は、精製された細胞から抽出され、その後、腫瘍特異的と組み合わせるSILAC標識スパイクで標準的なタンパク質定量化を可能にします。得られたタンパク質混合物をゲル電気泳動またはトリプシン消化に続いてフィルター支援サンプル調製 (FASP)のいずれかに供される。最後に、トリプシンペプチドは、ハイブリッド四重極トラップ型質量分析計を用いて分析し、得られたデータはMaxQuant含むバイオインフォマティクスソフトウェアスイートを使用して処理される。 8000タンパク質まで、ここに提示されたワークフローを用いて同定することができ、患者由来のサンプル中で定量し、得られたタンパク質発現プロファイルは、診断プロテオミクスシグニチャーまたは潜在的な薬物標的を同定するための患者の間で比較することができる。
概要
質量分析に基づくプロテオミクスは、浮上していると細胞生物学および翻訳生物医学研究で広く使用されている規律は今です。タンパク質の何千もの単一の質量分析実験1,2で同定することができるよう分野における技術の進歩は、細胞株および動物モデルにおける複雑な細胞プロセスを研究することが可能となっている。これは、通常、変更2,3の各タイプの濃縮およびデータ分析のためにオーダーメイドのワークフローを必要とするが、同様の進歩は、リン酸化またはユビキチン化などの多くの翻訳後修飾の分析のためになされたものである。また、SILACを含む化学的および代謝標識戦略の関与は、基本的な細胞プロセス、診断バイオマーカーとヒト癌4における潜在的な薬剤標的の発見のためのこの方法は、特に魅力的、タンパク質とのPTMの正確な相対定量を可能にします。
しかし、いくつかの課題は、一次ヒトの癌5のプロテオーム解析に関して克服しなければならない。まず、ヒトの癌サンプルは、多くの場合、免疫細胞および線維芽細胞を含む腫瘍の微小環境に属する様々な細胞型の存在に起因する細胞の不均一性の高い示す。第二に、クローン進化は、異なる機能特性を有するいくつかの細胞集団の存在をもたらし、それ自体腫瘍内の遺伝的多様性をもたらす。いくつかの癌幹細胞は、癌の発生および進行の原動力であるという現在の考え方によれば、(機能的に関連性が高い)は、細胞集団のプロテオーム解析は、臨床応用に関連する発癌のメカニズムをよりよく理解するために非常に重要であると予想される6。第三に、サンプルの大規模なセットの定量的タンパク質発現プロファイルは、多くの場合、強固な臨床biomarの同定のために必要とされるKERS。代謝標識戦略ながら、これは、そのようなのiTRAQ 7のような化学的標識によって達成することができない-頼って、彼らがそうであるように、細胞増殖4日 -も同様に適用できない。第四に、最も利用可能な固形腫瘍サンプルは、ホルマリン固定によるタンパク質の架橋8の形成に質量分析プロテオーム解析が複雑である。最後に、ほとんどの既存のプロテオミクスワークフローが難しい臨床研究のために、関連するサンプル数の分析をレンダリングする、試料処理およびデータ収集のかなりの量を必要とし、新しいワークフローを求めること9,10パラダイム。
これらの障害に対処するために、我々は総合的な質量分析のためのグローバルな内部標準を導入するスーパーSILAC 14戦略と携帯濃縮のために11またはレーザーキャプチャーマイクロダイ12,13のソートのどちらか、フローサイトメトリー細胞を組み合わせた実験装置を開発しました。ここに記載された方法を用いることにより、液体または固体のいずれかの癌に由来する単一のヒト腫瘍サンプルにおいて8000タンパク質まで定量化することが可能である。
プロトコル
ヒト組織または血液サンプル上のすべての実験は、倫理委員会によって承認され、倫理の投票で与えられたすべてのガイドラインに従って実施されなければならない。
1.携帯濃縮
- 液性腫瘍/蛍光活性化細胞選別。
- 塩化アンモニウムを用いて赤血球溶解を行うことによって、またはフィコール密度勾配遠心分離により、骨髄または血液サンプルから単核細胞を単離する。
- 赤血球溶解のために、塩化アンモニウム溶液4mlで1mlのサンプルを組み合わせる。 10分 - 5氷上で解決策をインキュベートします。 400×gで4℃でリン酸緩衝生理食塩水(PBS)+ 2%ウシ胎児血清(FCS)、5分間遠心分離を40mlを加える。
- フィコール勾配遠心分離、レイヤ2の異なる層を形成するためのフィコール - ハイパックの15ミリリットル上のサンプルの10ミリリットルのために(層を乱さないように注意してください)。 RTで30分間、400×gで遠心分離 - 慎重に(15〜25℃)および単核収穫間期に集まる細胞。
- 細胞をスピンダウンし、PBS + 2%FCSでそれらを取る。 5分間400×gで遠心分離し、1mlのPBS + 2%FCS中で占める。陰性対照として1アリコート、最終的な汚れで使用される各蛍光色素のための1アリコートを取る。
- 氷上で30分間、製造者の指示に従って希釈して、白血病細胞集団を単離するのに有用な蛍光標識抗体でインキュベートする。また、個別に各抗体との補償のために使用アリコートを染色。 PBS + 2%FCSで二回洗浄する。
注:使用される抗体は、CD117-PE(クローン95C3)、CD34-FITC(クローン8G12)とCD33-PE(クローンP67.6)に対するマウス抗ヒトだった。 - 理想的にキャップに統合セルストレーナーでチューブを使用して、35μmのセルストレーナーを通して細胞をフィルタリングします。
- 細胞生存性染色( 例えば、7-AAD)を追加します。適切なセルソーター11( 図2)を使用してソート細胞。 Iscの中で細胞を回収 10%FCSを含むオベ改変ダルベッコ培地(IMDM)。
- 塩化アンモニウムを用いて赤血球溶解を行うことによって、またはフィコール密度勾配遠心分離により、骨髄または血液サンプルから単核細胞を単離する。
- 固形腫瘍/レーザーキャプチャーマイクロダイセクション。
- 記載された実験では、肺癌試料からのFFPE試料を用いた。この目的のために、肺癌のための組織は直ちに外科的切除、さらなる分析のためにパラフィン中に包埋し、約3×1×2cmの断片から4%緩衝ホルマリン中で固定した。
- ミクロトームとのホルマリン固定パラフィン包埋(FFPE)サンプルから10μmの厚さ - 5のセクションをカット。膜で覆われた膜のスライドと1時間37℃で乾燥した上で、マウント部分。脱パラフィンし、キシレン、無水エタノール、70%水での連続インキュベーションによって1分間の各マウント切片を再水和。
- 20秒間ヘマトキシリンでセクションを染色した後、水道水ですすいでください。レーザーキャプチャーマイクロダイセクションシステムを用いて、目的の細胞集団を収集する(また、12を参照)。
- 液性腫瘍。
- 400×gで、4分間、4℃でステップ1.1.5から細胞懸濁液を遠心し、上清を捨てる。 400×gで5分間500冷PBSのμLと遠心分離で二回洗浄し、4℃
- (最小細胞数でなければなりません10 5細胞(約10μgの全タンパク質))10 6細胞あたり40μlの溶解バッファーを追加し、氷上で15分間インキュベートする。 14000×gで、10分間、4℃で溶解物を遠心し、新しい反応チューブに上清(クリア細胞溶解物)を転送する。ペレットを捨てる。
- 固形腫瘍。
- 顕微解剖組織に組織溶解バッファー60μlのを追加し、氷上で15分間インキュベートし、短い遠心分離によって流体を収集し、新たな反応チューブにサスペンションを移す。 3分間氷上で溶解液を超音波処理。
- 最終SDS共同達するまで、20%ドデシル硫酸ナトリウム(SDS)の15μlを添加する4%のncentration。 1時間加熱ブロック中で99℃で顕微解剖し、組織をインキュベートし、600rpmで撹拌した。 16000×gで、10分間18℃で溶解液を遠心し、上清を新しいチューブに移す。
SILACスパイク·イン定量標準(スーパーSILAC標準)の3。設立
NOTE:定量標準は、4から導出SILAC標識タンパク質の混合物からなる - 関心の腫瘍タイプと一致6細胞株。 SILAC標識参照プロテオームおよび腫瘍由来のプロテオームの間の最大のオーバーラップを達成するために、主成分分析は、細胞株は、定量標準14のために選択される前に実行される必要がある。
- 主成分分析(PCA)。
- 細胞株のタンパク質発現パターンを決定するために、適切な細胞培養培地中で約10の異なる細胞株を育成。細胞を溶解説明したようにステップ2.1で。ステップ6.1で説明したように、質量分析のための細胞溶解物を準備します。
- 高分解能液体クロマトグラフィー結合質量分析計(ナノLC-MS / MS)の各細胞株のタンパク質の発現パターンを分析する。
- 無料のウェアMaxQuantを使用して結果の生データを分析し、ペルセウス16,17などの関連ソフトウェアを使用して、主要成分分析を行う。
- それらのタンパク質発現プロファイルとの間の最大の多様性を示す6細胞株とスーパーSILACスパイクイン標準を生成するためにそれらを使用する - 4を選択。
- SILAC標識およびラベルチェック。
- アルギニンおよびリジンは、炭素と窒素(SILAC培地)4の安定同位体で標識された適切なSILACの細胞培養培地中の少なくとも5つの細胞周期のために選択された細胞株を育成。
- 溶解ステップ3.1で説明した、ステップ6.1で説明したように、質量分析のための細胞溶解物を準備として細胞。ナノLC-MS / MSによるSILACラベリングの取り込み効率を測定します。 MaxQuant得られた生のMSデータを分析し、SILAC標識の効率を決定する。これは、それらの標識された(重)で同定されたペプチドの数をカウントし、その内因性形態(光)との比(重)/(重+光)を計算することにより達成される。標識効率98%を超えなければならない。
- SILACプロテオームと検証の組み合わせ。
- 育成と適切なSILAC培地で製造業者の指示に従って、選択された細胞株を展開します。溶解液性腫瘍のためのステップ2.1で、または固形腫瘍のためのステップ3.2で説明した各細胞溶解物についてのタンパク質濃度を決定するように説明したように細胞。
- 各細胞株の等モルタンパク質量を混合し、アリコートに混合物を分割します。測定まで-80℃でアリコートとストアをスナップ凍結。スーパーSILAC標準の50μgの - 1実験ではあなたが20を必要としています。スタンを準備するように注意してください一連の実験の範囲内標準を変更するなど、過剰でDARDは避けるべきである。
タンパク質濃度およびスパイクインの4。測定
- 液性腫瘍。
- タンパク質定量アッセイを使用すると、それぞれの細胞溶解物のタンパク質濃度とスーパーSILAC標準を決定する。
- クリア細胞溶解物とスーパーSILAC規格の等量を混合し、続いてリチウムドデシル硫酸塩(LDS)緩衝液(試料体積の25%)と還元剤(サンプル体積の10%)を加える。
- 10分間72℃で加熱ブロック中で得られた溶液を加熱する。必要に応じて、-80℃で生じた変性タンパク質を保存する。
- 固形腫瘍。
- プレートリーダー上でタンパク質濃度を測定するため、標準のウシ血清アルブミン(BSA)の希釈液シリーズ、市販のタンパク質aを有する溶解物および適切なスーパーSILAC標準を混ぜる96ウェルプレートにおいてssay、1分間振とう、指示された時間インキュベートし、製造業者によって示されるように吸光度を測定する。
注:溶解液中の高濃度のSDSおよびジチオスレイトール(DTT)は、タンパク質濃度測定のために最も利用可能なアッセイのための問題である。 - 清澄化ライセートを20℃で30分間、14000×gでフィルタユニットと遠心分離機の尿素を200μlとスーパーSILAC規格の等量を混合する。 50以上の明確化ライセートのμlのとスーパーSILAC規格を使用しないでください。尿素が出て結晶化しないように、15℃以下の温度を避けてください。
- プレートリーダー上でタンパク質濃度を測定するため、標準のウシ血清アルブミン(BSA)の希釈液シリーズ、市販のタンパク質aを有する溶解物および適切なスーパーSILAC標準を混ぜる96ウェルプレートにおいてssay、1分間振とう、指示された時間インキュベートし、製造業者によって示されるように吸光度を測定する。
5.サンプル分離およびタンパク質消化物
- 液性腫瘍。
- 個別の30 - 4上のレーンあたり100μgの総タンパク質 - 12%勾配SDS-PAGEゲル。クマシーブルーO / Nで染色タンパク質。水で2回洗浄し、その後の過剰クマシー染色を削除します。
- ゲルから各レーンをカットし、それを分割23の同じサイズのスライスに関係なく、ゲル染色のパターンの。 0.6ミリリットルポリプロピレンバイアル中で、別々の各をゲルスライスを処理します。
- 水、メタノール/水でゲルスライスを洗浄し(50:50、v / v)で、56℃で30分間インキュベートすることによって、10mMのDTTを減らす。暗闇の中で、室温で60分でインキュベートすることによって、55mMヨードアセトアミド(IAA)でゲルスライスをアルキル化。
- サンプル処理工程の間に、過剰の溶媒を除去し、試薬溶液の取り込みを改善することをSpeedVac中で15分間乾燥したアセトニトリルでスライスを洗浄する。
- 37℃で16時間(0.025 M水性重炭酸アンモニウム中12.5 ng /μl)をブタトリプシン溶液の最小量の乾燥したゲル切片を再水和することにより、プロテアーゼ切断を行う。
- ゲル切片に10μlの水を加え、37℃で15分間インキュベートする。 80μlのアセトニトリルを加え、37℃で15分間インキュベートする。 1分間、15,800×gで遠心分離する。別々の0.6ミリリットルで上清とストアを収集チューブ。
- 、5%ギ酸溶液の65μlを加え、ボルテックスし、37℃で15分間インキュベートする。 65μlのアセトニトリルを加え、37℃で15分間インキュベートする。 1分間15,800×gで遠心分離する。上清を収集し、前のステップからの上清に追加します。真空濃縮器で乾燥するまで組み合わせた上清を蒸発。
- 固形腫瘍。
- 組織溶解物からSDSを除去するには、参照15のように説明されている次のFASPプロトコルを使用。
- ステップ5.2.3で説明した第1の遠心分離した後、20℃で20分間14000×gでフィルター上に8 M尿素のさらなる200μlの、さらに遠心分離を追加。フロースルーろ液を捨てます。
- 100μlのIAAを加え、1分間600 rpmでサーモミキサーで混ぜる。暗所で20℃で20分間フィルターをインキュベートする。 20℃で10分間14000×gでフィルターを遠心。
- フィルタとCENへの尿素100μlのを追加します。20℃で15分間14000×gでtrifuge、。この手順をもう一度繰り返します。
- 20℃で10分間14000×gでフィルターや遠心分離機にNH 4 HCO 3100μlのを追加。二回、この手順を繰り返します。
- 40μlのNH 4 HCO 3 + 1μL(= 0.4μgの)トリプシンを追加し、600 rpmで、1分間20℃のサーモミキサーで混ぜる。 37℃で湿ったチャンバー内でフィルターのO / Nをインキュベートする。新しいコレクションチューブにフィルターを転送します。
- 20℃で10分間14000×gでフィルターを遠心。 20℃で10分間14,000gでNH 4 HCO 3および遠心50μlのフィルタを追加する。質量分析測定まで-20°Cで得られたペプチドを保管してください。
- ペプチド濃度の測定のため、96ウェルプレートに得られたフロースルーおよびニートトリプトファンの適切な希釈系列の50μLを分注する。トリプトファン蛍光を測定します。の結果の濃度を変換するトリプトファン0.1μgのようなペプチド濃度のトリプトファンは、9μgのタンパク質に対応している。
6.液体クロマトグラフィーおよび質量分光分析
- 超音波処理浴中で5分間30μlのローディングバッファー中のペプチドを再溶解。 1分間15,800×gで遠心分離器でスピンダウンし、MSのオートサンプラーバイアル中に透明な溶液をピペット。
- ナノLC-MS / MSシステムのオートサンプラーを用いた分析あたりのサンプルの5μLを注入。逆相でオンラインペプチドを濃縮し、脱塩C18プレカラム(0.15ミリメートル5μmの孔サイズのC18材料とID×20 mm)はベント列のセットアップや設定を切り替えるプレカラムどちらに搭載された。
- 逆相C18マイクロカラム上の別個のペプチドは(0.075g内径×200ミリメートル3μm以上対5> 35%のアセトニトリルの90分間の勾配を使用してこのようなPicoFritなどの自己パックナノスプレーカラム小さい細孔サイズC18材料、自己詰め300 NLで0.1%ギ酸水溶液/分。ナノスプレーイオン源によりハイブリッド四重極/オービトラップ質量分析計に溶離液を転送します。
- Top15データ依存取得方法(MSのm / z範囲 350使用したペプチドの分析- 。1600、解像度ターゲット70.000 FWHM、AGC対象1×10 6、最大充填時間60ミリ秒をMS / MSは質量100の開始、解像度ターゲット17.500 FWHM、AGC 2×10 5を標的とする、最大時間を60ミリ秒を埋めるMS / MS閾値3×10 4、荷電状態2、 - 。5、正規化衝突エネルギーNCE 25%、動的排除15秒)。
7.データ解析
- データ分析のために自由に利用可能なMaxQuant 16ソフトウェアを使用しています。生物情報学的データ解析のための詳細なプロトコールは、16,17に記載されている。分析のために、単一の実験17にSDS-PAGEのレーンからのすべてのスライスからの生データファイルを結合する。
結果
患者からの液体と固形腫瘍のプロテオームプロファイリングは、新しい診断および予測バイオマーカーの発見のための有望なアプローチである。しかし、サンプル調製手順及び質量分析は、サンプルの複雑さ、サンプルの大きなセットで正確なタンパク質定量のための必要性のために、挑戦的である。上記の実験手順は、蛍光活性化細胞選別により、またはレーザーキャプチャーマイクロダイセクションのいずれかによって、目的の細胞を単離することから始まります。
この目的のために、患者由来の骨髄吸引液または血液試料からの細胞を、FACSに基づくソーティング及び細胞溶解の前に興味のある規定された表面マーカーに対する蛍光標識抗体で染色する。
組織切片から細胞のサブセットを富化するために、これらは、最初のレーザーキャプチャーマイクロダイセクションを可能にするために適切なスライド上にマウントされなければならない。この目的のためにトンマウント彼は適切な膜スライド上の組織切片を、製造業者の説明書に従ってレーザーキャプチャーmicrodissectorを使用する。エリアや目的の細胞を選択することは、健康で新生物組織の組織形態についての適切な知識が必要です。抽出された細胞は、適切な収集チューブに移す。最初の実験は、関心のあるすべての新しい組織のためのタンパク質の十分な量(最小10μgの全タンパク質)の抽出のために必要な組織の量を定義するために行われるべきである。各顕微解剖サンプルは、組織溶解バッファー60μlので処理する。効率的な溶解のために、組織試料からの細胞をホルマリン誘導タンパク質の架橋を除去するために1時間99℃でサーモミキサーでインキュベートする3分間、そしてSDSサンプルを15μl添加した後に超音波処理されなければならない。遠心分離は、最終的にクリア細胞溶解物の収集を容易にする。
私のすべての病気のためにnterest(液体および固形腫瘍)の適切なスーパーSILAC定量標準は、14を確立する必要がある。適切な標準は、対象のサンプル中で発現されたタンパク質の90%以上を表すべきである。定量標準の調製のために、関心の癌タイプに関連する細胞株は、まずそれらのタンパク質発現プロファイルを決定するために、質量分析法によって分析されるべきであり、その後、主成分分析を行うべきである。 4 - 示差タンパク質発現パターンを持つ6つの異なる細胞株が選択され、「重い」アルギニンとリジンとのSILAC標識されるべきである。標識効率は、ナノLC-MS / MSによって確認されるべきであり、98%より大きくなければならない。その後、細胞株は、各患者由来のサンプルと同じ方法で溶解されるべきであり、その後、各サンプルSILACスパイクイン標準の等モルタンパク質量を混合すべきである。 O臨床サンプルの正確なタンパク質定量のための重要なステップFの関心は、患者由来のサンプルとSILACのスパイクで定量標準の等モルタンパク質量の正確な混合物である。ソートされた細胞由来の溶解物のタンパク質濃度を決定するために、様々なタンパク質定量アッセイを使用することができる。組織由来細胞からの細胞溶解物についてのアッセイは、溶解物中のSDSおよびDTT高濃度のに対応できることが必要である。患者由来のサンプルとSILACスパイクイン標準のタンパク質濃度にも匹敵する数百の試料を製造する際に重要である正確な混合を確実にするために、それぞれの臨床サンプルと組み合わせる前に毎回測定されるべきである。
スパイク内標準と溶解物の等量混合した後、液性腫瘍から得られた試料は、LDSと混合される10分間72℃でサーモミキサー中で加熱し、続いて、1D-PAGE、分離のゲル内消化にかけトリプシンを有するタンパク質。サンプルから得られた組織はWisniewskiのらによって確立されFASPアプローチを使用してSDSを除去し、トリプシンで消化された。15
得られたトリプシンペプチドを、フィルターから放出されたペプチドの量は、最初にフィルタにロードされたタンパク質の量と比較して15%と75%との間で異なるように組織サンプルのための特別な関心のあるトリプトファン蛍光を測定することによって定量することができる。この目的のために、我々は、トリプトファンの蛍光を測定する。トリプトファンの1.1μgのは、約100μgのペプチドのに対応しているように、適切なトリプトファン希釈系列との比較では、ペプチドの定量化が可能になります。必要であれば、FASP処理に特に由来の試料は、ナノLC / MS / MSシステム18にロードする前に、逆相C18(RP-C18)材料が充填されたコマーシャルまたは自家製段チップのいずれかで事前に精製することができる。
質量分光分析は、高い上で実行される-resolution、高感度の質量分析システム。要するに、ペプチド試料を脱塩し、予備濃縮RP-C18プレカラムに、質量分析計に直接連結RP-C18分析カラム上で分離する。 FASPによって処理固形腫瘍(3時間RP-C18勾配 - 分析の十分な深さを達成するために、我々は、長い2を40分間RP-C18の(液性腫瘍の場合)勾配または単回注射とのSDS-PAGEタンパク質の前分画の組み合わせのいずれかを採用する)。 MSスペクトルは、クロマトグラフピークプロファイルの積分によりSILACペアの正確な定量化を可能にするために70,000 FWHMまたはそれ以上の解像度で取得される。タンパク質同定のために、Top15データ依存取得方法は、ペプチドおよびタンパク質同定のためのペプチドのMS / MSスペクトルを大量に生成するために使用される。
結果の生データから、タンパク質同定および定量は、UniProtのKnowledgebasに対してMaxQuantソフトウェアとデータベース検索によって達成される電子人間の完全なプロテオーム配列データベース17。 MaxQuantソフトウエア(現在のバージョン1.5.0.25)において、ペプチドは、タンパク質配列データベースからインシリコするスペクトルに対してペプチド断片マッチングにより取得されたMS / MSスペクトルから同定される。同時に、同位体プロファイルイオン前駆体は、クロマトグラフィーの保持時間を中心に抽出され、それらの統合ピーク面積は、光の相対的定量のために使用される:SILAC標識により生成された重いペプチド対。ペプチドのアイデンティティおよび相対強度は、その後、対応するタンパク質のプロパティに割り当てられます。ペルセウスソフトウェア(現在のバージョン1.5.0.15)を、サンプル間の比較は、PCAおよび階層的クラスタリングを含むMaxQuant処理結果のさらに下流統計的評価を行うために使用される。
実験のセットアップを使用すると、私たちは、わずかの全タンパク質のμgの30から特定され、8000タンパク質にまで定量化しているに説明液体腫瘍に由来する。
固形腫瘍サンプルから最大2500タンパク質は、比較的短時間での臨床サンプルの何百もの分析を可能にする、わずか2時間のLC勾配を有するショットガンプロテオミクスアプローチで同定し、定量化することができる。
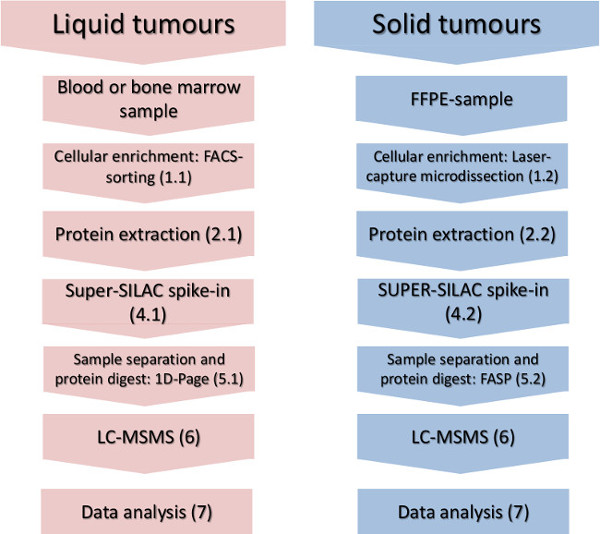
図1.実験ワークフロー。セルラーサブセット濃縮、タンパク質分離の主なステップ、定量標準と質量分析分析のスパイクで、液体と固形腫瘍のために示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
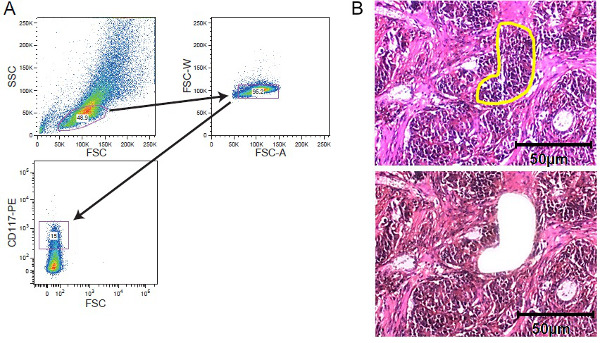
図2.携帯濃縮strategiES。FACSソーティングとLCM。 (A)代表的なゲーティング戦略セルソーターにより取得されたCD117染色白血病細胞集団にゲー示す。 (B)固形腫瘍組織のレーザーキャプチャーマイクロダイセクション。 5の組織切片 - 10μmの厚さは、染色前のフィルムで覆われた膜をスライド上に載せた。利害の領域がレーザーキャプチャーマイクロダイセクションのために手動で選択した。示す黄色のマークの関心領域と顕微解剖前と顕微解剖の後のセクションである。 50μmのスケールバーを図に含まれています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
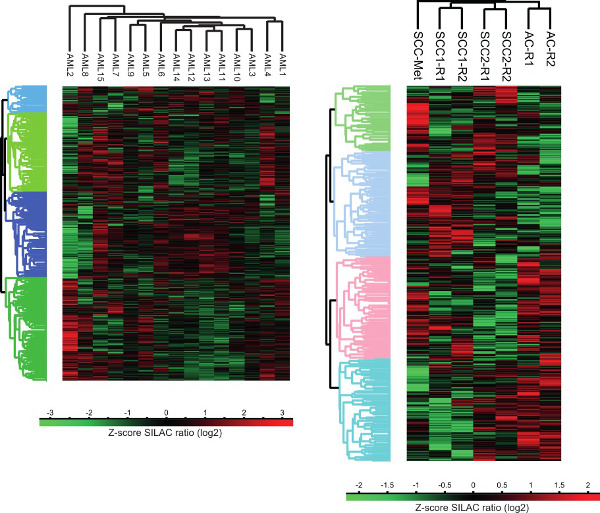
ヒト癌細胞プロテオームの図3.クラスター分析。PRの教師なしクラスター分析液体および固形腫瘍のotein発現プロファイルは、計算プラットフォームペルセウスを用いて行った。 AC - 腺癌、SCC - 扁平上皮癌、SCC-Metの - 扁平上皮癌転移頭頸部癌から、R - 技術的な複製。
ディスカッション
患者由来の癌細胞のプロテオームの質量分析プロファイリングは、新たな診断/予測バイオマーカーの発見のために必要とされるだけでなく、癌細胞生物学の理解を与えるために、その新たな潜在的な薬物標的の同定にターンリードしてあります。様々な分析前問題一つ堅牢かつ生物学的に関連性の高い結果を得ることである場合には、解決しなければならないので、そのような質量分光分析は、特に、非常に挑戦的である。
ここで説明する実験的なワークフローでは、液体と固体腫瘍の両方の細胞の亜集団から得られプロテオームの定量的プロテオミクス特性評価が可能になります。どちらFACSベースの細胞sortingor顕微解剖による腫瘍細胞の初期の濃縮は、腫瘍微小環境の細胞による汚染を回避するために必要とされる。さらに、これらの技術は、対象となる細胞の亜集団を単離することを可能にする。最近の細胞生物学の研究では、悪魔を持っている特定の細胞亜集団が、腫瘍開始特性を有し、従って、癌の病因19,20のために非常に関連していることstrated。質量分析法は、近年、より敏感になっているように、定量的なプロテオーム解析は、機能的に関連する細胞集団に集中することが可能となる、数千の細胞に由来することができ、少量のタンパク質のために可能である。
ここに提示され、セットアップは、FFPE試料中の新規の診断バイオマーカーを同定および検証するために使用することができる。したがって、それはまだ多くの癌タイプについて十分な数と質の分子バイオマーカーの不足してこれまでのように、臨床診断の改善のための便利なツールをBEAすることを約束。バイオマーカーが欠如している困難な鑑別診断の重要な例は、肺への転移、膵臓内胆管細胞癌および膵臓腺癌の原発性肺癌の区別され、ならびに異なる非常に悪性末梢神経鞘腫瘍から良性の神経線維腫のentiation。さらに、我々および他のプロテオミクスシグニチャーの定量的解明は、一般に、癌細胞生物学の研究において、がん患者21の治療応答を予測するバイオマーカーを明らかにするのに有用であり得ることを示した。
ここに提示方法の2つの現在の欠点は、大規模な手動の試料処理およびナノLC-MS / MS取得時間に対する要求の要件である。前者は、例えば、96ウェルフォーマットにサンプル調製を移動させ、ロボットの処理を使用することによって対処することができるが、後者は、質量分析取得戦略の変更を必要とする。標的タンパク質のサブセットは、例えば、腫瘍の分類に関連付けることができることが確認されたら、我々は大幅に低減分離労力でこれらのサブセットのための定量的な読み出しを提供する標的化質量分析法の設計を想定し、そしてしたがって、対応して減少取得時間と。 (液性腫瘍)又は3時間(固形腫瘍)を標的化質量分析およびペプチドの単純な一次元分離を用いて、1時間、例えばする36時間スループットが結果として得られるゲイン-必要な必須の取得時間は24から減少させることができた場合有意な生物学的および技術的反復の数を増加させるために使用することができる定量結果の有意性の対応する改善を、調べた。標的の質量分析のアプローチは既に癌関連タンパク質バイオマーカー候補22の検証に適したツールであることが実証されており、それらは、検証のために、あるいは日常的な臨床使用の23の潜在的なツールとして有望である点に開発されている、24。
開示事項
著者らは、開示することなく、利益相反などの問題がありません。
謝辞
The authors thank Uwe Plessmann, Monika Raabe und Silvia Münch for technical support.
資料
| Name | Company | Catalog Number | Comments |
| 660 nm Kit | Thermo scientific | 22662 | |
| Cell culture medium depleted of arginine and lysine | Thermo Scientific | 88421 | |
| Coomassie Brilliant Blue R-250 staining solution | Bio Rad | 161-0436 | |
| Dialyzed fetal calf serum (FCS) | PAA | A15-107 | |
| Diffuser caps for microdissection | MMI | 50202 | |
| FACS-sorter | BD | FACSAria III | |
| Ionic Detergent Compatibility Reagent | Thermo scientific | 22663 | |
| Laser-capture microdissector | MMI | cell cut plus | |
| LDS buffer | Life Technologies | NP0009 | |
| Membrane slides for microdissection | MMI | 50103 | |
| Microcon YM-30 | Millipore | MRCF0R030 | |
| NuPAGE 4-12% Bis-Tris Mini Gels | Life Technologies | NP0335PK2 | |
| Picofrit Self-Pack Columns | New Objective | PF360-75-15-N-5 | Mass Spectrometry Column/Emitter |
| Reducing agent | Life Technologies | NP0007 | |
| Reprosil-Pur LC/MS/MS Column stationary phase | Dr. Maisch | 120 C18-AQ, 3 µm | |
| Reprosil-Pur LC/MS/MS Precolumn stationary phase | Dr. Maisch | 120 C18-AQ, 5 µm | |
| SILAC-labeled arginine | Eurisotop | CLM-2265-H-0.1 | |
| SILAC-labeled lysine | Eurisotop | DLM-2640-0.25 | |
| Trypsin, NB Sequencing Grade | Serva | 3728301 | for in-gel digests |
| Trypsin, Sequencing Grade | Promega | V5111 | for in-solution digests |
| Buffer and solutions | |||
| Cell lysis buffer: 150 mM NaCl, 50 mM Tris/HCl pH 7.8, 5 mM NaF, 0.5% NP40, 0.1% laurylmaltoside, Roche complete protease inhibitor, 1 mM Na3VO4 | |||
| Tissue lysis buffer: 100 mM Tris/HCl pH 7.8, 0.1 M DTT | |||
| Urea: 8 M urea in 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| IAA: 0.05 M iodoacetamide, 8 M urea, 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| 0.05 M NH4HCO3 | |||
| 10 mM dithiothreitol (DTT) in 0.1 M ammonium bicarbonate | for in-gel digest | ||
| 55 mM iodoacetamide (IAA) in 0.1 mM ammonium bicarbonate | for in-gel digest | ||
| 5% aqueous formic acid. |
参考文献
- Walther, T. C., Mann, M. Mass spectrometry-based proteomics in cell biology. J Cell Biol. 190 (4), 491-500 (2010).
- Lenz, C., Urlaub, H. Separation methodology to improve proteome coverage depth. Expert Rev Proteomics. 11 (4), 409-414 (2014).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics. 1 (5), 376-386 (2002).
- Jimenez, C. R., Verheul, H. M. Mass spectrometry-based proteomics: from cancer biology to protein biomarkers, drug targets, and clinical applications. Am Soc Clin Oncol Educ Book. , e504-e510 (2014).
- Tang, D. G. Understanding cancer stem cell heterogeneity and plasticity. Cell Res. 22 (3), 457-472 (2012).
- Evans, C., et al. An insight into iTRAQ: where do we stand now. Anal Bioanal Chem. 404 (4), 1011-1027 (2012).
- Ostasiewicz, P., Zielinska, D. F., Mann, M., Wisniewski, J. R. Proteome, phosphoproteome, and N-glycoproteome are quantitatively preserved in formalin-fixed paraffin-embedded tissue and analyzable by high-resolution mass spectrometry. J Proteome Res. 9 (7), 3688-3700 (2010).
- Malmström, J., Picotti, P., Aebersold, R. Perspectives of targeted mass spectrometry for protein biomarker verification. Curr Opin Chem Biol. 13 (5-6), 518-525 (2009).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics. 11 (6), (2012).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. 41, (2010).
- Edwards, R. A. Laser capture microdissection of mammalian tissue. J Vis Exp. 8, 309(2007).
- Liu, N. Q., et al. Proteomics pipeline for biomarker discovery of laser capture microdissected breast cancer tissue. J Mammary Gland Biol Neoplasia. 17 (2), 155-164 (2012).
- Geiger, T., et al. Use of stable isotope labeling by amino acids in cell culture as a spike-in standard in quantitative proteomics. Nat Protoc. 6 (2), 147-157 (2011).
- Wisniewski, J. R. Proteomic sample preparation from formalin fixed and paraffin embedded tissue. J Vis Exp. (79), (2013).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Cox, J., et al. A practical guide to the MaxQuant computational platform for SILAC-based quantitative proteomics. Nat Protoc. 4 (5), 698-705 (2009).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat Protoc. 2 (8), 1896-1906 (2007).
- Sarvi, S., et al. CD133+ cancer stem-like cells in small cell lung cancer are highly tumorigenic and chemoresistant but sensitive to a novel neuropeptide antagonist. Cancer Res. 74 (5), 1554-1565 (2014).
- Shlush, L. I., et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 506 (7488), 328-333 (2014).
- Schaab, C., et al. Global phosphoproteome analysis of human bone marrow reveals predictive phosphorylation markers for the treatment of acute myeloid leukemia with quizartinib. Leukemia. 28 (3), 716-719 (2014).
- Hüttenhain, R., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 142ra94(2012).
- Burgess, M. W., et al. Simplified and efficient quantification of low-abundance proteins at very high multiplex via targeted mass spectrometry. Mol Cell Proteomics. 13 (4), 1137-1149 (2014).
- Boja, E. S., et al. Analytical Validation Considerations of Multiplex Mass Spectrometry-based Proteomic Platforms for Measuring Protein Biomarkers. J Proteome Res. , (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved