Method Article
グラスサポート平面脂質二重層上のナチュラルキラー細胞免疫シナプスの超解像イメージング
要約
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
要約
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
概要
免疫学的シナプスは(IS)細胞の活性化と機能1の臨界接合部である。これは、抗原提示および細胞性免疫が行われることにより、主要な媒体である。シナプス形成の最も初期の顕微鏡研究は、細胞-細胞複合体システム2を利用した。このアプローチの主要な制限は、それがあったとして、複合体のほとんどは、このようにシナプスの構造自体の観察者の視界を制限する、「プロファイルで「見られることである。 1999年には、ダスティンの研究室では、以前のMcConnelラボ4,5によって開拓されていたガラスサポート脂質二重層(SLB)技術3を利用することによって、この制限に対処。このアプローチは、タンパク質が結合し、二次元で自由に移動することができたにガラスサポート脂質平面表面を支持する抗原提示細胞(APC)、処分した。この方法を使用して、ダスティンと同僚は、Tに直接バックアップピアすることができました彼は、高解像度の蛍光顕微鏡を用いて、初めてISの構造の「対面」外観を得るシナプス。
SLBシステムを用いて、ISを視覚化することが可能な詳細は、現在の画像化技術6-8の限界によって制限されている。標準照射技術を用いて、最小分解能(これらは区別することができる、請求つの異なるオブジェクト間、即ち、最小距離)は、レイリーの基準9に基づいて<200nmであった。この制限は、シナプスを構成する非常に微細な、分子スケールの構造の画像化を妨害し、超解像技術の開発10-12まで、これらの構造の可視化は、電子顕微鏡を用いて固定された細胞の画像化に限定された。
そのようなSIMのような超解像技術は、種々の最近の出現により、(構造化照明顕微鏡)、PALM(光活性化ローカライゼーション顕微鏡)、STORM(stochastical光学復興顕微鏡)、およびSTED 10-12は 、研究者らは現在、順番にISのますます明確に理解を提供してきたこれまでにない詳細にこれらのシナプスの構造を研究することができます。 STED顕微鏡法の利点は、13の前に記載されている。ここでは、新たに開発された660nmの枯渇レーザーを備えたSTED顕微鏡で超解像画像を記述する。従来の592 nmの枯渇レーザーと比較して、660 nmのレーザーは、蛍光色素(http://nanobiophotonics.mpibpc.mpg.de/old/dyes/を参照)、特に、これらの赤色蛍光体のより広い選択が可能になる。
他の刊行物は、抗体でコーティングされたスライドガラス13,14にNK細胞のシナプスのSTED画像化を記載している。ここで、SLBシステムはNK細胞のシナプスを研究するために、超解像STED顕微鏡法と組み合わされる。この技術は、抗体を上回る利点を有している埋め込まれた表面タンパク質が平坦二次元平面(xy平面)内で自由に移動できる流動モザイクという被覆スライド。これは、より忠実に標的細胞の有機及び移動表面を模倣し、その結果、優れた生理学的に関連する免疫シナプスの形成を再現する。
このプロトコルの目的は、SLBシステムと、超解像STED顕微鏡法を組み合わせることにより、NK細胞のどの画像に免疫学的シナプスの詳細な説明と、エンドユーザに提供することである。それに必要な手順をエンドユーザに提供する:リポソームを調製し、タンパク質包埋二重層を構成する脂質二重層にタンパク質濃度を決定し、STED顕微鏡を用いて超解像画像を取得する。これらの技術は、免疫学の分野に限らず、広く、様々な分野にわたって使用することができる。
プロトコル
リポソームの調製
- クロロホルム懸濁し、1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)のストック溶液を、1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン - Nキャップビオチン(ビオチン-PE)の量を計算する所望の最終濃度に希釈したストックを作る。 10ミリリットルそれぞれで400μMのDOPCおよび80μMビオチン-PEリン脂質の最終濃度にするには、別のガラスクロマトグラフィー管に10 mg / mlののDOPCの629μLと88μlの10 mg / mlのビオチン-PEを配置することによって開始する。
注記:DOPCおよびビオチンPEのクロロホルム懸濁原液を転送しながら、溶液(水120mlを含有する60gの水酸化カリウム、KOHに1 Lの95%エタノール)を洗浄することにより、ガラスのハミルトンシリンジ、ガラスクロマトグラフィー管をきれいにすることが重要である。 - 化学フード内のアルゴン流でクロロホルムを乾かします。パラフィルムによってクロマトグラフィーチューブをシール。
- lyophilizに高真空に新たに乾燥したリポソームを件名ER O / Nは任意の残留クロロホルムを除去します。 60〜90分間のドライ同じ日の完了については、。
- 凍結乾燥機の実行中に、いくつかの希釈バッファーを準備します。このプロトコルのために、25 mMトリス、pHが8.0からなる25ミリリットルを用意。 150mMのNaCl; 2%(重量)のn-オクチルβ-D-グルコピラノシド(OG)洗剤。ドライOG粉末を添加する前に、アルゴンで酸素を置換、一緒に最初の最初の2種の成分を混ぜる。調製後、0.2ミクロンの酢酸セルロース膜でOGの溶液を濾過し、4℃で保存する。
- また、同じ濃度で、しかしOGずにトリス - 食塩水緩衝液の1 Lの2つのネジトップボトルを準備する。各底部の蒸留水洗浄磁気攪拌棒を置きます。トリス - 生理食塩水緩衝液をさらに6リットルのを準備します。アルゴンですべてのボトルから酸素を除去し、同様に、4℃に敷いてください。
- 凍結乾燥後、各4 mM溶液を作るために、トリス - 生理食塩OG緩衝液中で乾燥した脂質を溶解する。たとえば、次のボリューム、DOPCチューブに2ミリリットルを追加し、ビオチン-PEチューブに0.2ミリリットル。
- 一緒にDOPC脂質とビオチン-PE脂質を混ぜる。結合したビオチンをリン酸頭部基の流動性を損なうことができるので、これは、SLBの移動度を向上させる。 80μMビオチン-PEの最終濃度にするには、4 mMのビオチン-PEおよび4 mMのDOPCの1ミリリットルの0.2ミリリットルを混ぜる。その後、トリス - 生理食塩水OGバッファの8.8ミリリットルを追加します。
- 400μMDOPCの最終濃度のために、単にトリス - 生理食塩水OGの9ミリリットルで4 mMのDOPCの1ミリリットルを混ぜる。
- 氷水で超音波処理器を埋める。ユーティリティクランプを使用して超音波処理器の中心に希釈されたリン脂質を含有するガラス管を入れてください。溶液が透明になるまで10分間希釈したリン脂質を超音波処理する。
注:超音波処理は、熱を発生するので、低温を維持するために超音波処理器の水浴に氷を加える。 - 液体上の空気中の酸素を置換し、パラフィルムでそれらを密封するためにアルゴンでチューブを記入してください。
リポソームの2.透析
- 乾燥透析チューブの2つのセクションカット(分子量カットオフ:12-14,000、直径6.4 mm)の適切な長さの(この例では40センチ)、各リン脂質の希釈のための1つを、ロールから。
- それらは、2分間のガラスビーカー中で蒸留水200mlに浸漬させることにより、チューブのセクションを再水和。
- 高い設定で5分間これをマイクロ波、または少なくとも水が沸騰に来るまで。
- 各チューブの一端に結び目を作るとトリス - 生理食塩水-OGバッファの数ミリリットルで内部をすすぐ。その後、細心の注意を払って内部の残りの緩衝液の量を最小限に抑えるために、できるだけこの洗浄緩衝液だけを絞り出す。
- 層流フード内で、各チューブに希釈したリン脂質を追加し、全ての空気を排除するために小さな透析チューブの閉鎖と開放端をクランプする。完全な空気排除は&の下にクランプすることにより、少量の試料の犠牲が必要になります#8220;水ライン」。
- OGなしでトリス - 生理食塩水バッファーの先に調製したボトル内のサンプルを浸し。 4℃でO / Nを攪拌するために再密閉し、場所の前に、アルゴンでボトル内の酸素を置換する。
- OGなしでトリス - 食塩水緩衝液の新しいボトルに少なくとも3回のために12時間ごとにチューブを転送します。
- まもなく透析した脂質の除去の前に、酸素を置換するアルゴンでそれぞれを充填することによって脂質をアリコートにその中に小さな管の数を用意。
- 36時間後、層流フード内に透析ボトルを取り、ボトルから透析チューブを取り外します。湿った流出を収集するために手にベンチおむつやビーカーをお持ちです。
- クリップ上記透析チューブを切断し、その後、クリップを取り外して慎重に氷上にアルゴンガスを充填した予め調製チューブ内の1mLのアリコートにピペットを介して透析した脂質溶液を移す。
- 水性リポソーム溶液を分注し、再び私の酸素を置換するためにアルゴン流を使用nは各チューブ。
- 4℃でリポソームを保管してください。凍結しないでください。
脂質二重層上の抗体密度の3の決定
- 0 nMの(空白)、10 nMの、50 nMで、100 nMの、と500 NM:以下の濃度で、各希釈するためのボリュームで50μL、ビオチン化、蛍光標識された抗体の希釈系列を準備します。 (以下は、「サンプルシリーズ」と呼ばれる)。
- 96ウェルV底プレートの6ウェルにシリカビーズの1を添加する。彼らが沈降する傾向があるように、よくピペッティング前にビーズを振るようにしてください。
注:乾燥ビーズを注文したのではなく、一時停止した場合には、希釈する、製造元の指示に従ってください。 - 1:1の比率でビオチニルリン脂質:これらのビーズに、混合DOPCの2μlを添加する。各ウェルについて、これを行います。
- ビーズとリン脂質との相互作用を促進するために、10秒ごとに中程度の強度で3回ボルテックス上でプレートをパルス。
- 5%のCAS150μlのを追加します。各ウェルにEIN。アップピペットで3回上下よく混ぜる。
- 次いで、プレートを、10分間、カゼイン溶液でインキュベートそれを洗い流すう。 、洗浄HEPES、250μlの総体積に各ウェルを充填するために、1%ヒト血清アルブミン(HSA)と食塩水(HBS)をバッファリング。 2分間千×gで遠心分離する。出ピペット上清のトップ200μlのを破棄し、3回の洗浄サイクルの合計のために二回繰り返します。
- 333 / mlの濃度でストレプトアビジン50μlのを追加。プレートを再び3倍10秒パルス、それが15分間シェーカー上に座ってみましょう。未結合のストレプトアビジンを除去するためのステップ6のようにウォッシュ3X。
- よく先に調製した希釈系列(ステップ3.1を参照)からそれぞれに蛍光標識したビオチン化抗体を50μlを追加し、20〜30分間シェーカー上のプレートを交換してください。非結合抗体を除去するためのステップ6のようにウォッシュ3X。
- 最終洗浄後、その後のFACSチューブに移し、HBS / 1%HSAの100μlのビーズを懸濁します。 2回これを繰り返します300μlの合計で、ウェルからすべてのビーズの効率的な除去を確実にし、各ウェルのためにこれを行う。
- フローサイトメーターに生じたチューブを持参。それはそれらを読む時間です。
- 蛍光強度較正(FIC)ビーズキットから「B」とマークされたボトルからの1滴を加えるFACSチューブに(以下「標準シリーズ」と呼ばれる)、およびHBS / 1%HSA300μlで希釈する。
- このチューブを読みますが、まだデータが記録されません。今のところは、単に空白のビーズが適切にゼロにされることを確認してください。ピークはヒストグラムの左端になるまで、適切なチャネルで測定されたビーズの蛍光を示すヒストグラムを作成し、次に下の励起レーザの電圧をシフト。
- チューブを外し、同じチューブに(1〜4を表示)シリーズの他の4管のそれぞれの1滴を追加します。さて、再びマシンにチューブを置き、5つの別個のピークとして表示されます、結果のデータを、記録します。
- サンプルシリーズから、個々のチューブをお読みください。
- FACS分析ソフトウェアを用いて、半最大点で標準シリーズヒストグラムの各ピークの幅全体に及ぶゲートを描く。つまり、各ピークの一つのゲートです。各サンプルに対して同じ操作を行います。 MFI各ゲートのため(平均蛍光強度)に注意してください。
- 適切な場所で測定されたMFI値は、表計算プログラムの入力を使用して。また、入力MESF値(等価可溶性蛍光色素の分子)標準シリーズの各ボトル用(各ビーズをコーティングする蛍光分子の平均数)。この情報は、チューブが入って来たプラスチックジャーの指示に従うことによって見つけることができます。
- 蛍光体の数と測定された強度との間の線形相関を作成、MESF値に対してMFIをプロットしますスプレッドシートを使用してください。
- プロへの染料の比率を決定するために、マイクロボリューム分光光度計「タンパク質·ラベル」のモジュールを使用標識抗体でテイン。
- 入力サンプルタンパク質の標識効率、脂質でコーティングされたビーズの平均直径は、各エントリーについてのMFI値。スプレッドシートは自動的に各タンパク質希釈し、各濃度の試料タンパク質の播種密度のためのMESF値を計算するためにステップ3.16で生成された折れ線グラフから式を使用します。
4.単離及び培養ヒトNK細胞
- 分量15ミリリットル50ミリリットルコニカルチューブに、末梢血またはバフィーコート。 1:PBSを1の割合で、1%FBSを含有するこの血液を希釈する。
- 10ミリリットルの血清学的ピペットを用いてチューブの底に優しくフィコールの13ミリリットルを追加します。
- 加速器と休憩をオフにしたり、最低の設定で1200×gで20分間遠心し、このチューブを。
- 遠心分離後、末梢血単核細胞の浮遊濁った白色中間層末梢血単核細胞(PBMC)を収集するための血清学的ピペットを使用し、ワットHICHは、座って、透明な黄色の上層と赤血球(RBC)の最下層の上に座って、どちらも、より濁った淡い色の下層、交点べきである。注記のPBMCを収集するすべてのRBCを収集するためにしないでください。
- 新しい50ミリリットルコニカルチューブに回収したPBMCを置き、PBS、1%FBSを含む容量に希釈する。再び遠心分離し、300×gで5分間の最大のブレーキとアクセル、とこの時間。
- 上清を捨て、1%FBSを含む10mlのPBSで細胞を懸濁します。
- ステップ4.6のように、もう一度同じ設定で遠心分離しながら、細胞を数える。
- 再び上清を捨て、1000万細胞/ mlの密度で、R10培地中で細胞を再懸濁。
- 製造業者の説明書に従って5mlのポリスチレンチューブ中で30万個の細胞を取り、磁気分離キットを使用してNK細胞を単離する。単離に続いて、500,0の密度で細胞1以上の再懸濁を数えるR10完全培地中で00細胞/ ml(88%RPMI、10%FBS、1%HEPES、1%ピルビン酸ナトリウム)、IL-2(100 U / ml)を補充した。 CO 2インキュベーター中で37℃で培養し、毎週の中2〜3回交換してください。
5.ガラス、サポート平面脂質二重層を組み立て
- ビーカー中の3:1の割合で硫酸と30%過酸化水素水を混合して100ミリリットルのピラニア溶液を調製する。
注:常に正しく指定化学ヒュームフード中の硫酸のような有害な薬剤との作業を行っています。 - この溶液に、20〜30分間ピラニア溶液中で2長方形の#1.5カバースリップを浸す。
注:ピラニア溶液によってカバーガラスを清掃することが不可欠である。 - カバーガラスを清掃されている間、以前の1チューブを取る400μMのDOPC脂質を作成し、以前の1チューブは80μMビオチン-PE脂質を用意しました。アルゴンタンクに氷の上に輸送。
- アルゴンで新しいマイクロ遠心チューブ中の酸素を置換する、1:1の比を1にDOPCおよびビオチン-PEを一緒に追加します。具体的なボリュームは、実験的なニーズに基づいて異なりますが、最小2μlのそれぞれであるべきである。冷蔵庫に後者を返す前に、同様に再度アルゴンガスとの混合管内の酸素、および個々の試薬チューブを変位させる。
- 彼らは、クリーニングが終了した後、蒸留水で十分にカバースリップをすすぐ。数分間空気乾燥に外にカバースリップを設定します。
- ステップ5.4で調製したリポソーム混合物の1.5μLを撤回し、チャンバースライドのレーン室の一つに一滴でそれをアリコート。レーンあたり2滴の使用は、典型的な、しかし必要ではない。
- 迅速かつ効率的に小滴の上に乾いたカバースリップを置く。カバーガラスが配置されると、彼らはマージしないように滴が十分に離れていることを確認してください。さらに、滴がチャンバ壁の縁に触れることなく、円形のままであり、明確に定義されていることを確認してください。しっかりと下に押し各レーン間の周りにカバースリップとスライドの間に水密シールを確保する。
- マーカーペンを使用して液滴の位置をマーク
- 二重層をブロックするためにチャンバを通して、水性5%カゼイン100μlのを渡します。フローチャンバー内に気泡がないことを確認してみてください。
- 各レーンに333 ng / mlの濃度でストレプトアビジン100μlのを注入。 RTで10〜15分間インキュベートする。その後、過剰ストレプトアビジンを除去するために、各レーンを通じてHBS / 1%HSAの3ミリリットルを実行することで洗う。
- そのような以前に20〜30分間の暗闇の中で部3インキュベートの中で最も効果的であることが決定されたタンパク質濃度でアレクサフルオロ568としてビオチン化蛍光標識した抗CD16100μlのを追加します。各レーンを通じてHBS / 1%HSAの3ミリリットルを実行して、もう一度洗ってください。
- 過剰のストレプトアビジンを結合させるために、チャンバを通って濃度25 nMのにD-ビオチン100μlの流れ、したがって目の非特異的結合の可能性を排除する細胞にreptavidin。
- HBS / 1%HSA 500,000 / mlの濃度でNK細胞を再懸濁し、カウント。
- 細胞をスピンダウンしながら、レーンあたりHBS / 1%HSAの別の3ミリリットルで室からD-ビオチンを洗う。
- 前NK細胞を追加する全反射蛍光(TIRF)または共焦点顕微鏡で(FRAP)を光退色後の蛍光回復によってSLB上のリガンドの移動性を確認してください。
- 細胞の回転が終了したと所望の濃度で再懸濁されたら、各レーンに100μlを添加する。
- 30〜60分間、37℃、5%CO 2インキュベーター中で室を置きます。
- このインキュベーション期間の後、10〜20分間室温で4%パラホルムアルデヒドで細胞を固定する。パラホルムアルデヒドを除去するために、各レーンを通して3mlのPBSを実行することによって洗浄する。
- バッファー(5%正常ロバ血清および0.2%PBSでTritron X-100)をブロック400μlを添加する。室温で30分間インキュベートする。
- 広告によるステインF-アクチンとパーフォリン鼎希釈された蛍光標識ファロイジン200μlの(1単位/ mlのラベルファロイジン)と蛍光標識された抗パーフォリンモノクローナル抗体(500 / mlの抗パーフォリンモノクローナル抗体)。室温で1時間インキュベートする。
- 3mlのPBSを実行することによって洗浄する。チャンバーは、イメージングのための準備ができている。
STEDを使用して脂質二重にNKシナプスの6イメージング
- 必要なすべてのハードウェアモジュールをオンにします。
- 画像解析ソフトを起動します。共振スキャンおよびSTEDモジュールの両方を有効にします。これらの選択を行った後、開始するためのソフトウェアのために約3〜5分間待つ。
- 画面の上部にある「 設定 」タブをクリックします。
- 白色光とSTED 592 nmのレーザーをオンにし、 " レーザーコンフィグ 」 を選択します。
- 100X目的を選択し、592 nmの枯渇レーザーで励起レーザービームを揃える。
- 「 レーザーコンフィグ 」モジュールを選択し、592枯渇をオフにするレーザー、および660nmの枯渇レーザーをオンにします。
- レンズの上に、ステージ上にスライドを置きます。白色光ランプと接眼レンズを使用して焦点に区画され、二層の領域に結合した細胞を持参。
- 直接「 設定 」タブの右側に、「 取得 」タブに戻ります。
- その後にそのモジュールをオンにし、適切な波長に励起レーザラインをドラッグして、タブ「 ホワイトライトに切り替える 」 をクリックしてください。
- 波長の適切な範囲を包含するように検出範囲を設定し、その後、利用可能なもののリストから所望の検出器を選択する。
注:励起ビームの直下に検出範囲を置いてはいけません。 - 左側のツールバーの下に順次走査対話を開き、左側の「 取得 」ツールバーの「Seqential」ボタンをクリックします。これは、各ユーザが複数のシーケンスを追加することができ異なる色のための異なる励起ビーム。 「フレーム間の "クリックし、手順6.9と6.10のように、追加の各色用の励磁周波数、検出器、および検出範囲を設定します。
- すべての設定が最適化されると、取得プロセスを開始するために "Start"をヒット。
- 以前に13説明したように、STEDデコンボリューションのために設計され、設定を使用して無料のデコンボリューションソフトウェア(ホイヘンス)を適用します。
結果
図1は、脂質二重層上の抗体密度の結果を示す。原理は、フローサイトメトリー(A) を介して MFI対MESFの標準曲線を作成するための標準的なビーズを使用することである。サンプル列のMFIは、標準曲線を用いてMESFに変換した。脂質二重層上の抗体密度は、直線的に抗体濃度(B)と相関している。 図2ガラス支持平面脂質二重層におけるNKシナプスの三色STED画像を示す。脂質二重層上の抗CD16抗体は、Fアクチン形成及び分極およびNK細胞における免疫シナプスの焦点パネルでFアクチンメッシュパーフォリンの浸透を誘発する、蓄積する。この組み合わせたアプローチを使用して、1はきれいに直接NK細胞上のCD16のクラスタリングを反映しSLB、内抗CD16蛍光標識のマイクロクラスタを観察することができます。従来の共焦点画像を、CD16セントラの構造と比較してlのクラスタは、より容易により枯渇周囲の蛍光にSTED画像において識別される。また、アクチン細胞骨格の微細構造が大幅に向上解像度で見られる。以前の観察16,17と一致して、パーフォリン陽性溶菌顆粒はSTED画像、大部分は共焦点画像で失われている重要な詳細に低F-アクチン密度の領域の上に配置見られている。
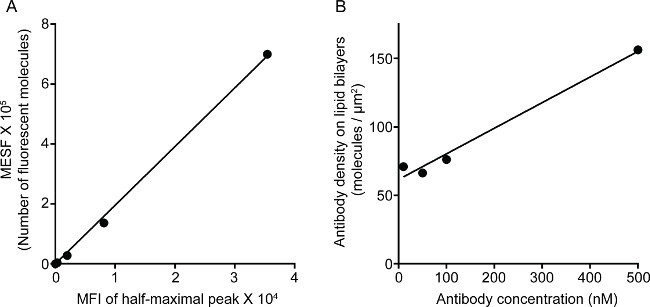
脂質二重層における3G8抗体の図1の密度。(A)は 、標準シリーズのMESFおよびMFIとの間の線形相関。(B)のタンパク質濃度及び試料タンパク質の希釈系列の濃度と線形相関当たり蛍光標識されたタンパク質のモノマーの数を示す脂質でコーティングされた済州に増加する濃度の関数としての単位面積LICAビーズ。
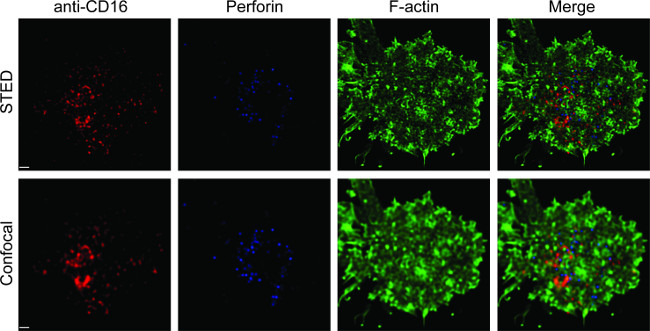
平面脂質二重層におけるNKシナプスの図2 STEDイメージング。初代NK細胞は、SLBを含むビオチン化、蛍光標識された抗CD16(赤)で刺激した固定、透過処理し、その後ファロイジン(青色)および抗Fアクチンで染色した(緑色)。個々のセルは、第1、通常の共焦点設定で画像化され、その後、STED設定した。共焦点とSTED画像はホイヘンスソフトウェアを使用してデコンボリューションされた。スケールバーは1μm。 この図の拡大版については、ここをクリックしてください。
ディスカッション
現在の研究の新規性は、NK細胞のシナプスを研究するSTEDとSLBの技術を組み合わせることである。以前の研究は、T細胞のシナプス形成8を研究するためにTIRFと脂質二重層を撮像して、原形質膜6上の分子の輸送をシグナリングしている。他のものは、抗体でコーティングされたガラススライド13,14を使用してNK細胞のシナプスのSTED画像化を記載している。本明細書中にさらに記載のハイブリッド方法は、これらの脂質二重層の表面に超解像画像化によって得られる強化明確にNK細胞のシナプスを撮像する努力、より良いモデルAPCの動的表面上に構築。
のSLBは、実際の標的細胞またはAPCが有すること骨格、脂質ラフトを欠く人工膜、および他のリガンドであるが、この技術は、移動性およびリガンドの向きと重要な特徴を再現することができる。これはSLBシステムは解剖トンで還元主義的なアプローチとして機能することができますISとISのダイナミクスの形成に個々の受容体およびリガンドの寄与彼。のSLBの最も重要な特徴は、研究者はそのような共焦点及びTIRF顕微鏡法のような高分解能イメージング手法を使用して、この手法を組み合わせることができることである。 STED顕微鏡の導入は、さらに研究とその臨床応用がISに前例のない洞察を提供し、この利点を増大させる。
このシステムの一つの潜在的な批判は、SLBが十分に得られ、したがってシナプスにおける潜在的に非生理的解剖学的特徴を生じさせる、APCの複雑な表面を模倣しないことである。それがSLB上の表面分子の限られたレパートリーは完全にAPCの不均一人口表面を再現しないことは事実ですが、それがシナプス形成上の個々の受容体とリガンドの相互作用の影響を決定するために研究者を可能にするという点で、この制限は、有利であることができる。
Tここでの処理のいくつかの重要なステップがあります。最も重要なの中でのリポソームの酸化は、常にこのようなステップ1.10、2.6のように、チューブ、溶液中の酸素を置換するために、アルゴンを用いて、2.11を介して防止されることである。脂質の酸化は、このように自由に移動し、シナプスの構造に関与する表面タンパク質の能力を阻害、減少、脂質移動度をもたらす。同様に、凍結乾燥(ステップ1.2)により、リポソーム内のすべてのクロロホルムを除去することも重要です。脂質二重層中のタンパク質濃度の測定では、最初のクラスタのない均質な懸濁液にシリコンビーズを分散させるために重要である。必要であれば、ビーズの超音波処理を適用することができる。カバースリップを洗浄されるSLB、初期段階(5.1〜)を組み立てる際に、液滴が配置され、カバースリップは不可欠で固定されている。これらのいずれかでミスが(セクション5の先頭から)上で実験を開始する必要ができます。この理由のため、それは事故の場合には時間を節約するために必要とされるよりも多くのカバーガラスをきれいにすることをお勧め。
このシステムで作業しているとき、非クラスタは、最も頻繁な問題である。最後のステップで細胞を可視化する際に、1は任意の蛍光シナプスを見つけられなかった場合は、撮影することができいくつかのステップがあります。別のコグネイト細胞表面受容体のための染色細胞をガラスカバースリップまたは二重層の表面に非特異的に付着することができるが、細胞は重層とシナプスを形成していないことを確認するために、チャンバーに添加することができ、シナプス-関与する表面タンパク質べき非係合表面タンパク質は、細胞の周囲に拡散染色のように表示されます。一方で、細胞 - 二重層界面の面でのように明確なクラスタを表示されます。このメソッドは失敗した場合、1は、特定のマーカー1は、細胞表面上に十分な豊富に発現して勉強したいと考えていることを確実にするために、フローサイトメトリーを経由して 、それらの細胞を確認する必要があります。一定の表面proteインは、インビボ培養において長期間にわたり下方調節されることが知られている。
NK細胞のシナプス形成を視覚化する方法を具体的に、このプロトコルの詳細が、SLBシステムは単に、ステップ5.11において主リガンドの置換によって想像任意の免疫細胞におけるシナプス形成を研究するために使用することができる。複数のリガンドはまた、同時に添加してもよい。一つには、二重層内表面タンパク質を付着させるためのストレプトアビジン - ビオチン系を使用する必要はありません。ニッケルNTA:ヒスチジン相互作用も生存可能である。しかし、ストレプトアビジンの高強度と特異性に起因する:ビオチン相互作用、私たちの研究室ではこのシステムを好む。一つには、ステップ5.13において、所定濃度の二重層上に添加した細胞の濃度、ならびに成熟の異なる段階でシナプスを観察するために、その後のインキュベーション期間の持続時間を変えることができる。もちろん、これは細胞内のSTRを可視化する可能性を排除が、これはあっても、生きて行うことができますuctures(これらはすでに融合した蛍光タグで標識されていない限り、私たちの研究室は、いくつかのような変更された細胞株を使用しています)。これにより、プロトコルの可能な高度なカスタマイズのために、一つの基本的な脂質ダイナミクス15、シナプス形成を含む、免疫学、細胞生物学、および生化学における質問の非常に多様な範囲に対処するために、STEDイメージングと共に、基本SLB技法を使用することができ16、17細胞内シグナル伝達、および腫瘍細胞の転移18。
開示事項
The authors have nothing to disclose.
謝辞
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
資料
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
参考文献
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved