Method Article
腸神経系のその場のCa 2+イメージングに
要約
The enteric nervous system (ENS) is a network of neurons and glia located in the gut wall that controls intestinal reflexes. This protocol describes methods for recording the activity of enteric neurons and glia in live preparations of ENS using Ca2+ imaging.
要約
Reflex behaviors of the intestine are controlled by the enteric nervous system (ENS). The ENS is an integrative network of neurons and glia in two ganglionated plexuses housed in the gut wall. Enteric neurons and enteric glia are the only cell types within the enteric ganglia. The activity of enteric neurons and glia is responsible for coordinating intestinal functions. This protocol describes methods for observing the activity of neurons and glia within the intact ENS by imaging intracellular calcium (Ca2+) transients with fluorescent indicator dyes. Our technical discussion focuses on methods for Ca2+ imaging in whole-mount preparations of the myenteric plexus from the rodent bowel. Bulk loading of ENS whole-mounts with a high-affinity Ca2+ indicator such as Fluo-4 permits measurements of Ca2+ responses in individual neurons or glial cells. These responses can be evoked repeatedly and reliably, which permits quantitative studies using pharmacological tools. Ca2+ responses in cells of the ENS are recorded using a fluorescence microscope equipped with a cooled charge-coupled device (CCD) camera. Fluorescence measurements obtained using Ca2+ imaging in whole-mount preparations offer a straightforward means of characterizing the mechanisms and potential functional consequences of Ca2+ responses in enteric neurons and glial cells.
概要
腸神経系(ENS)は、消化管1の壁内に埋め込 まれた2神経節のある叢で構成されています。これらの筋肉内の神経回路は、筋層間神経叢(MP)と粘膜下神経叢(SMP)は、ニューロンと腸溶性グリア( 図1)2で構成されている。 MPとSMPは、それぞれ、胃腸(GI)などの腸運動として機能し、上皮吸収および分泌、3を制御する。腸溶性グリアは神経節内のニューロンに近接して配置されているが、腸溶性グリアの集団はまた、繊維路と腸壁3,4の余分な神経節部分を相互接続内に存在する。腸グリアは、元々ニューロンにのみ栄養サポートを提供すると考えられていた。しかし、最近の研究では、強くENSは5,6機能するためのニューロングリア相互作用が必須であることを示唆している。例えば、データは、腸グリアは神経活動を7に「聴く」ことを示しているそして、神経回路6,8を変調する酸化ストレス9から腸ニューロンを保護し、損傷10,11に対応して新たな腸ニューロンを生成することができる。この技術審査で提示プロトコルは、その場の細胞内Ca 2+イメージングで使用してニューロンと腸溶性グリア間の複雑な相互作用を検討するためのシンプルかつ堅牢な方法を提供する。
Ca 2+が興奮性細胞に遍在シグナル伝達分子であり、神経系12におけるシナプスシグナル伝達事象において重要な役割を果たしている。ニューロンまたは腸溶性グリアの励起はどちら流入によってカルシウム2+透過チャネルまたはCaを通じて細胞内カルシウムストアから2+放出を細胞質Ca 2+濃度の上昇を誘発する。蛍光色素でニューロンおよびグリアにおけるイメージングのCa 2+トランジェントの機能的な組織とダイナミクスを研究するために設立され、広く使用される技術であるENS 13-17。のCa 2+イメージングは、ICCのペースメーカーネットワーク18および腸平滑筋19,20を通して興奮の広がりを解明するために、完全な消化管組織セグメントを研究する上で重要なツールであることが示されている。これは、生理的パラメータの広いスペクトルを調べるために、研究者を可能にし、それらの空間分布と時間的なダイナミクスの両方に関する情報を提供します。細胞は、効率的に膜透過性蛍光指示薬、最適化された染色プロトコル21を使用して、低侵襲性の方法で染色することができる。これは、生体内 23だけでなく、機能的に保存調剤14-16,22のニューロンの数が多く、腸溶性グリアを監視する機会を提供しています。組織標本をホールマウントバルクは、Ca 2+に結合した場合、その蛍光を増加するようのFluo-4などの高親和性のCa 2+指示薬色素がロードされている。蛍光の変化はCCDカメラおよびアナによって記録されるデジタルで6溶菌。 Ca 2+の出現は、ニューロンとグリア細胞の相互作用、様々な刺激に応答し、リアルタイムで消化プロセスにおけるこれらの細胞型の関与をモニターする機会を提供した。
その場でのCa 2+イメージングは、腸ニューロンとグリアのシグナル伝達機構に大きな洞察をもたらしたし、細胞培養モデル6,24に比べていくつかの明確な利点を有している。まず、 その場での製剤は、ニューロンとグリアのネイティブマトリックス環境を維持し、無傷組織を標的とするためにその接続の大部分を残す。第二に、遺伝学と培養された腸溶性グリアの形態は大きく、生体内 6,24と比較して変化している。第三に、多くのヘテロタイプの相互作用は、初代細胞培養中に失われ、この制限は、細胞 - 細胞相互作用を評価する。培養した細胞は、基本的な特性の調査、彼らのusefulneに適していますが、腸溶性グリアと神経細胞の間の複雑な相互作用を研究するためのssは限られている。シナプス経路は25そのまま残るように、その場でアプローチを使用して調査ニューロン-グリア相互作用は、より生理学的に関連ある。細胞培養のアプローチと比較すると、 その場でのアプローチで体系的にニューロンと腸溶性グリア間の複雑な相互作用を理解するための改善された条件を提供しています。さらに、全体のマウント製剤における神経節のある叢の平面組織は、細胞内Ca 2+トランジェントの蛍光イメージングのための理想的であり、この技術はENSのニューロン-グリア活性を評価するための直接的なアプローチを提供します。
プロトコル
注:実験動物からの組織が関与する次の手順では、動物の2013年の安楽死のためにAVMAガイドラインと一致しているとミシガン州立大学IACUCによって事前に承認された。
1.組織調製
- 酸素または物理的障壁をイソフルランとの直接接触から動物を防ぐことを確実にする、室の床に吸収材料上に液体イソフルラン3~5 mlで配置することにより、2.5%のイソフルランを含むチャンバの研究動物を麻酔。フットパッドをつまんで麻酔深度のためのテスト。
NOTE:後肢の引っ込め反射が存在しない場合、麻酔の深さが適切であると考えている。適切に麻酔をかけた後、頚椎脱臼によりマウスを安楽死させる - 仰臥位で動物を置き、70%エタノールで腹部の皮膚をきれいに。正中線で腹部の皮膚を挟ま6センチのメディアを作るために外科用ハサミを使用するように鉗子を使用して、内部消化器官を露出する白線に沿ってL切開。
- 腹膜内部の回腸を見つけて、公開する鈍鉗子を使用してください。ハサミで回腸/結腸腸間膜をカットし、腸の解明始める。
- 腸の長さが十分に解明された後、回腸の準備のために盲腸に胃と近位に腸遠位をカット。大腸の準備のために、直腸に盲腸と近位結腸遠位をカット。
- すぐに腸のセグメントを削除し、氷上で3μMニカルジピン塩酸塩及び1μMスコポラミン、塩酸を添加したDMEM / F12培地(以下、「メディア」という。)とのビーカーに入れてください。これらの阻害剤の添加は、消化管平滑筋を麻痺させることにより、顕微解剖とその後のイメージングを容易にします。
- 確立された解剖学的マーカーに基づいて関心の切断セグメント( 例えば 、空腸、回腸、遠位または近位結腸)。通常utiliz回腸遠位部または遠位結腸からの電子組織。しかし、すべての腸の地域で、負荷や画像筋層間神経細胞とグリアを分離するために同じ基本的な手順を使用します。
- チルド媒体で充填シルガードコーティングしたペトリ皿に希望腸セグメントと場所の小さなセグメント(4-6 cm)を取り外します。
- 近位および昆虫ピンと腸のセグメントの遠位端部を固定し、縦に腸間膜の国境に沿って切断し、まっすぐにすることによって、腸の管を開きます。
- 細かい鉗子(#5、#最高の45分の5作品)と、非常に微細な春のはさみを使用して粘膜層を離れて解剖まで、慎重に粘膜側と光張力下でフラットピン組織。
注:適切に行われていない場合は、粘膜の除去は、ENSのための非常に外傷性であることができます。品質の準備のために、剥離やこすることによって粘膜の突然の除去を制限するように注意してください。ベストプラクティスは、粘膜を持ち上げ、細かいハサミで下にカットすることです。 - 小さい準備に組織を切断Sイメージング皿に(約0.5cm 2)とピン新鮮なメディアとの氷上に置かれ(円形筋層が上を向くようにして4隅)。
- 慎重に筋層間神経叢を露出するように細かいピンセットで離れてからかうことで円形の筋肉を離れて解剖。過度のストレッチは避けてください。
- 新鮮な培地と氷と変更ソリューションに戻ってイメージングディッシュを置きます。
- [メディアにディスパーゼ1 U / mlの(4.48ミリグラム/ 8ミリリットル)、コラゲナーゼタイプII 150 U / mlの(5.45ミリグラム/ 8ミリリットル)]皿当たり酵素ミックスの2ミリリットルを準備します。
- 氷から皿を取り出し、ステップ1.13から酵素ミックスを追加します。
- 5%CO 2/95%空気で15分間、室温で皿をインキュベートする。
- メディア3回と再ピンの角を持つウォッシュ組織標本。
2.のロードのFluo-4色素
注:指示色素を搭載した蛍光色素および組織の処理中に制限された光と協力して光退色を避ける。
- 4μMのFluo-4ローディング溶液を準備します。
- 4 mMのフルオ-4株式の1.5μlのアリコートに1.5ミリリットルのメディアとの250mMプロベネシド株式の1.2を添加する。のFluo-4を50μg、AMに、4mMのフルオ-4ストックはプルロニックF-127の11.4液(0.25%クレマホール-ELを補充したDMSO中20%)を添加することにより調製される。
- 37℃の暗黒インキュベーター内で45分間のFluo-4ローディング溶液中でプレップをインキュベートする。
- インキュベーターから取り出し、メディアで3回準備を洗う。
- メディアは200μMのプロベネシドを含む、イメージングの前に37℃で15分間インキュベートするための交換媒体。
注:プロベネシドが神経細胞に多剤耐性トランスポーターを阻害する薬剤である。この薬の添加は、染料を押し出すための神経細胞の能力を阻害し、神経ラベリングを強化します。プロベネシドの不在中のCa 2+指示色素のバルクロードは、主にグリア細胞の負荷を生成します。プロベネシドの添加は、ニューロンおよびグリアの応答の可視化を可能にする。 - 準備クレアル修正BSバッファ。
- 続いてコンポーネントの(mm)を最終濃度があるように修正されたクレブス緩衝液を作る:121のNaCl、5.9のKCl、2.5のCaCl 2、1.2のMgCl 2、1.2のNaH 2 PO 4、10 HEPES、21.2のNaHCO 3、1ピルビン酸及び8個のグルコース(NaOHでpH7.4に調整されたpH)。のCa 2+イメージングおよびホールマウント解剖時の筋肉の収縮を抑制するために3μMニカルジピンおよび1μMスコポラミンを追加します。
3.イメージングと分析
注:蛍光光源、顕微鏡、高品質のCCDカメラと適切な取得ソフトウェアで、少なくとも基本的なイメージング·リグを使用してください。光源と特定の用途に応じて他の成分の添加を変える。フィルターホイールおよびシャッターは、従来のキセノンアーク光源を使用しなければならない。しかし、光源及び照明システムは、これらのコンポーネントを必要としないLED。
- RECを置き顕微鏡下でチャンバーディング及び多重加熱シリンジリザーバに重力流灌流システムを用いて、37℃でクレブス緩衝液2-3 ml /分の連続的な灌流速度を確立する。真空トラップに接続された入力と吸引ラインの両方に気泡の発生を防止することを確認してください。
- 明視野照明下での焦点に希望叢を持参してください。フォトブリーチングにつながる可能性があり、組織を、overexposingは避けてください。
- 神経節内のFluo-4の負荷を調べ、イメージングのための健全な神経節を選択します。不健康/損傷した神経節は、自己蛍光または点状の形態を示すであろうし、画像化のために使用すべきではありません。
- 神経節を選択すると、カメラへの光路を迂回し、画像取得ソフトウェアを使用してライブ画像を取得する。神経節に焦点が合うと、画像取得速度と露光時間を設定していることを確認してください。
注:画像取得率と時間は研究者が記録したいイベントによって異なります。ほとんどの実験、イメージの場合グリアのCa 2+応答は、神経細胞におけるCa 2+トランジェントとして急速なようではないので、伝統的にグリア細胞のために、0.5〜1 Hzで取得し、神経細胞のために、最大2-10 Hzのしている。 - 実験を開始し、30秒間のベースラインの活動を確立します。
- このような2〜3ミリリットル/分の速度で重力流灌流システムを使用して受容体アゴニストおよびアンタゴニストのような関心のある予め温め薬を適用する。通常のバッファーの灌流に戻っアゴニスト/アンタゴニストの適用に従って、少なくとも10分の洗浄/回復期間を可能にする。
NOTE:薬物適用時間は、個々の化合物および実験デザインに依存して変化する。一般に、アゴニストの20~30秒のアプリケーションは、ニューロンおよびグリア細胞におけるGタンパク質共役受容体を活性化するのに十分である。しかしながら、(例えば、ニコチン性アセチルコリン受容体のような)リガンド依存性イオンチャネルはせいぜい5〜10秒の適用時間を必要とする。さらに持続エクスポージャーは、リガンド依存性イオンチャネルが急速にDESEになりますnsitize。アンタゴニストは、受容体経路の完全な遮断を確保するために約3~15分間適用されるべきである。しかし、これはグロス一般化され、研究者は常に彼らの特定のパラダイム内の任意の試験薬を最適化する必要があります。 - 実験の記録とビュータイムラプスムービーを停止します。適当な画像解析ソフトウェアを用いて関心注意深く選択領域(ROIの)。
- 正規化し、その初期ベースライン蛍光値に対してROI蛍光強度を比較するためにソフトウェアを使用してください。正規化された蛍光の変化は、の[Ca 2+] iの変化に正比例する。
- ROI - ((F 1 - F 0)/ F 0)F1は、任意の所与の蛍光バックグラウンド、 - ΔF/ F =(F 0)/ F 0(F 1)を使用して、以前に26の記載された方法の変法を使用し点F0、評価精度を向上させるために、ベースラインの蛍光である。この変更を補助筋層間神経叢の根底にある筋層の動きを示す組織調製物における蛍光の変化からノイズを低減する。
結果
この技術の適切な使用は、組織標本をマウント全体の研究者は、正確に細胞内Ca 2+の[Ca 2+] iの腸溶性ニューロンにおける過渡現象とにおけるグリアを測定することができます。マウス結腸の筋層間神経節内のグリア細胞におけるアゴニスト誘発のCa 2+応答の代表的な例は、 ビデオ1に示されている。以下の結果は、我々はこの方法を用いて得られてきたいくつかの代表的な結果を示すことを意味する。まず、 図2は 、腸グリアを測定した実験結果を示した[Ca 2+] iのモルモット結腸の縦筋層間筋肉神経叢(LMMP)準備中のATPによる刺激に応答して変化する。具体的には、この図は、分析筋層間神経節および腸神経の位置を示すアスタリスクの概要を含む上記の実験プロトコルを適切に分析するための方法を示している。これらの結果は、私の[Ca 2+] iのモルモット筋層間神経膠での動員に百マイクロモルのATPの最適な用量をllustrate。この応答は、腸のグリア刺激を較正し、刺激をテストするための応答を正規化するために使用することができる。次に、 図3は 、黄色の円の周囲に示され、適切にグリア細胞の周囲の関心領域(ROI)を選択する方法を解明。これらの結果は、基本条件下および薬理学的刺激に応答して所望の蛍光の変化を示す。最後に、 図4は、全体のマウントの準備での[Ca 2+] iの応答のために腸溶性グリアと神経細胞を選択するための空間的な考慮事項を示しています。
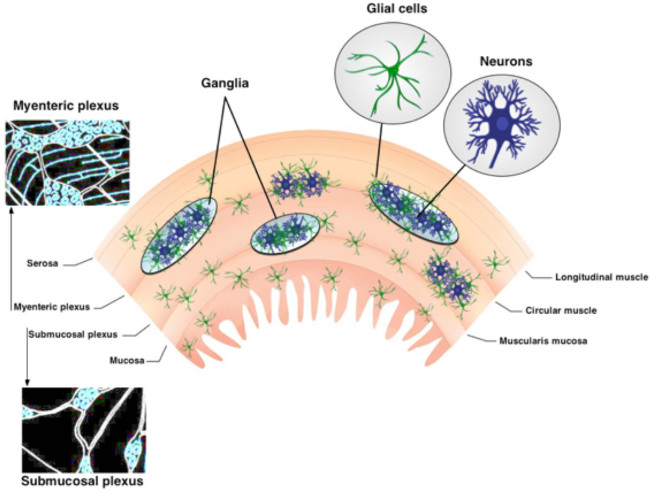
ENSの図1.組織。ENSは、2つの主要な神経節のある叢が含まれています。筋層間神経叢はリットルとの間に配置されるongitudinal円形筋肉層。粘膜下神経叢は、粘膜と円形筋層の間に位置している。 ENSはもっぱらニューロンと腸溶性グリアから構成されている。神経線維トラクトは、神経節を接続してください。 この図の拡大版をご覧になるにはこちらをクリックしてください。
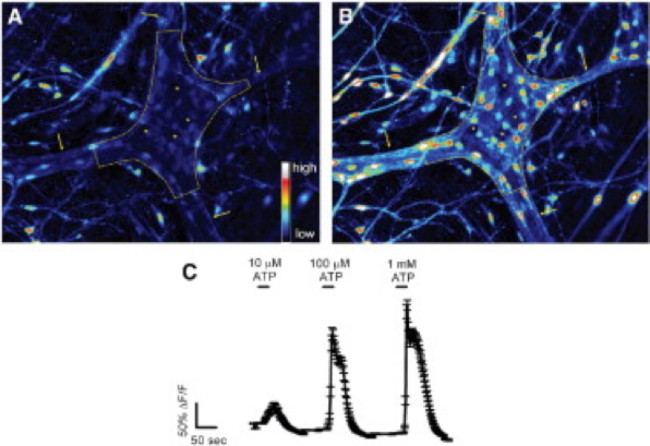
その場での ATPに対するモルモット結腸の筋層間神経叢に応答図2.腸グリア。 (A)筋層間神経節内のFluo-4蛍光は基本条件下(破線によって概説)。矢印は、100マイクロモル/ LのATP、グリア細胞に刺激を受けると(B)。厚いinterganglionic繊維路を指してではなく、ニューロン、急激に増加するのFluo-4の[Ca 2+]の増加を示す蛍光私。最大応答24を誘発1ミリモル/ Lの用量依存的にATPに応答する(C)腸グリア。応答する細胞が小さく、はるかに大きなニューロン(アスタリスクでマーク暗いスペース)を囲むことに注意してください。 表示するには、こちらをクリックしてくださいこの図の拡大版。
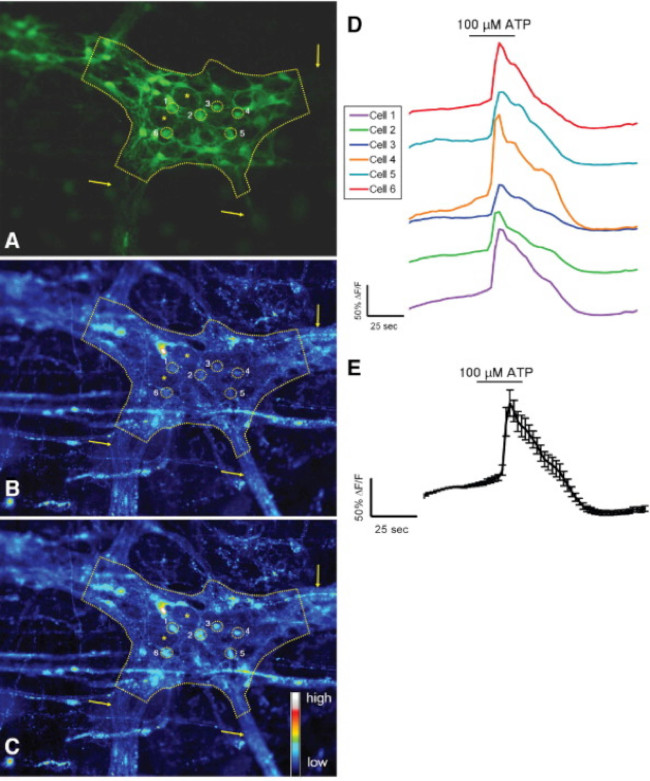
その場で ATPに結腸の筋層間神経叢の応答図3.マウスS-100-GFP +細胞。(A)S-100-GFP +マウス結腸の筋層間神経節におけるグリア細胞(緑)(破線で概説)。神経節内のグリア細胞の周囲の関心の6つの領域(ROIを)を黄色の円で示されている。矢印は、神経節に通じる太い線維トラクトを示している。アスタリスクdの2腸溶性ニューロンのenoteの場所。100マイクロモル/ LのATPとの刺激の後、基礎条件の下でRhod-2蛍光。(C)を示す(B)と同じ神経節、グリア細胞が増加して応答がの[Ca 2+] iの増加Rhod-で示した2蛍光。(D)-Cに示した各ROIに対応するトレースします。(E)は D 24に示す6 ROIの応答を(平均±SEM)平均した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
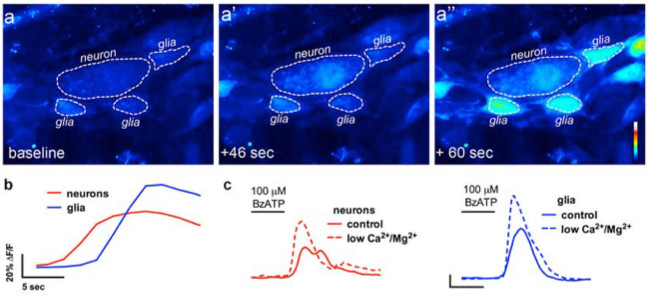
腸溶性ニューロン対グリア通信のその場イメージングでは、図4。 (A)代表的な画像(疑似カラー)のCa 2+イメージング実験ホールマウントから筋層間神経叢の調製は、神経細胞のP2X7受容体アゴニストBzATP(100μM、30秒)でチャレンジした。神経作用薬の前、周囲の腸のグリア細胞、グリアにおける経時的な蛍光の変化(青)の(A ")。(B)分析およびニューロンニューロン(A ')でFLUO4蛍光の増加を引き起こすことに注意してください(赤)通常のバッファ(実線でBzATPへの神経作用薬、BzATP。(C)は、ニューロンとグリア反応の適用後)、バッファにニューロンのP2X7受容体13を増強するために、低カルシウム2+およびMg 2+(破線)を含む。 してくださいこの図の拡大版を表示するには、こちらをクリックしてください。
中腸溶性グリアでビデオ1アゴニスト誘起のCa 2+応答その場。このビデオは、Ca 2+指示薬色素、フルオ-4を搭載したマウスの遠位結腸から筋層間神経節を示しています。示されたときに、グリア細胞アゴニスト、ADPは、浴に添加される。 ADPはフルオ-4蛍光で一時的な上昇によって観察されるよう腸溶性グリアに細胞内Ca 2+の上昇を誘発する。 このビデオを見るにはこちらをクリックしてください。
ディスカッション
The methodologies described in this manuscript provide a consistent approach to effectively study neurons and enteric glia in the ENS. Although imaging neurons and enteric glia in culture has yielded a wealth of insight into the function of individual cells, studying these cells in their native, multi-cellular environment is crucial for our understanding their physiology and pathophysiology. Fluorescence microscopy is a crucial technique for assessing multidirectional interactions of cells in the ENS. Loading cells of the ENS with selective fluorescent markers and image acquisition with high-resolution microscopy permits quantitative observations of cellular activity in the ENS. Imaging live tissue samples of the ENS is performed relatively quickly and generates large amounts of in-depth functional and spatial data. Mouse myenteric and submucosal plexus preparations used in these experiments allow for molecular and genetic manipulation approaches. Ca2+ imaging in whole-mount preparations provides a useful tool for the assessment of neuron-glia interactions.
In advanced experimental paradigms, several probes can be combined to obtain information about different events within the cells. Fluorescence microscopy can record images with enhanced contrast of specific molecules, if an appropriate fluorescent label is used. Fluo-4 was chosen because it possesses a large dynamic range. Sufficient incubation time is vital when using the AM dyes in ENS. Dye concentration and loading method may need to be adjusted to achieve best results. Ideal preparations should be loaded with sufficient dye to visualize changes in fluorescence but not so much so that the dye chelates the target ions and interferes with intracellular signaling. Exposure to fluorescent light should be limited to prevent phototoxicity in cells and photobleaching of dyes.
Investigators must be careful with several steps of this experiment, especially solution and tissue preparation. Particular care has to be taken during processing and dissection of ENS tissue in order to maintain cellular functions. The GI tract contains several layers and tissue varieties, which pose challenges for dissection and imaging quality in these whole-mount preparations 27. Furthermore, the interconnecting fiber tracts of the MP are wider and ganglia are larger than those of the SMP 2. The neuronal density of the myenteric plexus is higher compared to that of the submucosal plexus 28. Slow and imprecise dissections will have detrimental effects on the quality of the plexus preparations and thus the overall success of the experiments. Therefore, clean/undamaged tools, practice and manual dexterity are critical to this procedure.
In whole-mount tissue preparations, careful consideration should be taken when drawing the regions of interest (ROI) to correctly assess the kinetics and degree of observed change in fluorescence intensity of the desired cell type. As the ganglia are located on a contractile muscle layer, motion artifacts caused by gut motility are a primary concern during in situ imaging. Thus, suppressing these motion disturbances through re-pinning tissue preparations after incubation with enzymes and the addition of pharmacological inhibition (nicardipine/scopolamine) to buffers permits clear and reliable image acquisition. Aside from pharmacology and mechanical approaches to prevent tissue movement, recent studies illustrate the application of advanced software methodologies and cell type response characteristics to correct for residual tissue movement in the recordings and improve the accuracy of analysis 29. Barring these technical hurdles, this method provides physiologically relevant conditions to assess morphologic and quantitative characteristics of neurons and enteric glia in the ENS.
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by grants from the Pharmaceutical Research and Manufacturers Association of America (PhRMA) Foundation (to B. Gulbransen), National Institutes of Health (Building Interdisciplinary Research Careers in Women’s Health) grant K12 HD065879 (B. Gulbransen) and start-up funds from Michigan State University (B. Gulbransen).
資料
| Name | Company | Catalog Number | Comments |
| BubbleStop Syringe Heater | AutoMate Scientific | 10-4-35-G | |
| CaCl2 | Sigma | C3306 | |
| Collagenase, Type II, powder | Gibco | 17101-015 | |
| Dispase | Sigma-Aldrich | 42613-33-2 | |
| Dissection tools | Roboz | ||
| DMSO | Sigma-Aldrich | D5879 | |
| Fixed-stage microscope | Olympus | BX51WI | |
| Fluo-4 AM dye | Invitrogen | F-14201 | |
| Glucose | Sigma | G8270 | |
| Insect pins | Fine Science Tools | Minutien Pins | |
| iQ Live Cell Imaging Software | Andor | Andor iQ3 | |
| KCl | Sigma | P3911 | |
| MgCl2 | Sigma | M9272 | |
| NaCl | Sigma | S9888 | |
| NaH2PO4 | Sigma | S8282 | |
| NaHCO3 | Sigma | S6014 | |
| Neo sCMOS camera | Andor | Neo 5.5 sCMOS | |
| Nicardipine | Sigma | N7510 | |
| Perfusion chamber | Custom | ||
| Peristaltic pump | Harvard Apparatus | Model 720 | |
| Pluronic F-127 | Invitrogen | P3000MP | |
| Probenecid | Molecular Probes | P36400 | |
| Scopolamine | Sigma | S1013 | |
| Sutter Lambda DG-4 | Sutter | DG-4 | |
| Sylgard | Dow Corning | 184 | |
| Temperature Controller | Warner Instruments | TC-344C |
参考文献
- Furness, J. B. Types of neurons in the enteric nervous system. Journal of the Autonomic Nervous System. 81 (1-3), 87-96 (2000).
- Furness, J. B. The organization of the autonomic nervous system: peripheral connections. Neuroscience. 130 (1-2), 1-5 (2006).
- Pham, T. D., Gershon, M. D., Rothman, T. P. Time of origin of neurons in the murine enteric nervous system: sequence in relation to phenotype. Journal of Comparative Neurology. 314 (4), 789-798 (1991).
- Nasser, Y., et al. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 291, G912-927 (2006).
- . Glial cells in the gut. Neurogastroenterology & Motility. 17 (6), 777-790 (2005).
- Broadhead, M. J., Bayguinov, P. O., Okamoto, T., Heredia, D. J., Smith, T. K. Ca2+ transients in myenteric glial cells during the colonic migrating motor complex in the isolated murine large intestine. J. Physiol. 590, 335-350 (2012).
- Gulbransen, B. D., Bains, J. S., Sharkey, K. A. Enteric glia are targets of the sympathetic innervation of the myenteric plexus in the guinea pig distal colon. J. Neurosci. 30, 6801-6809 (2010).
- McClain, J. L., et al. Ca2+ Responses in Enteric Glia Are Mediated by Connexin-43 Hemichannels and Modulate Colonic Transit in Mice. Gastroenterology. 146 (2), 497-507 (2014).
- Chandrasekharan, B., et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress. Neurogastroenterology & Motility. 23 (2), e131-e126 (2011).
- Abdo, H., et al. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 24, 1082-1092 (2010).
- Aube, A. C., et al. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 55, 630-637 (2006).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nature Reviews Molecular cell biology. 1 (1), 11-21 (2000).
- Gulbransen, B. D., et al. Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis. Nat Med. 18, 600-604 (2012).
- Bayguinov, P. O., Hennig, G. W., Smith, T. K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon. J Physiol. 588, 399-421 (2010).
- Okamoto, T., Bayguinov, P. O., Broadhead, M. J., Smith, T. K. Ca(2+) transients in submucous neurons during the colonic migrating motor complex in the isolated murine large intestine. Neurogastroenterol Motil. 24 (8), 769-778 (2012).
- Kunze, W. A., Clerc, N., Furness, J. B., Gola, M. The soma and neurites of primary afferent neurons in the guinea-pig intestine respond differentially to deformation. J Physiol. 526, 375-385 (2000).
- Schemann, M., Michel, K., Peters, S., Bischoff, S. C., Neunlist, M. Imaging and the gastrointestinal tract: mapping the human enteric nervous system. Am J Physiol. 282, G919-G925 (2002).
- Hennig, G. W., et al. Visualization of spread of pacemaker activity in through ICC in guinea-pig antrum. Neurogastro Motil. 14, 575 (2001).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Induction and organization of Ca2+ waves by enteric neural reflexes. Nature. 399, 62-66 (1999).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Propagation and neural regulation of calcium waves in longitudinal and circular muscle layers of guinea-pig small intestine. Gastroenterology. 118, 982-984 (2000).
- Jessen, K. R., et al. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. Journal of Neuroscience. 3 (11), 2206-2218 (1983).
- Gulbransen, B. D., Sharkey, K. A. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 9, 625-632 (2012).
- Gomes, P., et al. ATP-dependent paracrine communication between enteric neurons and glia in a primary cell culture derived from embryonic mice. Neurogastroenterology & Motility. 21 (8), e870-e862 (2009).
- Gulbransen, B. D., Sharkey, K. A. Purinergic neuron-to-glia signaling in the enteric nervous system. Gastroenterology. 136, 1349-1358 (2009).
- Ren, J., Bertrand, P. P. Purinergic receptors and synaptic transmission in enteric neurons. Purinergic Signal. 4, 255-266 (2008).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol Rev. 79, 1089-1125 (1999).
- Dongcheng, Z., et al. Neural crest regionalisation for enteric nervous system formation: implications for Hirschsprung's disease and stem cell therapy. Developmental Biology. 339 (2), 280-294 (2010).
- Gershon, M. D. Behind an enteric neuron there may lie a glial cell. J Clin Invest. 121, 3386-3389 (2011).
- Boesmans, W., et al. Imaging neuron-glia interactions in the enteric nervous system. Frontiers in Cellular Neuroscience. 7, (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved