Method Article
鶏の胚内の神経堤細胞と血管の二重標識は、ひよこGFP 神経管移植とカルボシアニンDyI注射を用いた
要約
ここでは、血管内DiI注射と組み合わせたひよこGFP 神経管の種内移植を用いた神経堤細胞および血管の二重標識を報告する。この実験技術により、臓器形成中にNCC由来の(腸管)神経系と血管系の発達を同時に可視化し、研究することができます。
要約
すべての開発器官は、神経系(感覚および運動制御用)と血管系(ガス交換、流体および栄養供給用)の両方に接続する必要があります。その結果、神経系と血管系の両方が互いに一緒に発達し、分岐アーキテクチャの顕著な類似点を共有しています。ここでは、神経堤由来の神経組織(この場合は腸神経系)と血管系の同時発生を研究することを可能にする胚操作を報告する。これは、同じ胚の血管DiI注射と組み合わせた、神経管の離散セグメントの移植、および関連する神経堤の移植 を介して チキンキメラを生成することによって達成される。我々の方法は、種内移植のためにトランスジェニックひよこGFP 胚を使用し、移植技術は1970年代以来大きな効果を発揮して使用される古典的なウズラ-ひよこ種間移植プロトコルよりも強力である。ひよこGFP-ひよこ内種移植は、移植された細胞のイメージングと無傷の組織におけるその予測を促進し、種の違いに関連する細胞開発における潜在的なバイアスを排除する。この方法は、鳥の胚のアクセスの容易さ(他の脊椎動物胚と比較して)を最大限に活用して、腸神経系と血管系の共発達を研究する。
概要
鶏の胚は脊椎動物発生生物学において非常に貴重なモデル生物であり、ovoでの開発は、子宮内で発達する脊椎動物では行うことが不可能な実験的操作を可能にするため、少なくとも。このアクセシビリティと操作の容易さは、発生生物学の分野で多くの精巧な発見で重要な役割を果たすひよこ胚につながっています。最も強力な技術の中で、ウズラひよこキメラ胚を使用して細胞の運命を研究してきました, 1970年代の1-3でニコール・ル・ドゥアラン教授によって開拓された方法.特に、ウズラひよこキメラは、初期の発達の間に非常に回遊性神経堤細胞(NCC)集団を遺伝的にマークし、従うために特に有用であった。NCCは、神経管の余白の後部外胚に生じる回遊細胞の多能集団であり、脊椎動物胚全体に幅広い細胞型を生じさせる。これらには、頭蓋顔面構造(軟骨、骨、筋肉)、神経およびグリア(感覚および自律神経系における)、メラノサイト、および内分泌系2,4,5の細胞の亜集団が含まれる。NCCの運命に影響を与える最も重要な要因の1つは、神経管の前後軸に沿った最初の位置である。例えば、腸管神経系(ENS)のニューロンおよびグリアを生じさせる腸管NCCは、2つの離散サブ集団から生じる:第1は迷走(尾頭脳)領域に位置し、第2は神経管6-13の仙骨領域に位置する。神経管の対応する領域の種間または内接合は、これらの細胞に恒久的にラベルを付け、その後、神経管の余白での出生から消化管内の最終目的地までの追跡を可能にする選択の技術であった6,7,10。
他の動物モデルと比較して、ひよこで行うより容易な別の胚操作は、血管系の重要な標識である。確かに、ひよこ胚が発達するにつれて、それは黄身から酸素と栄養素を循環する胚外血管ネットワークの上に横たわっている。卵黄の表面に位置するこのアクセス可能な血管ネットワークは、器官形成中に胚の発達中の血管系を標識するゲートウェイとして使用することができる12,14-17。各種色素DiIなどの種々の色素の血管内注射は、新生血管網のすべての発光血管を線引き/染色することを可能にする。
発達器官は神経系(感覚および運動制御用)と血管系(ガス交換、流体および栄養供給用)の両方に接続する必要があるため、2つのネットワークは互いに並行して発達し、分岐アーキテクチャ18-20において顕著な類似点を共有する。ここでは、臓器形成中の血管系と共にNCC由来ENSの同時発生を研究することを可能にする胚操作を報告する。これは、神経堤を含む神経管の離散セグメントの移植を介して鶏キメラを生成することによって達成され、血管DiI注射と組み合わされる。ウズラチキンキメラからの進歩として、我々の方法は、細胞内移植のためにトランスジェニックGFPひよこ胚を使用し、細胞とその予測をイメージングするという点で移植技術をより強力にし、種の違いに関連する潜在的なバイアスを排除する。
プロトコル
1. 神経管アブレーションのためのマイクロメスの調製
- 市販のスチール製縫製針からマイクロメスを形作ります。
- まず、パワードベンチグラインダーに取り付けられた粉砕ホイールを使用して、両側の針を平らにします。
- メスの成形を開始し、最初に制御された円形の動きを使用して粗いグレードのアーカンソー石で、針の両側に交互に形成します。
- 非常に細かいグレードのアーカンソー石に同じ研ぎの動きを持って、細かく定義された最先端を持つ超微細なマイクロメスを形作ります(図1A、B)。
注:マイクロメスの代替は、電解的に研いだ針、市販のタングステン針、または引っ張られたガラス針である可能性があります。
2. 野生型とGFP卵を所望のステージにインキュベート
- 受精鶏卵とトランスジェニックGFP鶏卵を、この温度で発生が停止するため、インキュベーション前に14〜15°Cの冷却インキュベーターに保存します。卵は数日間、最大1週間保存します。
- 開発を開始するには、野生のタイプとGFPの卵をトレイに水平に置き、加湿(58〜60%)で同時にインキュベートします。37.5 ºCのインキュベーターは、胚が神経管移植のための一致段階にあるように。
- 迷走神経管移植を行うための発達の10-12のスマイト段階で胚を得るために、ハンバーガーとハミルトン21の発達テーブルに従って1.5日間(33〜38時間)および胚をステージにインキュベートする。
3. 卵を窓と移植に備える
- 一度に1つの卵をカスタムメイドの卵ホルダーに移動して窓を付けます。卵の尖った端の上面に、まっすぐなはさみで繰り返しタッピングして、卵の殻に小さな穴を開けます。
- 卵から2〜3mlのアルブミンを181/2G皮下注射針と5mlの注射器で取り出します。アルブミンを取り除くことは卵の中の黄身を下げ、胚に損傷を与えることなく、その後の窓を容易にする。
- アルブミンを捨てる。細かいはさみでサイズにカット透明テープの小さなストリップで穴をシールします。
- 湾曲したはさみを使用して、卵殻の上面に別の穴をタップします。はさみの先端を穴に入れ、ハサミをベンチに平行に保ち、シェルの上に直径約2cmの窓を切り取るために円形の動きで働きます。
- はさみを静止した位置に保ち、卵を回転させます。卵殻の取り外したディスクを捨てます。E1.5では、胚は黄身の上に暗い黄色の円盤として認識可能である。
- ピンセットを使用して卵の中に落ちた貝の破片を取り除きます。未受精卵を捨てる(それ以外の場合は薄い黄色の黄身の上に小さな白い斑点によって識別される)。
4. 移植された組織を受け取るために宿主胚を準備する
- ステレオ顕微鏡を目の高さに調整し、グースネック光源の向きを最適化して、反射を引き起こすことなく胚を適切に照らします。
- 適切な胚を視覚化するには、口管と引っ張られたガラスマイクロピペットを使用して、暗い黄色の円盤の中心の下に少量のインドのインクを注入する(図1C、Oii)。
- ペニシリン/ストレプトマイシンを含むPBSで、インク50:50を100μg/mlの最終濃度で調製します。ブラトデアルムの周囲外の黄身膜を通してマイクロピペットを挿入し、慎重に胚の真下に先端を角度付けします。
- 口管に吹いて胚の下にインクを送ります。口のピペットが許可されていない場合は、代わりに1mlの注射器を使用してください。胚の下に気泡を入れて汚染を引き起こす可能性があり、ガラスのマイクロピペットを慎重に取り除かないように注意してください。これは、正確に行われなければ胚の死につながる微妙なステップです。
- ハンバーガーとハミルトン21 を参照して胚をステージングし、ラボブックにステージを記録します。
- 針ホルダーに取り付けられたカスタムメイドのマイクロメス(または細かいタングステン針)を使用して、マイクロ手術が行われる領域の隣にあるビテリン膜に非常に小さなガッシュを作ります。
- 慎重に2〜3滴のPBSを膜の裂け目の上に塗布し(ガラスマイクロピペットと口管を使用して)胚と膜の間に空間を作り出す。膜内の大きな窓を切り、マイクロ手術が行われる領域全体を露出させます。
- マイクロメスを使用して対象の神経管領域を除去し、下部神経管全体(ビデオ中のスマイト1〜7のレベル)全体にわたるロストラルと尾側横切り切開から始まる。
- 神経管とスマイトの間を両側で切断し、スマイトを損傷することなく、周囲の組織から神経管を分離する。
- 非常に穏やかに、そのまま残るはずの根底にある脊索から神経管を分離する。神経管切除が成功すると、周囲のすべての組織が完全にそのまま残されることに注意してください(図2)。
- 切除された神経管をガラスマイクロピペットに吸引して取り出し、捨てます。
- ラボブックに神経管アブレーションのレベルを記録します。宿主胚はドナー神経管を受け取る準備が整いました。
5. ドナー移植組織の準備
- FITCフィルターを使用した蛍光ステレオ顕微鏡での視視により、ウィンドウ付きのステージに適合したGFP胚を選択します。GFP蛍光は、スマイトを視覚化し、胚をステージすることが非常に容易になります。
- ステージマッチの胚が同定されたら、4回の切開を行い、Pascheff-Wolffスプリングハサミ(図1C、l)を胚の周りの長方形の形で卵子から取り除き、胚スプーンでそっと拾います。
- 胚をシルガードポリマーベースの正方形の時計ガラスに入れます。デュモン#5ピンセットで卵子をそっと振り、付属の黄身を取り除きます。ビテリン膜を取り外し、ステンレスミヌティエンピンを使用して胚をポリマーベースに固定する(図1C)。
- スプリングハサミを使用して、宿主胚から除去されたのと同じ領域で、神経管と周囲のスマイトの周りの長方形の形状で4切開を行う。
- プラスチックトランスファーピペットを使用して、ドナーGFP胚からペン/ストレップPBSの0.2%膵臓を含むウォッチグラスに神経管とスマイト組織を移管する。
- 酵素消化をRTで10分間進め、組織を分離します。酵素中でインキュベーションした後、ハンドルに取り付けられたステンレスミヌティエンピンを使用して、隣接するすべての組織から手動で神経管を分離します。
- ガラスマイクロピペットを使用して、DMEM + 10%血清(例えば、ヤギ、馬または胎児の子牛)を含む別の時計ガラスに解約した神経管を氷上で移し、余分な膵臓をすすぎ、酵素消化を止める。5分後、解剖された神経管は、チックホストに正交的に移植される準備ができている(図2およびS1)。
6. 組織の移植
- ガラスマイクロピペットを使用して、解剖された神経管を時計ガラスから宿主胚に慎重に移す。神経管を正しい前後方方向に配置し、マイクロメスルを使用してひよこ宿主の切除領域に隣接する外植を静かに押す。神経管の向きを識別するために、小さなニックを取り付けたり、小さなニックを切断したりして、小さな外皮の断片を残します。
- 必要に応じて、切除物を切除領域の正確なサイズにトリミングするためにマイクロメスを使用します。
- 神経管をアブレート領域にそっと導き、後側が正しく向き合うよう位置づけます。口の管に取り付けられたガラスマイクロピペットを使用して、移植片を取り巻くPBSおよび/または流体を除去する。これは、ドナーおよび宿主組織が付着し、移植片が確立するのを助ける。
- 脱水や汚れを防ぐために、24 mm 幅のクリアテープで窓全体を密封します。
- 卵殻に鉛筆で印を付けてキメラ胚にラベルを付け、その数をラボブックに記録します。さらなる開発のためにインキュベーターに卵を返します。
7. 宿主胚の血管にDiIを注入する
- 所望の実験時点(ここでは、3〜10日後)で、培養器からキメラ胚を取り出し、まっすぐはさみを使用して透明なテープを取り出し、卵子内の胚にアクセスする。
- 必要に応じて、はさみを使用してシェル内のウィンドウを拡大します。絨毛膜がシェルに付着している場合は、出血を引き起こし、血管の標識を危険にさらす場合は、その絨毛膜を損傷しないように注意してください。
- 黄身のアクセス可能な静脈を選択して、血流が胚に向かっていることを確認します。ビテリン静脈の分岐点を選択します (図 3B, C)。
注:E6.5 - E7.5では、卵黄静脈にアクセスするために、絨毛膜をピンセットで静かに脇に移動する必要があります。E8.5の後、唯一の選択肢は、この段階までに絨毛管内膜が胚を完全に覆っているので、絨毛管内膜静脈の1つに注入することです。 - 2 つのデュモン#5ピンセットを使用して、選択した注射点の上のビテリン膜を取り除き、反対方向に引き裂きます。
- デュモン#5を使用して引っ張られたガラスの針を破り、CellTracker CM-DiIでロードする前に静脈のおおよその大きさに直径を調整します。DMSOで40μg/μlのDiIストックソリューションを作成し、-20°Cで保存します。 4 μg/μlの濃度で0.3 Mスクロース/PBSで動作溶液を調製します。
- 口管との吸引を使用して針に0.3 Mスクロース/PBSのDiIの5-10 μlの間の吸気。古い胚は25μl以上必要かもしれません。E8.5から、胚はより大きく、より多くの筋肉静脈を有し、DiIを装填されたガラス針で刺す前にデュモン#5の位置に保持する必要があるかもしれない。
- 迅速に静脈に針を挿入し、凝固を形成せずにゆっくりと血流に参加できるようにDiIが許可するように口管で着実に吹きます。あるいは、DiI送達用の圧力インジェクタを使用します。
8. 切除または全山試験のための収穫胚
- できるだけ多くのDiIを胚内に保持するには、穿穿なるスプーンにすくい、まっすぐハサミで血管と結合組織を切断して、注射直後に胚を収穫し、卵黄から胚を解放する。
- 任意の緩い膜を除去し、関心のある器官(すなわち、このチュートリアルでは肺と消化管)を解剖し、DiIの拡散を作成する組織を圧縮しないように細心の注意を払う。直ちに、RTで1〜2時間4%PFAに浸漬して組織を固定します。
- 組織をPBSで5分間リンスし、5μg/ml DAPIを含むPBSで15分間リンスします。サンプルをブリッジングされた顕微鏡スライドに取り付けて、全体のマウント検査を行うか、凍結切断のために埋め込みます。
結果
図1 は、神経管の微小外科的隔離および移植を行うために必要な典型的な器具を示す。 図2 は移植手順を示す。移植胚の後に移植の成功のためにスクリーニングされる。これは、移植片由来(GFP+)NCCの存在のために、ステレオ蛍光顕微鏡(典型的にはマイクロ手術後の朝)の下で胚を調べることを含む。移植が成功した場合、GFP+ NCCは神経管の近傍および前腸に向かう早期移動経路で観察することができる。手順が成功しなかった場合、GFP+ NCCは神経管の外で観察されないか、またはそれらが宿主に存在する場合、それらはより少ない数にあるかもしれない。これらの失敗した胚は廃棄されます。典型的には、5-8の神経管移植は1日で行われ、これらの80%は成功する。神経管移植が失敗した理由としては、微小手術中に発生した組織損傷による胚の死亡、または宿主胚に統合する神経管の障害が含まれる。後者は、宿主内の神経管の配置が悪かったり、解離技術が悪かったり、解離酵素に過度に曝露したりして、質の悪い神経管から生じる可能性がある。GFP+細胞の初期スクリーニングステップと同様の後の検査は、腸内にGFPラベルのNCCを持たない胚の実験を行うことによって時間とリソースが無駄にされないことを意味するので有用である。
図3は、血管のDiI注射の手順を示す。DiI注入技術の効率/成功は、まず、注射針を標的静脈の最適な直径に切断し、第2に静脈に針を挿入する際の正確なジェスチャー(反対側を貫通しないように)、第3に一定の速度で吹くことによって注射中に針が差し込まれるのを避けることによって異なります。これらの3つのパラメータのいずれかが間違って行われた場合、出血がすぐに再注入することがほとんど不可能になるため、2回目の試みが行われる前に胚が出血するか、回復に数時間が必要になります。成功した胚は、立体蛍光顕微鏡で観察することによって直ちに選択されるべきであり、迅速に解剖されなければならない。正常な胚では、DiI標識された血管が毛細血管を含む胚全体に存在する(図3C,D)。
胚の収穫と組織切片または全山胃腸管の検査に際して、 典型的な結果は、原始的なENS内のGFP+ NCCとDiIラベル付き腸血管ネットワークの微細な構造を明らかにする(図4)画像スタックがGFP+ ENS細胞とDiI染色血管系の微細投影との間の相互関係を示す3次元(3D)再構成を生成する共焦点顕微鏡を使用して全体実装調製を検討することができる(図4 A-C;G-I;ビデオ 1 と 2)。

図 1.推奨マイクロ手術用器具。 (A) 縫製針から形をしたマイクロメス。 (B) マイクロメスを形作るための細かいアーカンソー石。 (c)a) ストレートハサミ、b)湾曲したはさみ、c)5mlの注射器と181/2G皮下注射針、d)プラスチックピペット、e)カスタムメイドの卵ホルダー、f)黒インク、g)スクエアウォッチガラス、 h)黒シルガードベース付きの正方形の時計ガラス、i)針ホルダーのマイクロメス、j)ミヌーティエンピン、k)ミヌーティエンまたは針ホルダーのタングステン針、l)パシェフ・ウォルフスプリングハサミ、m)デュモン#5ピンセット、n)穿刺スプーン、oi)短い火災引っ張り転送針、オイ) この図の大きなバージョンを表示するには、ここをクリックしてください。
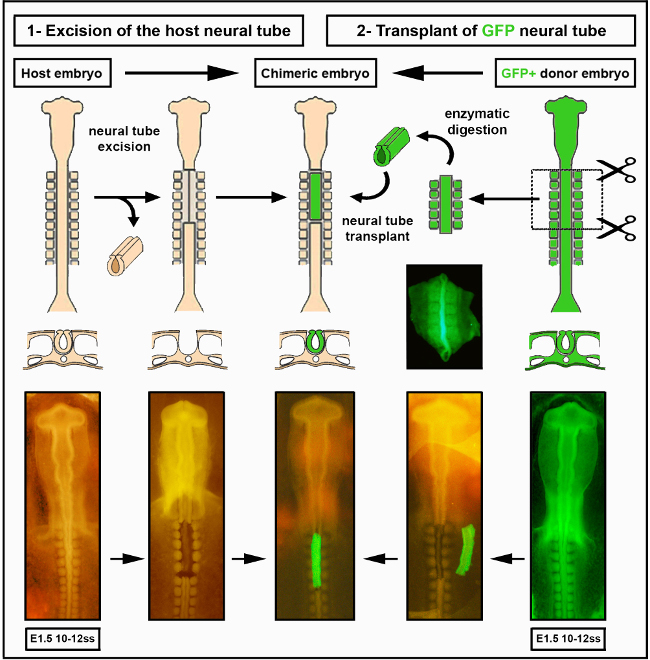
図 2.種内神経管移植. ひよこ胚/GFP神経管画像はデラランド らから変更された。12.腸管神経堤細胞による腸内植分化には血管形成が必要ない。 この図の大きなバージョンを表示するには、ここをクリックしてください。
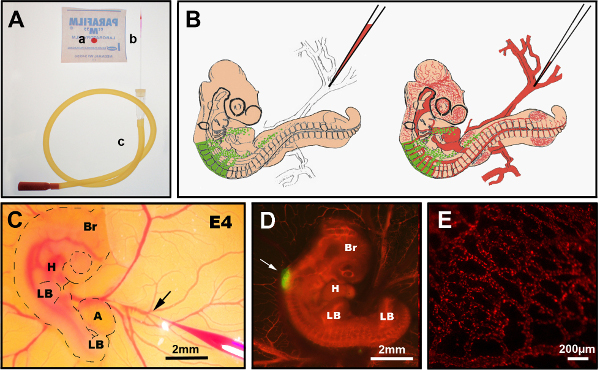
図 3.静脈内DiI注射。(A)推奨器具:a)セルトラッカーCM-DiIはパラフィルム上に落とし、b)引っ張られたガラス注射針、c)口管。(B)E4キメラひよこ胚への静脈内DiI注射の模式図。(c)ovo DiI静脈注射で静脈に挿入されたDiIを含む細かいガラス針(矢印)を示す。(D)E4キメラ胚ポストDiI注射(赤)GFP+ニューラルチューブ(矢印)を用いた。(E)DiIは、生きた胚、24時間の注射後に細かい血管ネットワークを染色した。Br: 脳;H: 心臓;LB:四肢の芽。A:アラントワ。(C)と(D)の画像は、デラランドらから変更されています。12腸管神経堤細胞による腸内コロニー形成には血管形成は必要ない。この図の大きなバージョンを表示するには、ここをクリックしてください。
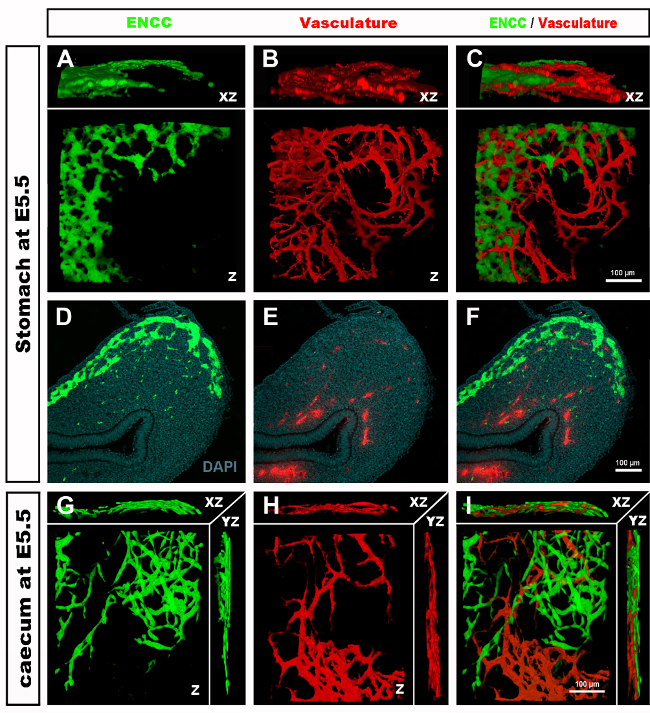
図4:E5.5のひよこ胚の胃および精液の代表的な結果。(A-C)(D)GFP+腸管性クレスト細胞(ENCC)を示す胃の領域における共焦点の3次元(3D)再構成(E)DiI染色された血管系と(F)両ネットワークの結合画像D-F組織学的切片を示す(G)DiI染色血管系と(I)両方の画像を合成した。核はDAPI(シアン)で染色される。(G-H)(A)GFP+ENCC移行前線を緑色で示すcaecum領域における共焦点画像スタックの3D再構成、(B)DiI染色された血管系を赤色で、(C)両ネットワークの結合画像を示す。 画像(A-F) はデラランドらから変更されました。12腸管神経堤細胞による腸内コロニー形成には血管形成は必要ない。この図の大きなバージョンを表示するには、ここをクリックしてください。
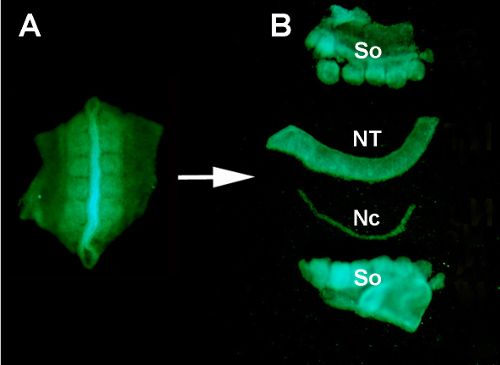
図 S1.酵素消化とマイクロ解剖による周囲組織からのドナーGFP+神経管 の分離。(A) GFP+ニューラルチューブ及び隣接するスマイトをドナー胚から解剖する。 (B) ステンレスミヌチエンピンを用いた膵臓消化およびマイクロ解剖後の神経管の分離。だから:スマイト。NT: 神経管;Nc: 脊索。
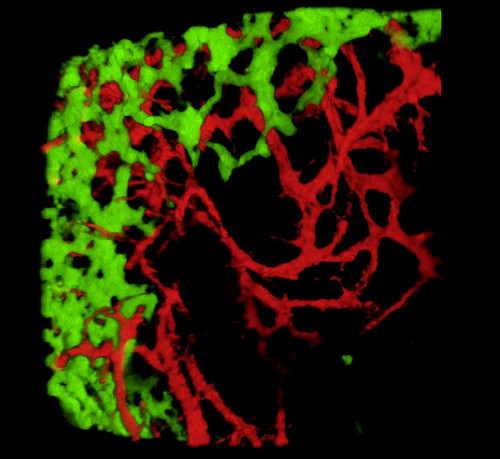
図4Cにおける画像の3次元360°回転を図1に、E5.5(HH27-28)で胃の血管系とENCCを示す。このビデオを見るには、ここをクリックしてください。
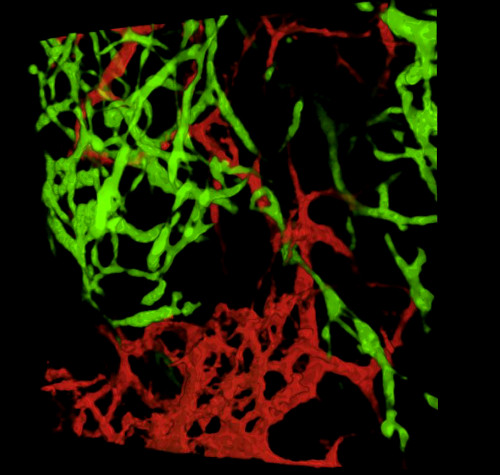
図4Iにおける画像の3次元360°回転を示す図2.E5.5(HH27-28)におけるcaecumの領域における血管系およびENCC移行前線を示す。このビデオを見るには、ここをクリックしてください。
ディスカッション
ここで説明する血管標識と組み合わせた、種内神経管移植の方法は、卵子内の鳥類胚のアクセスの容易さ(他の脊椎動物胚と比較して)を最大限に活用して、自律神経系(ENS)および血管系の要素の共発達を研究する。
NCC誘導体の標識に関して、我々が説明するひよこGFP-ひよこ種内移植法は、40年以上前に1-3で確立された古典的なウズラ・チック・キメラ法に対して多くの利点を有する。まず、FITC光の下では、GFP+細胞が生きたキメラ胚で容易に識別できる範囲で、GFP蛍光は非常に明るいです。これにより、移植片の成功をovoでチェックすることができ、ウズラひよこ移植は、移植片の成功を確認する前に、QCPNを使用して胚を殺し、処理し、免疫染色する必要があるのに対し、2。第二に、トランスジェニックチックGFPにおけるGFP発現は細胞質であり、したがって細胞体にラベルを付けるだけでなく、移植された細胞の投影も可視化することを可能にする22。これにより、複雑なニューロンネットワークを高解像度で観察することができます(サンプルが抗GFP抗体で免疫染色されたときに、微細な投影が最もよく視覚化されることに注意してください)。QCPN標識はウズラ細胞核に限定されるため、ウズラひよこキメラを使用してそのようなネットワークは明らかにされません。第三に、種内移植は、キメラ胚内の細胞間の潜在的な種差を排除する。ウズラ胚はひよこよりも潜伏期間が短いため(19日対21日)、ウズラ細胞はひよこ細胞よりも増殖率が高く、キメラ組織の発達に影響を与える可能性が示唆されている。興味深いことに、植物では、種間移植が宿主24におけるDNAメチル化パターンに広範な変化を生じさせる可能性が示されている。第4に、ひよこGFPは、NCC運命および細胞コミットメント25のようなトピックに対処するために、背中の移植実験を促進する。第5に、遺伝子導入性のチックGFPは、GFP+細胞亜集団のFACS選別、GFP+細胞を含む器官の組織的培養、発現プラスミド26のエレクトロポレーションによるGFP+移植組織の遺伝子操作、および光学投影トモグラフィー27などの他のイメージング技術を含む多くの他の技術にも有用である。
神経管移植アプローチは、より短い量の神経管を微小外科的に置換することによって変更することができる。神経管の小さなセグメントを使用することにより、マイクロサージャストは潜在的に胚にダメージを与えにくく、生存率を改善することができる。しかし、移植する神経管の少ない欠点は、宿主のGFP+NCCの数が減少することです。ユーザーは、胚の最適な生存を与えるために移植された神経管の量と、有益な結果を与えるために十分な宿主腸内のGFP + NCCの数とのバランスを試みることができます。
容器の塗りのために、DiIは蛍光が非常に明るく、強いという利点がある。また、最も優れた開いた毛細血管の染色を保証する固定中に拡散する能力を有する。それは重要な染料であるため、胚は注射手順を生き残り、染色された血管系で開発を続けることができます(私たちの手の中で最大24時間、染色は時間の経過とともにより穿刺されますが、 図3Eを参照してください)。したがって、DiI血管絵画との接木のひよこGFP の組み合わせは、ライブイメージングと互換性があります。これらすべての利点に加えて、血管注入は発光した血管のみを標識し、未開封の毛細血管、内皮先端細胞または単離された内皮細胞を同定しないことに注意することが重要である。しかし、鳥類の遺伝子導入のさらなる進歩は、Tg(tie1:H2B-eYFP)ウズラ胚を使用して血管形態形成を研究する実験によって例示されるように、そのような問題を回避する新しい方法を提供することができる。この技術のもう一つの制限は、E7.5以降の胚に効果的な血管標識のために、より多くの量の染料を注入する必要があり、実験を高価にすることができるということです。しかし、この技術の変更には、蛍光ペンインク14を使用した低コストの血管標識が含まれる可能性があるが、このアプローチは我々の手では試みられていない。
手順の重要なステップは、ブラストディスクの下にインクを注入することによって胚を視覚化するプロセスを含む。この段階で黄身を覆う膜がインクで満たされた針によって引き裂かれると、胚の生存が著しく損なわれる。また、ドナー神経管を調製する際に、組織が膵臓で過度に長時間放置されないことが重要である(最大として約10分を考慮する)。膵臓への長期暴露は組織に損傷を与え、神経管は処理が困難であり、宿主にうまく組み込まれません。キメラ胚を注入する前に、キメラ胚に対するDiI注射技術の経験を得ることは、一般的に各胚に対して1回の注射しか可能であるため、不可欠である。DiIの容積および針の直径は各胚のための重大な変数であり、野生のタイプ、ステージ一致した制御で査定されるべきである。
結論として、生きたひよこ胚における神経管移植とDiI血管塗装の二重標識法は、器官形成中のNCCと血管ネットワークの相互関係を調べるのに使用できる。臓器の開発中に正しい標的のインナーゼーションと血管化を確立するメカニズムはまだほとんど知られていないので、この方法論は、この分野における将来の発見の可能性を秘めています。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
受精したGFP鶏卵は、ヘレン・サン教授、ロスリン研究所、英国エディンバラ大学によって供給されました。ロスリントランスジェニックチキン施設は、ウェルカムトラストとバイオテクノロジー生物科学研究評議会(BBSRC)によって資金提供されています。この作品は、グレート・オーモンド・ストリート病院児童慈善団体(ロンドン、英国)が一部資金提供を受け、NTが支援しました。著者らは、移植のための胚の準備に協力してくれたUCL小児保健研究所のベン・ジェバンズに感謝する。
資料
| Name | Company | Catalog Number | Comments |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5 ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24 mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
参考文献
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved