Method Article
胚性マウスの心臓に免疫蛍光を用いて、心筋細胞の開発の分析
要約
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
要約
心臓発生時には、心筋の固有の構造的および機能的サルコメア、収縮筋原繊維、インターカレートされたディスクを含む単位、及びcostameresの生成は、時間と空間内の複数のコンポーネントの協調組み立てが必要です。これらの部品の組立の中断は、発達心臓の欠陥につながる。免疫蛍光染色技術は、筋原線維の成熟を プローブするために、培養心筋細胞において一般的に使用されているが、これをex vivoアプローチが筋細胞が完全に、培養物中の生体内の正常な機械的入力の欠如、及び心内膜の手がかりが存在しないことを差別化するため程度によって制限される。マウス心臓の開発の研究に免疫蛍光技術の適用が望ましいが、より技術的に困難であり、及び方法は、多くの場合、心臓発生の初期段階での筋節を可視化するのに十分な感度と分解能を欠く。ここでは、共免疫染色μに対して堅牢で再現性のある方法を記載ltipleタンパク質または胚性マウス心臓における免疫蛍光染色で同時可視化する蛍光タンパク質へと筋原、介在板、およびcostameresの開発を分析するために、このメソッドを使用します。この方法はさらに、発育心臓欠陥につながる突然変異によって引き起こさ心筋の構造的変化を評価するために適用することができる。
概要
開発中は、心臓の収縮は心筋細胞が正中線に移行し、線形心管1,2を形成した直後に始まる。サルコメアは、心筋細胞内の基本的な収縮単位です。この高度に組織化された細胞骨格構造は、Mライン( 図1)に固定された筋節αアクチニン(S-αアクチニン)とミオシン繊維によってZ-ディスクに固定されたアクチンフィラメントが含まれています。心筋細胞が成熟するにつれて、筋節は、セルにまたがる筋原繊維を形成するために直列に組み立てる。筋原線維は、N-カドヘリンのような接着結合タンパク質は、介在板などの-αアクチニン3としてZディスク要素のサブセットとの過渡的接合を含む細胞-細胞接合構造により心筋の両端に固定されているおよびβカテニン、ギャップ結合タンパク質、およびデスモソーム( 図1)4。縦膜、また、末梢筋原繊維のZディスクに沿ってcostameresを介して細胞膜に付着する。これらの特殊接着斑は、心筋細胞( 図1)4に追加の構造的支持を提供するために、筋原線維、原形質膜および細胞外マトリックスとの間のアンカーを提供する。初期の心臓発生において、心筋細胞、心室の空間に突出しており、比較的成熟した筋原繊維5を含む小柱として知られている指状突起に配置されている。心臓の開発が進むにつれ、サブ心外膜領域中の心筋細胞は、心室壁を含むが、筋節および筋原アセンブリは小柱心筋5,6と比較して遅延され、コンパクトな心筋層を形成するために増殖する。
サルコメアと筋原線維アセンブリのモデルは単純であるが、三次元環境、血流、および他の心臓細胞との接触を欠く培養心筋7-10、上の免疫蛍光研究から主に来る生体内に存在するのです。マウス胚中心部に免疫蛍光を用いて、高分解能の構造研究は、技術的に困難であり、いくつかの研究では、マウス心臓の開発中に介在板とcostameresの出現を検討している。カテニンβ接着結合タンパク質は17.5 11日胚(E)で介在板に局在することが表示され、N-カドヘリンは、生後0日13対E18.5 12によって介在板を表してもよい線状構造に局在し、costameresがで検出されましたE18.5 14が、これらのタンパク質は、以前の発達時点で11-13を拡散し、より連続的な膜分布を表示する。
ここでは、intercalaの出現など、筋原線維と心筋細胞の開発の詳細な分析が可能に区分されたマウス胚の心、の免疫染色および蛍光顕微鏡検査のための簡単で再現性のある方法を説明テッドは早けれE12.5とE16.5で発生期のcostameresとしてディスク。このプロトコルは、筋節形成ならびに筋原線維および心筋細胞成熟に対する変異の効果を精査するために有用であり得る。
プロトコル
注:すべての実験手順は、UCSF機関動物実験委員会によって承認された。
1.凍結保存胚マウスハーツの固定。
1.1)は、胚の心をスナップ凍結
- 最適な切削温度で3.5センチメートルペトリ皿と7ミリメートルcryomoldsフィル(OCT)培地(材料表を参照)。化学フード内で、液体窒素中で2-メチルブタンを冷却する。
- 3.5センチメートルペトリ皿に10センチメートルペトリ皿、10mlのPBS中にリン酸緩衝生理食塩水(PBS)の30ミリリットルを分配し、氷の上ですべてのペトリ皿を置く。 1 10cmディッシュや妊娠中のマウスあたり数3.5センチメートル料理を準備します。
- 以前に氷冷PBS中で解剖を行い、15を説明されているように胚を分離します。
- 簡単に言えば、CO 2ナルコーシスと頸椎脱臼を使用して妊娠した女性を安楽死させる。
- 、腹部の切開を行いALO血管を切断することによって子宮を解剖する子宮の内側の曲率ngを、氷冷したPBSを含有する10cmのペトリ皿に子宮を転送する。
- 氷冷PBSを含む個々の3.5センチメートルペトリ皿に各胚と転送の間で子宮をでカット。 15を説明するように各胚を分離します。
- 、細かい鉗子を用いて心膜腔を開き大動脈、下大静脈、及び肺静脈で切断することにより、離れた肺や血管系から心臓を削除し、10月を含む3.5センチメートルペトリ皿に移す。
- 心はその後10月を含む7ミリメートルの金型に心を移す、数秒間10月に平衡化しましょう。金型の底に、心臓の前壁を方向付ける。
- 静かに液体窒素で冷却した2-メチルブタンに金型を置く。 10月または心に触れる2-メチルブタン液体を許可しないように注意してください。 10月は、その後ドライアイスを含む氷のバケツに金型を転送し、白色の固体になるまで凍結。次の胚に移る。
- WRAPは、凍結切片直前まで、-80℃で箔とストアにcryomolds。
1.2)代替:ホルムアルデヒド(PFA)は、固定、凍結保護、そして10月には、胚の心を埋め込む
- 1×PBS中の4%PFAで12ウェル組織培養プレートのウェルを満たす。
- 1.1.3で説明したように、胚心を解剖。よく含む4%PFAにそれぞれの心を置き、4℃CO / Nで固定してください。
- 凍結保護:プラスチック製のトランスファーピペットを用いて、PBS中の15%ショ糖1.5 mlを含有する1.5ml微量遠心チューブに、各心臓を移動し、心臓がチューブの底に沈むまで、穏やかに4℃で攪拌する(O / Nに数時間)。 PBS中30%スクロースの1.5ミリリットルを含む1.5 mlのマイクロチューブに各心を移し、静かに心がチューブの底(O / Nに数時間)に沈むまで、再び4℃で攪拌する。
- プラスチック製のトランスファーピペットを用いて、凍結保護のOCTに心を配置し、それを平衡化させ数分間10月を含む7ミリメートルの金型に心を移すその後、過剰ショ糖を除去する。金型の底に、心臓の前壁を方向付ける。
- 液体窒素で冷却した2-メチルブタンまたはドライアイスいずれかで金型を配置することにより、10月中に心をフリーズします。
- 凍結切片のための準備ができるまで-80℃で箔とストア内cryomoldsを包み。
2.凍結切片化
- -17℃に設定しクライオスタット温度。
- 場所はクライオスタット室にcryomoldsと15〜20分間温度と平衡。
- クリオモールドを反転し、金型から心ブロックを追放するために穏やかな圧力を使用しています。成形された組織ブロックの先頭に、心臓の前壁を方向付ける。
- チャック上に10月の大幅な低下を置き、チャック上に凍結する10月のドロップに心ブロックをマウントします。心臓の前壁がチャックから遠いような向きにしてください。
- チャックをロードし、彼に搭載クライオスタット物体ホルダ上アートブロック。刃の角度はサンプルの相対3-5°になるように調整します。
- (材料表を参照)正に帯電したコーティングで前処理された顕微鏡スライド上に10μmの切片を収集する。 -80℃で保存する前に完全に乾いてから。
3.免疫蛍光
- スナップ凍結切片のために、修正し、室温で換気フード中で10分間、アセトン中で組織を透過性。
- スナップ凍結し、PFA固定セクションは、OCTを除去するために20分間、PBS-0.1%トリトンX-100中でインキュベートし、PFA固定切片を透過する。
- PBSで希釈した1×ブロッキングバッファー中で45分間ブロック、。
- RTで45分間、PBS-0.1%ツイーン20 100(説明を参照)、マウスで生成された一次抗体を使用した場合、ロバ、またはヤギ抗マウスIgG(H + L)1に希釈した一価のFab断片でインキュベートする。
- RTで2時間1×ブロッキング緩衝液で希釈した一次抗体または抗体でインキュベートするかO / 4℃でN(特定の希釈用材料/機器の表を参照)。
- 室温で10分間、1×PBSで3回セクションを洗う。
- 1希釈したアレクサフルオロコンジュゲート二次抗体でインキュベートする:500を光から保護し、室温で2時間、ブロッキング緩衝液中。
- 光から保護し、室温で10分間、のための1×PBS中で3回のセクションを洗う。
- オプション:PBSですすぎ、その後、核を標識するためにRT(光から保護された)でPBSに2000:ヘキスト染料でインキュベート1に希釈。
- RTで1分間、1%PFA中で後固定しラベルセクション。
- (核が既に標識されていない場合はDAPIで)マウントスライドの各端部に、媒体の2滴を配置し、次にカバーガラスで覆うことにより、抗退色培地中で摺動する。シールはマニキュアでカバースリップ。ストアは、画像への準備が整うまで4℃で光から保護した。
4.共焦点イメージングと画像解析
- 適切なレーザ波長、カメラ、共焦点顕微鏡株式会社の電源をオンにステージ移動及びZモータをluding。イメージングソフトウェア·プログラムを起動します。それぞれ、Hoechst-、アレクサ488、およびAlexa 568染色切片を画像化するため405、488、および561レーザー波長を使用してください。
注:私たちのハードウェアとソフトウェアの仕様のための材料の表を参照してください。 - スライドステージ上(倒立顕微鏡用ダウンカバースリップ)コントロールスライドをマウントします。
- 4倍対物レンズを用いて、(材料表を参照)をサンプルと関心領域を見つける。高倍率で撮影する場合にマップとして使用する画像をキャプチャします。
- スライドステージに最小限の調整を行う、スライドを削除します。スライドステージ上に(下にカバースリップ)60X油浸対物レンズに変更します(材料表を参照)を、客観的に油の小滴を配置し、スライドを交換してください。
- 再びサンプルを検索します。各チャンネルに対する所望のレベルまでレーザパワー、露光時間、ビニングを設定する。
注:我々は、一般的に、レーザー0.8のパワー、100ミリ秒のカメラ露光時間、及び2のビニングを使用します(SE電子材料表)ハードウェアおよびソフトウェアの仕様については、最適な設定は、各実験のために経験的に決定する必要がある。- 最適な設定が決定されると、実験内のすべての組織切片のために同じ設定を使用。 (この情報は解析のために使用される)チャネルごとに最適な強度範囲に注意する輝度ヒストグラムを使用する。
- 中央のzスタックの上限と下限を選択し、適切なレーザー·チャネルを選択し取得機能を使用してのzスタックを生成する。ソフトウェアによって提供される光学スライス厚の半分の値であるのzスタックステップサイズを選択する。画像を収集するために「実行」をクリックしてください。
- フィジー16または画像解析のための同等のプログラムを使用します。フィジーの中では、カスタムカラーモードオプションと別のウィンドウに分割チャンネル付きのZスタックファイルを開きます。画像プルダウンメニューから、「調整して明るさ/コントラスト」ツールを開きます。各チャネル内で、よら最適なヒストグラム強度範囲は、4.5.1で決定。分析されているすべてのzスタックにこれらのチャネル範囲を適用します。
- イメージ - >カラーのプルダウンメニューを使用して単一の合成画像に個々のチャネルをマージします。
- イメージ - > Stacks-> Zプロジェクトメニューを使用して合成画像から平坦化されたZスタックを作成します。この画像は、3D画像よりも著しく明るいであろう。過飽和を回避するために、対照試料のヒストグラムの強度範囲を調整し、実験的に同じ設定を適用するのzスタックを平坦化する。
- 3D画像を生成するには、最初のイメージ- > Stacks-> 3Dプロジェクトメニュー17を使用しています。 x軸や回転のy軸のいずれかを選択します。のzスタックステップサイズミクロンの同じ数とスライス間隔を設定する。所望の全回転を選択して、プラグインプルダウンメニューから画像J 3Dビューアを開く1に回転角度の増分を設定します。ボリュームとしてコンポジット4.8で生成された画像は、ディスプレイを選択し、再設定する1または2に係数をサンプリング。
結果
図急速冷凍し、アセトン固定心臓内の異なるタンパク質の共染色のために2〜6ショー典型的な結果。高い特異性及び最小のバックグラウンド( 図2A、3A、4A、5A、6Aおよび6C)とのsαアクチニン再現可能に標識されたZディスクと介在板に対する抗体; 図6は、抗マウスIgG(H +ことを実証しているL)の一価Fab断片を効果的にブロックは、内因性のマウスIgG抗マウス二次抗体による結合。カテニンβ接着結合タンパク質に対する抗体は、心筋細胞と非心筋細胞の両方の膜に結合した、とから予測されるように、S-αアクチニンとの共局在は、E16.5( 図2CおよびD)で推定される介在板で発生した成人の心臓18におけるβカテニンの染色パターン。 β胚の心臓内の1インテグリン免疫蛍光は特に困難であり、多くの場合、焦点接着14を識別するために失敗しますが、これらの研究におけるβ1インテグリン染色は、おそらくで形成初期のcostameresを反映して、S-αアクチニン標識Zディスクと同じ周期で信号を明らかにしたE16.5( 図3D)。
E12.5では、S-αアクチニンとトロポミオシン(サルコメア細いフィラメントタンパク質)免疫蛍光は、これらの細胞中で成熟した筋原繊維と一致小柱心筋細胞における定期的な周期性を持つ染色パターンS-αアクチニンのため( 図4Aおよび5Aを明らかにした。 図4Bトロポミオシンのため)。おそらく介在板を表すE12.5の心で小柱心筋細胞におけるN-カドヘリン染色は強烈なS-αアクチニン染色の領域(C - - Dと図6A図5B)と共局在する傾向があった。で小柱筋細胞にコントラスト、コンパクトゾーンにおけるs-ブチルαアクチニンは、線形よりも点状であって、トロポミオシン染色は、拡散ではなく、直線であった( 図4Aおよび4B)。このように、サルコメアアセンブリは、小柱心筋に比べてコンパクトで後発生する可能性があります。さらに、コンパクトなゾーンにおけるS-αアクチニンとトロポミオシンの差動パターンが細いフィラメントへの取り込みを、トロポミオシンが筋原線維組み立ての後のイベントかもしれないが、そのよ-αアクチニンは、涙点と早期未熟Zディスクに整理し提案する。
図7、映画1、ムービー2は、PFA固定E12.5胚の心からの典型的な結果を示しています。これらの例では、LifeAct-RFPrubyトランスジェニック胚は、イメージングのために使用した。 LifeAct-RFPruby導入遺伝子19のラベル繊維状アクチンが、PFA固定を必要とします。 S-αアクチニンで標識Zディスクは、ほとんどの地域で視覚化するのは簡単だったが、信号対雑音比がdecreた急速凍結する心臓切片( 図7A)と比較ASED。この信号がエピトープは、タンパク質の相互リンクによってマスクされていてもよいPFA固定組織、中のS-αアクチニンの免疫蛍光のための典型的なものであった。 図7Bは、繊維状アクチンの共同可視化を示しており、筋原繊維(矢じり)内のS-αアクチニン免疫標識と小柱筋細胞(矢印)に隣接する心内膜細胞内の繊維状アクチン。三次元画像再構成は、追加の詳細を明らかにした:個々の心筋細胞をより容易に識別された、心筋細胞内の筋原繊維が互いに略平行であったが、個々の心筋細胞は、 図7CおよびD、映画1、ムービー2(互いに対して様々な角度で配向し)。心内膜細胞と心筋細胞との間の密接な近似がより良いだけでなく、3次元のビューで高く評価された。
">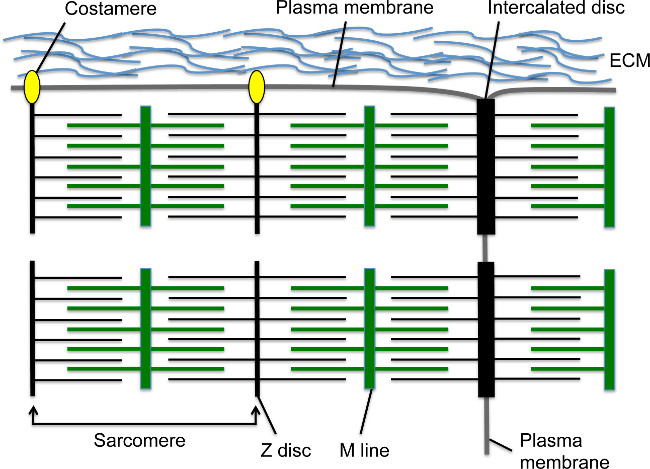
図1心筋サルコメア、介在板、及びcostameres Mラインがアクチンフィラメントと重なるミオシン繊維、アンカーた。Z-ディスクは、アクチンフィラメントを固定する。 Mライン - - Z-ディスク装置サルコメアは1 Z-ディスクを備えている。シリーズ内の複数の筋節は、筋原繊維を作成します。特殊化した細胞間接合構造における心筋の横方向の境界に筋原インサートの横方向の端部は、介在板と呼ばれる。周辺筋原繊維は、心筋細胞間の細胞外マトリックスとの接着斑を形成costameres、経由縦心筋細胞の原形質膜に接続します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
PLOAD / 52644 / 52644fig2.jpg "/>
図2. S-αアクチニンと胎生16.5でβカテニン免疫蛍光。心が切除し、スナップ凍結し、凍結切片、アセトン固定、およびS-αアクチニンに対する(A)マウスモノクローナルクローンEA53抗体を用いて免疫染色し、そのラベル心筋細胞のZディスクと介在板、及びカテニンβ接着結合タンパク質に対する(B)ウサギpolycloncal抗体。(C)マージされた画像は、S-αアクチニンとβカテニン染色を示す。(D)倍拡大パネルCからの関心領域を。アスタリスクは、S-αアクチニンとβカテニンの共局在と推定される介在板をマーク。画像は、パネルAC左上の心外膜層と、周辺左心室壁またはコンパクト心筋から得た。強度ヒストグラム表示範囲460から1600(O出F可能0〜65535)の両方のS-αアクチニン/ 488 nmおよびβカテニン/ 561 nmのレーザーチャネルのため。スケールバーは10μm。 この図の拡大版をご覧になるにはこちらをクリックしてください。
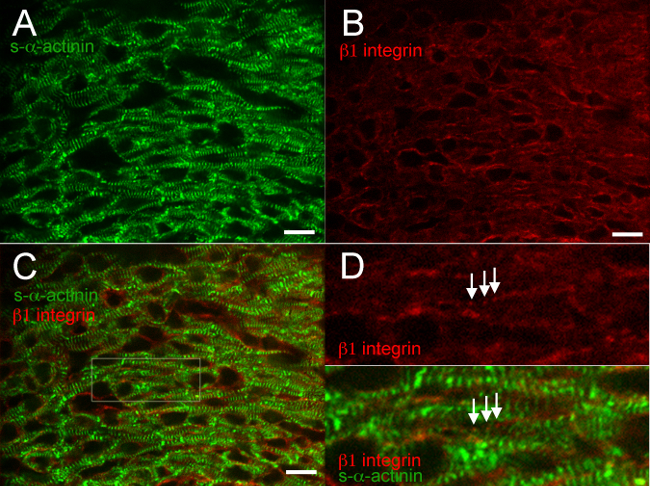
図3. S-αアクチニンと胎生16.5で1インテグリン免疫蛍光をβ。心臓が摘出し、スナップ凍結し、凍結切片、アセトン固定、およびS-αアクチニンに対する(A)マウスモノクローナルクローンEA53抗体を用いて免疫染色し、 (B)インテグリンβ1焦点接着タンパク質に対するヤギポリクローナル抗体(C)マージされた画像は、心筋細胞におけるβ1インテグリンならびに非心筋細胞を示す。両方のびまん性に注意し、。心筋細胞におけるインテグリンシグナルβ1点状(D)は 、パネルC.ノート点状、Zディスクで近くのS-αアクチニン染色と同様の周期で定期的β1インテグリン染色(矢印)から関心領域に拡大した。これらの構造はcostameresを表すことができる。画像は、左心室コンパクト心筋から得た。 β1インテグリン/ 561 nmのレーザーチャネル用のS-αアクチニン/ 488nmレーザーチャネルと460から600のために(可能0-65535外)強度ヒストグラム表示範囲460から1200。スケールバーは10μm。 この図の拡大版をご覧になるにはこちらをクリックしてください。
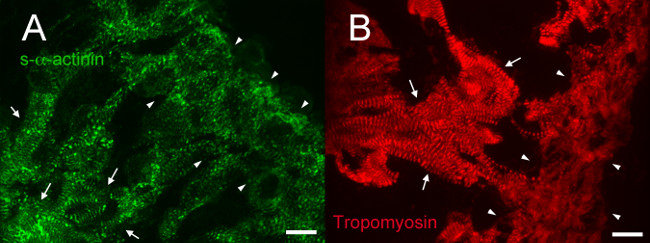
図4. S-αアクチニンと胎生12.5でのトロポミオシンの免疫蛍光:筋原線維組織内小柱コンパクト心筋。同腹子胚から心臓を摘出したが、凍結し、凍結切片をアセトンで固定し、そして筋原細いフィラメントに対して複数-αアクチニンおよび(B)マウスモノクローナル抗体に対する(A)マウスモノクローナルクローンEA53抗体を用いて免疫染色したスナップタンパク質トロポミオシン(発達研究ハイブリドーマバンクCH1)。小柱(矢印)とコンパクトな心筋(矢頭)が示されている。緻密層(A)中の涙点並びに線状染色などの染色パターンの範囲と比較して小柱心筋の通常周期性を有する線状の-αアクチニン染色を、注意してください。また、コンパクトな心筋における小柱心筋における定期的な周期性が、よりびまん性染色を有するリニアトロポミオシン染色に注意してください。 S-αアクチニンチャネルとトロポミオシンチャネル用460-1,000用(0〜65535の可能な外)強度ヒストグラム表示範囲460-1,400。スケールバーは10μm。「https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
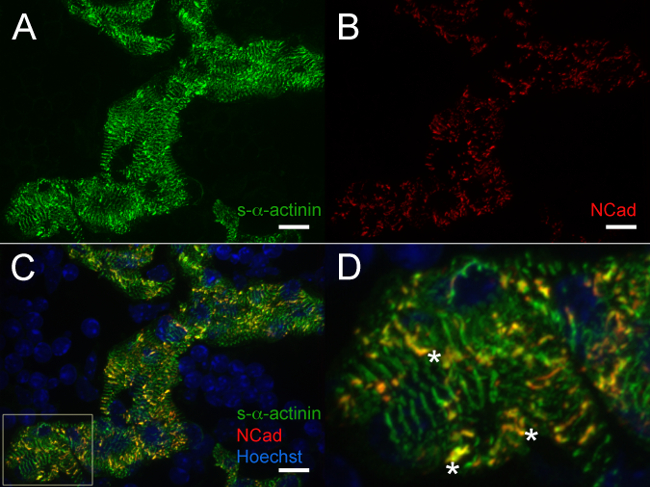
図5. S-αアクチニンと胎生12.5でのN-カドヘリンの免疫蛍光:小柱心筋細胞における筋原繊維と介在板の心は切除し、スナップ凍結し、凍結切片、(A)マウスモノクローナルクローンEA53を使用してアセトン固定し、免疫染色S-αアクチニンと焦点接着タンパク質N-カドヘリンに対する(B)ウサギポリクローナル抗体に対する抗体。 0.2μmの光学切片をzスタックとして収集し、およびzスタックは、画像を生成するために平坦化された。(C)合併平坦化スタックが小柱心筋細胞内のN-カドヘリンおよびs-αアクチニン染色の両方を表示ワットとしてエルパネルCから関心のヘキスト色素で標識された核(D)倍拡大領域として。アスタリスクは、S-αアクチニンとN-カドヘリンの共局在と介在板をマーク。 S-αアクチニン/ 488 nmおよびN-カドヘリン/ 561 nmのレーザーチャネルの両方のためのヘキスト/ 405nmのレーザーチャネルのための(可能0-65535外)と470-2,000強度ヒストグラム表示範囲470-1,200。スケールバーは10μm。 この図の拡大版をご覧になるにはこちらをクリックしてください。
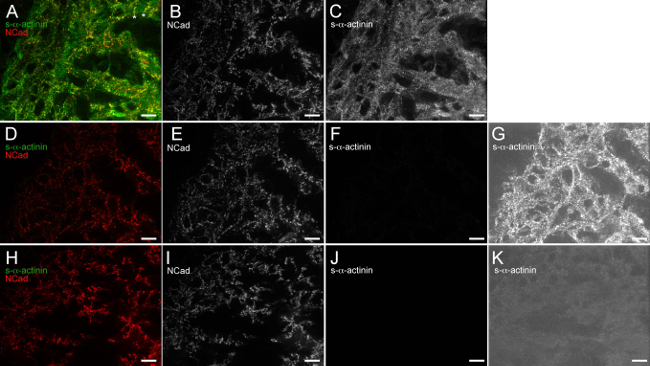
図6.抗マウスIgG(H + L)の一価Fab断片を効果的にブロック内因性マウスIgG抗マウス二次抗体による結合。E12.5の胚の心臓を摘出し、凍結し、凍結切片、アセトン固定し、免疫染色凍結した。 (AC)切片を、抗マウスIgGの一価Fabフラグメント、N-カドヘリンに対するs-ブチルαアクチニンおよびウサギポリクローナル一次抗体に対するマウスモノクローナル抗体クローンEA53一次抗体に曝露し、洗浄し、露出し、続いて1×のブロッキング緩衝液アレクサフルオロ488抗マウスおよびアレクサフルオロ586抗ウサギ二次抗体に。輝度ヒストグラム表示範囲480から2500を使用して、(A)合成画像(可能0-65535外)。 N-カドヘリン信号はおそらく初期の介在板を表し小柱心筋細胞の横方向端に制限されているアスタリスクノート領域。強度ヒストグラム表示範囲480-2,500を使用して、(B)N-カドヘリン専用チャンネル。(C)S-αアクチニンのみの輝度ヒストグラム表示範囲480-2,500を用いてチャネル(DG)、切片をウサギポリクローナル抗体に曝露し、1×ブロッキングバッファーのみ (抗マウスIgGの一価Fabフラグメントブロッキング工程)でブロックしたN-カドヘリンのみ(マウスモノクローナル一次抗体)、洗浄し、アレクサフルオロ488抗マウスおよびアレクサフルオロ586抗ウサギ二次抗体に曝露した。(D)に対する一次抗体は、輝度ヒストグラム表示範囲480から2500を使用して画像を合併。 (E)N-カドヘリンのみの輝度ヒストグラム表示範囲480から2500を使用してチャネル。(F)S-αアクチニンのみの輝度ヒストグラム表示範囲480-2,500を使用してチャネル。(G)S-αアクチニン専用チャンネル使用抗マウスIgGの一価Fabフラグメントブロッキング工程の非存在下で内因性のマウスIgGのバックグラウンドの検出を明らかに高感度輝度ヒストグラム表示範囲480から530は、(HK)切片を、抗マウスIgG、続いて1×のブロッキング緩衝液一価のFab断片は、N-カドヘリン(非マウスモノクローナル一次抗体)、洗浄に対するウサギポリクローナル一次抗体に曝露し、アレクサフルオロ488抗マウスおよびAにさらさのLexAフルーア586抗ウサギ二次抗体。(H)輝度ヒストグラム表示範囲480-2,500を使用して、イメージ合併。(I)のN-カドヘリンのみの輝度ヒストグラム表示範囲480-2,500を使用してチャネル。(J)S-α-actinin-抗マウスIgG背景内因性のマウスIgGの検出の欠如を示している高感度輝度ヒストグラム表示範囲480から530を用いて、輝度ヒストグラム表示範囲480-2,500を使用して唯一のチャネル(K)の-αアクチニン専用チャネル一価Fab断片ブロッキング工程が使用されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
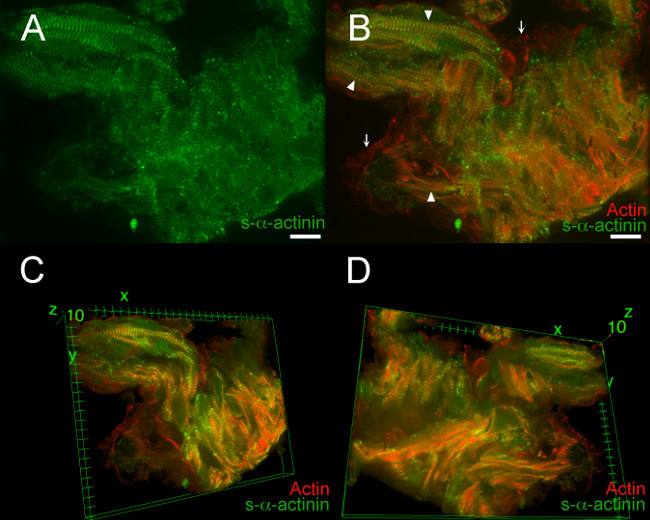
図7. S-αアクチニンと小柱カルディにおけるアクチンの組織s-ブチルαアクチニンに対するマウスモノクローナルクローンEA53抗体はZディスクと介在板を標識するために用いたが、胚12.5日でomyocytesはLifeAct-RFPrubyジェニックマウス系統は、繊維状アクチン19を可視化した。胚は、PFA-固定した。 0.2μmの光学スライスはAZスタックとして収集した(A)のzスタックをフラット化することだ-αアクチニン染色は、スナップ凍結し、アセトン固定部( 図2から5)に比べてPFA-固定組織でより拡散した示しています。。(B )は、zスタックが繊維状アクチンとS-αアクチニンの両方を示していますフラット化。筋原繊維内のZディスク(矢印)との間でローカライズされた繊維状アクチン蛍光。繊維状アクチン蛍光はまた、小柱筋細胞(矢印)をライン心内膜細胞で見られた。(C)は、スタックの一番上から見た小柱心筋細胞の三次元図、(D)の3次元ビュースタックの底から見た小柱心筋細胞、。両方の488nmレーザーチャンネルおよびAとBにおける561 nmのレーザー·チャネルのための(0〜65535の可能な外)強度ヒストグラム表示範囲470から900。 C、Dのスケールバーは10μmで両チャンネルの表示範囲460から800。 この図の拡大版をご覧になるにはこちらをクリックしてください。
映画 1。 S-αアクチニンと胎生12.5で小柱心筋細胞におけるアクチン組織の360°回転3Dビュー。図6から画像スタックは、フィジー画像解析プログラム内の画像J 3Dビューアプラグインを使用して3次元でレンダリングされました。 488 nmおよび561 nmのレーザーチャネルの両方のために(0〜65535の可能な外)強度ヒストグラム表示範囲470から800。
映画 2。胎生12.5日における小柱心筋細胞におけるs偏αアクチニンおよびアクチン組織の選択した立体図である。図6の画像スタックフィジー画像解析プログラム内のイメージJ 3Dビューアプラグインを使用して立体的にレンダリングされた。 X、Y、Z軸の周りの小さな回転は比較的心筋細胞が、ほとんどの心筋細胞間の配向不良の中筋原繊維を整列を示した。小さな回転はまた、心筋細胞の周りにS-αアクチニンを欠いている心内膜細胞の密接な近似を実証した。強度ヒストグラム表示範囲470から800 488 nmおよび561 nmのレーザーチャネルの両方のために(可能0-65535外)。
ディスカッション
最適な組織固定技術と希釈は、経験的に各抗体について決定しなければならない。私たちの手では、スナップ凍結がs-αアクチニン、βカテニン、β1インテグリン、トロポミオシン、タリン(図示せず)とN-カドヘリンを含むいくつかの心筋細胞の抗原に対するPFA固定よりも優れている。対照的に、PFA固定焦点接着キナーゼに対して優れた結果をもたらす(図示せず)。 PFAによって形成されたタンパク質架橋はエピトープをマスクし、抗体結合を制限することができる。抗原回復は、このような場合に必要とされてもよく、抗原回復のための方法は、他の場所20に見出すことができる。 PFA濃度または固定の長さは、経験的に各抗体について、各発達段階で決定された最適な条件で、エピトープのマスキングを低減するために低減することができる。新規抗体または心臓変異を特徴付ける際に適切な陰性対照は、一次抗体対照と「一次抗体なし「共として免疫前血清を含む、使用されるべきであるntrol。ノックアウトマウスの使用が理想的な陰性対照であるが、初期の致死性は、ここで研究されている遺伝子産物の多くはそれらの使用を妨げる。
スライドの穏やかに揺らしがソリューションへのセクションの均一な露光を確保するために、インキュベーション中にあったように、完全に同じ免疫蛍光ブロッキング、抗体、および洗浄溶液で実験およびコントロールスライドを沈めるために十分なボリュームの使用が重要であった。このアプローチは、実験内のセクションとスライドの間に染色技術的変動性を最小限に抑える。コストは、抗体溶液の容量を制限する際に、組織切片を超えたソリューションの流れを制限し、長いインキュベーション中に加湿チャンバー内でスライドを保持するためのPapペンを使用する。マウスモノクローナル一次抗体 - と、したがって抗マウス二次抗体は、 - 使用され、内因性のマウス免疫グロブリンを覆うように第二のブロッキング工程は、非特異的バックグラウンドシグナルを減少させる(ステップ3.4)が必要となる。
適切な顕微鏡と画像処理技術は、生物学的に正確な情報21を得るために重要である。各色について - (16ビット画像65535レベル0)強度ヒストグラムは、各輝度レベルの画素の分布を示す。背景、明るさ、コントラスト、ヒストグラムのピークに隣接する強度表示範囲を設定することにより調整することができる。条件間の有効な比較を行うために、制御および実験条件の間に同じ設定を使用する必要があります。
このプロトコルは、ネイティブのマウス胎児の心臓に心筋細胞の成熟と発展を分析する信頼性の高い方法を提供する。心筋細胞特異的タンパク質の免疫蛍光は、しばしば、開発中に心筋細胞をマークするために使用されているが、いくつかの研究は、筋原線維構造と介在板とcostameres 12-14,22,23の出現の高分解能分析を可能にする技術を使用する。この技術は、 ます。vで使用することができ構造的異常のメカニズムを解明することができる心筋細胞の成熟の変化を同定する手段として、発育心臓欠陥を引き起こす突然変異の評価をIVO。
開示事項
The authors have nothing to disclose.
謝辞
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
資料
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
参考文献
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved